IL-17在肝癌患者血清中表达增高对肝癌诊断的研究
2014-10-11范莎莎李爱民陈逢生张军一罗荣城
范莎莎,李爱民,李 荣,陈逢生,张军一* ,罗荣城*
(1.南方医科大学,a.中西医肿瘤中心,b.中西医结合医院,中国 广州 510315;c.南方医院,中国广州 510515;2.湖南省人民医院临床医学研究所,中国 长沙 410005)
肝细胞癌(Hepatocellular Carcinoma,HCC)是最常见的肝原发恶性肿瘤,因为发病率较高、发现困难、治疗方法少等原因,在导致人类死亡的各种疾病中位居前列[1].目前,原发性肝细胞癌在全球范围内致死率位列第五位,而在一些非洲和亚洲国家,原发性肝细胞癌在肿瘤性死因中已经位居首位[2-3].肝癌早期转移和术后复发是肝癌患者生存率低的主要原因.目前有效的肝癌诊断标志物寥寥无几,当前的检测技术仍然不能及时发现和有效检测早期阶段的肝癌[4-5].
超声和AFP检测是最常用的筛查肝癌方法,然而超声检测依赖于医师的专业知识和设备实际灵敏度,难以对肿块的良恶性予以评估和诊断.AFP被认为是用于筛查和早期诊断肝癌最实用且可行的方法,40% ~60%HCC患者的AFP值增高,然而还有很大一部分肝癌患者其AFP值没有增高[6-7],因此AFP用作唯一的工具来诊断肝癌仍然存在较大的漏诊率[8-9].
IL-17具有促肿瘤生长、转移的作用.动物实验研究表明IL-17具有促进多种肿瘤生长的作用,这些肿瘤包括纤维肉瘤、结肠癌、皮肤癌、非小细胞肺癌等[10-12].研究认为IL-17能通过聚集血管内皮细胞而促进肿瘤血管的形成,也能促进成纤维细胞产生血管内皮生长因子、前列腺素、趋化因子、巨噬细胞炎性蛋白2,转化生长因子的产生促进肿瘤细胞的粘附和运动,为肿瘤血管的形成和癌细胞播散提供条件[12-13].
基于以上IL-17与肿瘤和肝癌的各种相关报道,结合已有的AFP的临床价值,检测IL-17在肝癌血清中的表达情况及评估与AFP的相关性显得非常有意义,这样更有利于系统地分析和检验二者的检验效能,以便更好地对其进行利用.
1 方法
1.1 实验分组
筛选2013年9月和2013年12月在湖南省人民医院就诊的肝癌病人和健康体检者,其中肝癌患者入组条件为:未经过任何治疗,经病理或者临床诊断为肝癌的患者.共有84名受试者参与,并分为以下两组:健康对照组,包括32名,年龄范围为21~72岁(平均年龄43±15岁);肝癌组共52名,男45例,女7例,年龄范围为27~80岁(平均年龄54±12岁),各组人员在入院后进行相应治疗之前,完成CT、超声、血生化常规、血清AFP检测,各组实验对象资料见表1.
1.2 标本收集
用真空采血针取患者晨起空腹3 mL静脉全血,4℃ 4 000 r/min离心10 min,提取离心后的血清.血清保存在-80℃,保存至同批测定.

表1 各实验分组及临床资料Tab.1 Clinical datas of each group
1.3 酶联免疫吸附实验(ELISA)
酶联免疫吸附实验(Enzyme-linked Immunosorbent Assay)检测人血清IL-17质量浓度.使用人IL-17酶联免疫吸附试剂盒(CSB-E14917H,Cusabio Biotech),检测浓度下限(LLD)为7.8 ng/L.批内精密度(化验内精度)CV% <8%,批间精密度(检测精度之间)CV% <10%.Biotech酶标仪检测各样本孔吸光值.Curve Expert 1.4软件计算和绘制ELISIA标准品曲线,并计算各孔的质量浓度.
1.4 应用Roche电化学发光法测定血清AFP质量浓度
按试剂盒说明书处理样本后,吸取10 μL标本与生物素化抗AFP单克隆抗体和钉标记的抗AFP抗体混匀,加入链霉亲合素包被的微粒,反应混合液吸到测量池中,微粒通过磁铁吸附到电极上,电极加电压后产生化学发光,通过光电倍增管进行测定.检测结果由Elecsys软件自动测出.
1.5 软件分析
应用SPSS17.0统计软件进行统计分析.应用受试者诊断特征曲线(receiver operator characteristic curve ROC)评估指标的预测效能,得到曲线下面积(Area Under the Curve,AUC).最大约登指数计算临界值(Cutoff points),约登指数(Youden index)=敏感度+特异度-1.各组均值比较,两独立样本t检验.logistic逐步回归分析.所有结果以双尾检验P<0.05认为有统计学差异.Medcalc软件绘制ROC曲线.
2 结果
2.1 正常组与肝癌组血清IL-17的质量浓度
结果显示IL-17在肝癌组中质量浓度明显高于正常组,分别为5.76 ±2.35 ng/L 和2.98 ±2.53 ng/L(P*<0.001),差异有统计学意义.两独立样本t检验.见图1.

图1 正常组与肝癌组血清IL-17质量浓度Fig.1 Serum levels of IL-17 in HCC group and control group
2.2 血清IL-17诊断肝癌组与正常组的效能分析
以IL-17的血清质量浓度为变量做ROC曲线,检测其作为肝癌血清诊断标志物的可能性,结果显示IL-17和AFP分别单独作为标志物对肝癌与正常组进行区分时,其曲线下面积AUC分别为0.820(P <0.001)和0.884(P <0.001),见图 2 和表 2,二者作为血清标志物均具有统计学意义.IL-17诊断的特异度较AFP低,但敏感性较AFP增加.选择截断点IL-17为2.455 ng/L时,敏感度为67.3%,特异度为87.5%.当AFP为32.4 μg/L截断点时约登指数最大,其敏感度为61.5%,特异度为100%,如表3.若选择以20 μg/L的诊断指标为截断点,其敏感度为61.5%,特异度为90.6%.

表2 ROC分析血清两指标诊断肝癌与正常组(AUC和P值)Tab.2 ROC analysis of IL-17 and AFP in HCC and the control group(AUC and P values)

表3 两指标诊断肝癌组和正常组敏感度、特异度及约登指数Tab.2 Sensitivity,specificity and Youden index for HCC and control groups
2.3 AFP与IL-17两指标联合Logistic逐步回归模型预测肝癌
通过对AFP、IL-17的logistic向后逐步回归分析,选择进入变量的概率标准为0.10,剔除变量的概率标准为0.15,得出回归方程:

其中x1代表IL-17,x2代表AFP,其中P为logistic模型预测概率,取值范围在0~1之间,e为自然对数(e≈2.718),Odd Ratio(OR)95%CI(95%可信区间)如表4所示.结果发现IL-17血清质量浓度高的患者其转移的风险为质量浓度低的患者发病风险的3.872倍.AFP血清质量浓度高的患者其发病的风险为质量浓度低的患者风险的1.064倍.Logistic回归预测模型的卡方值为65.567,P<0.001,提示纳入模型的预测变量对预测肝癌发生有显著的解释能力.通过分类交互表计算Hosmer-Lemeshow,df=8,P>0.05,认为模型拟合观测数据良好.以预测变量PRE为检验变量,诊断结果为状态变量作ROC曲线分析.Medcalc绘制3条曲线(图3),可见AFP和IL-17回归模型中ROC曲线下面积的AUC为0.947,大于AFP(0.884)和 IL-17(0.820)各指标单独诊断时面积,两指标联合模型约登指数最大时对应的敏感度84.6%,特异度96.9%,均较单独两指标诊断时增高.

表4 逐步logistic回归后预测肝癌的模型(n=84)Tab.4 Logistic regression model to predict HCC(n=84)

图2 ROC分析IL-17和AFP两指标诊断肝癌与正常组Fig.2 ROC analysis of IL-17 and AFP in HCC and the control group
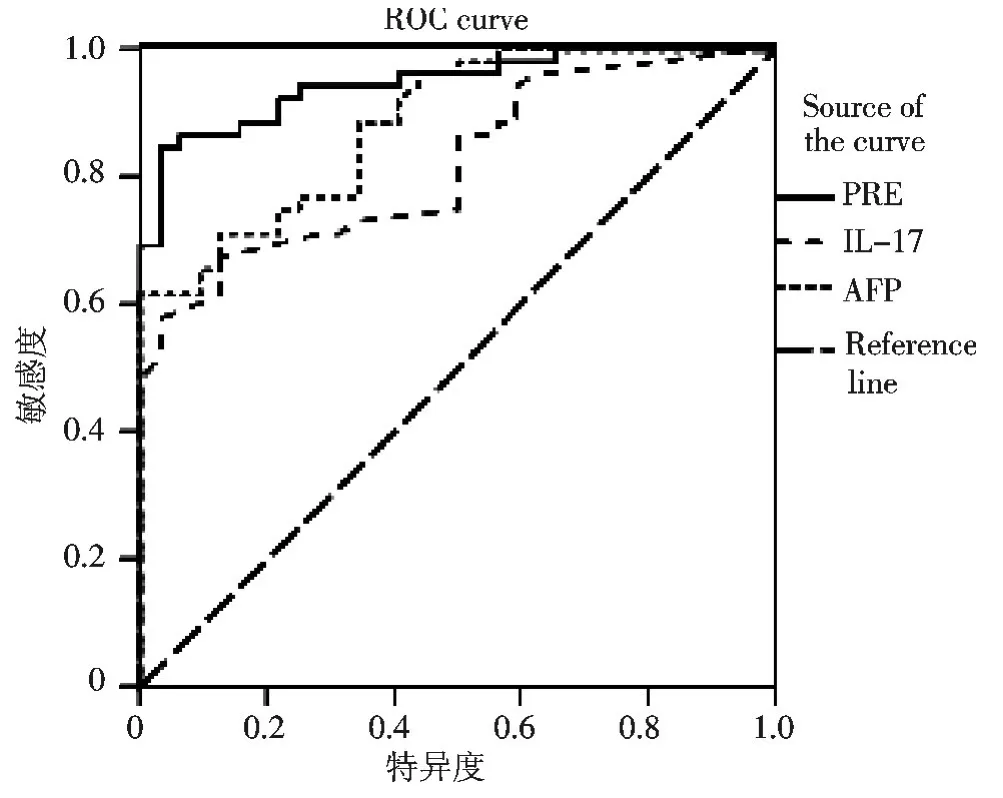
图3 ROC曲线绘制AFP与IL-17两指标单独及联合Logistic逐步回归模型PRE预测肝癌Fig.3 ROC polt of AFP and IL-17 two indicators alone and Logistic regression model PRE to predict HCC
3 讨论
原发性肝癌的早期诊断对提高患者的5年生存率以及生存质量十分重要.在中国,AFP目前仍然被作为筛查和早期诊断肝癌的主要指标,主要由于其应用的方便和指标具备一定的特异性,肝癌患者约60%血清中的AFP较正常人增高[14],但是AFP的敏感度和特异度对于临床诊断来说还远远不够,即使联合已有的指标DCP或AFP-L3时,诊断肝癌患者的敏感度也仅为78.3%[14-15].因此,寻找更加敏感和特异的肝癌诊断指标有着非常重要的临床意义,也是目前肝癌研究的重点方向.
本研究应用了受试者诊断特征曲线分析,判断指标的潜在诊断价值.在AUC>0.5的情况下,AUC越接近于1,说明诊断效果越好.通过ROC分析,结果显示肝癌患者IL-17血清质量浓度为2.455 ng/L临界点时,其曲线下面积(AUC=0.820)有统计学意义.目前关于IL-17与肝癌转移的报道在国内外还非常少,仅有IL-17增高与肝癌复发相关的类似研究,当IL-17大于0.9 ng/L时,肝癌患者术后的复发概率增高,远期生存质量较差,预测肝癌术后复发的敏感度为63.3%,特异度为91.1%[16].另外也有报道178例肝癌患者,肿瘤内IL-17质量浓度与肝癌术后复发及生存相关,是预后的不良因素,认为IL-17质量浓度与肿瘤的微血管密度正相关,可能的机制为IL-17能够促进血管生成,导致肿瘤进展[17].
Logistic回归分析是一类数据挖掘技术,可以从大量的医学信息和临床数据中提取有用的信息和知识,建立某种疾病的诊断或治疗模型.临床医生进行诊断时如果利用计算机辅助诊断的logistic回归模型,其准确率可得到提高.本研究构建的IL-17和AFP的logistic回归模型其诊断肝癌的效能较IL-17和AFP均增高,该模型在国内外的文献中还未见报道.
本研究发现在肝癌血清中IL-17质量浓度较正常组增高,因此IL-17可作为诊断肝癌的标志物,其敏感度较AFP高.同时获得了IL-17和AFP两指标联合诊断的logistic回归模型,其ROC的曲线下面积AUC(0.964)较两指标单独诊断的曲线下面积均高,且敏感度和特异度都提高.本研究还有待于进一步扩大样本,验证其logistic回归诊断模型的诊断效能.
[1]JEMAL A,SIEQEL R,XU J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2]YAU T,CHAN P,EPSTEIN R,et al.Management of advanced hepatocellular carcinoma in the era of targeted therapy[J].Liver Int,2009,29(1):10-17.
[3]GONZALEZ H D,FIGUERAS J.Surgical treatment for hepatocellular carcinoma in cirrhotic patients.Guide to the selection and decision-making process in a context of multimodal strategy[J].Clin Trans Oncol,2009,11(1):20-27.
[4]BOLTON J S,O'CONNELL M J,MAHONEY M R,et al.Hepatic arterial infusion and systemic chemotherapy after multiple metastasectomy in patients with colorectal carcinoma metastatic to the liver:a North Central Cancer Treatment Group(NCCTG)phase II study,92-46-52[J].Clin Colorectal Cancer,2012,11(1):31-37.
[5]NICOUD I B,JONES C M,PIERCE J M,et al.Warm hepatic ischemia-reperfusion promotes growth of colorectal carcinoma micrometastases in mouse liver via matrix metalloproteinase-9 induction[J].Cancer Res,2007,67(6):2720-2728.
[6]YOKOYAMA N,SHIRAI Y,AJIOKA Y,et al.Immunohistochemically detected hepatic micrometastases predict a high risk of intrahepatic recurrence after resection of colorectal carcinoma liver metastases[J].Cancer,2002,94(6):1642-1647.
[7]CHEAH Y L,CHOW P K H.Liver transplantation for hepatocellular carcinoma:an appraisal of current controversies[J].Liver Cancer,2012,1(3-4):183-189.
[8]BRAILLON A.Is the American association for the study of liver diseases recommendation for hepatocellular carcinoma screening a cul-de-sac?[J].World J Gastroenterol,2013,19(21):3369-3370.
[9]DANIELE B,BENCIVENGA A,MEGNA A S,et al.Alpha-fetoprotein and ultrasonography screening for hepatocellular carcinoma[J].Gastroenterology,2004,127(5 Suppl 1):S108-S112.
[10]ZIPPRICH A,GARCIA-TSAO G,ROGOWSKI S,et al.Prognostic indicators of survival in patients with compensated and decompensated cirrhosis[J].Liver Int,2012,32(9):1407-1414.
[11]ACCOLLA R S,LOMBARDO L,ABDALLAH R,et al.Boosting the MHC Class II-restricted tumor antigen presentation to CD4+T helper cells:a critical issue for triggering protective immunity and re-orienting the tumor microenvironment toward an anti-tumor state[J].Front Oncol,2014,4:32.
[12]RAN Q,HAO P,XIAO Y,et al.CRIF1 interacting with CDK2 regulates bone marrow microenvironment-induced G0/G1 arrest of leukemia cells[J].PLoS One,2014,9(2):e85328.
[13]MIYAHARA Y,ODUNSI K,CHEN W,et al.Generation and regulation of human CD4+IL-17-producing T cells in ovarian cancer[J].Proc Natl Acad Sci U S A,2008,105(40):15505-15510.
[14]BERTINO G,ARDIRI A,MALAGUARNERA M,et al.Hepatocellualar carcinoma serum markers[J].Semin Oncol,2012,39(4):410-433.
[15]YAMAMOTO K,IMAMURA H,MATSUYAMA Y,et al.AFP,AFP-L3,DCP,and GP73 as markers for monitoring treatment response and recurrence and as surrogate markers of clinicopathological variables of HCC[J].J Gastroenterol,2010,45(12):1272-1282.
[16]刘立国.术前血清中细胞因子含量与肝癌切除术后预后相关性探讨[D].北京:北京协和医院,2012.
[17]李宝华,何蓓晖,潘高辉.白细胞介素17在原发性肝癌中的表达及意义[J].中国卫生检验杂志,2012(10):2405-2406,2409.
