CdS-Eu(Ⅲ)体系荧光恢复的磷酸根离子可视化测定
2014-10-11杨海冉杨传孝孙向英
杨海冉,杨传孝,孙向英
(华侨大学 材料科学与工程学院,福建 厦门361021)
磷酸根离子是水生微生物营养链的主要成分,其衍生物是生命遗传物质的重要组成部分,同时也是水体富营养化的重要来源.因此,发展一种简单、可视化检测水溶液中PO34-的方法具有重要的现实意义.目前,检测PO34-的方法有分光光度法[1]、离子色谱法[2]、电化学法[3]、酶传感[4]及数码成像比色法[5]等.但是,在复杂环境体系中高灵敏度、高选择性地检测PO34-仍然是一个挑战.量子点(quantum dots,QDs)是一种新型的纳米发光材料,具有激发范围宽、发光效率高、发射峰位窄且峰位可调等特点,是一种理想的可视化荧光传感材料[6].在离子检测方面,报道较多的是QDs直接用于金属离子的测定[7],而QDs直接用于阴离子测定的研究报道却较少.目前,研究较多的是将QDs进行表面修饰,制备QDs双荧光发射纳米复合材料[8-9];或在QDs及其复合物表面包覆具有介孔结构的二氧化硅[10-11],然后建立比率荧光传感的模式.虽然这些方法可有效提高其对金属离子的选择性,但制备过程繁琐,有的荧光颜色变化不明显.理想可视化荧光传感策略是建立在QDs的荧光共振能量转移体系的基础上,可充分发挥QDs的发光特性,提高被识别分析物的选择性[12-13].基于此,本文用聚丙烯酸为稳定剂、硫脲为硫源合成表面富含羧基的CdS QDs,设计建立了基于CdS-Eu(Ⅲ)体系荧光恢复可视化测定PO34-的新方法.
1 实验部分
1.1 仪器与试剂
F-4500型荧光分光光度计(日本日立公司)和UV-2102PC型紫外可见分光光度计(尤尼克上海仪器有限公司)分别用于QDs荧光强度和吸收光谱的测定;H-7650型透射电镜 (日本日立公司)用于表征纳米粒子的大小以及形态;FL-920型荧光分光光度计测定QDs的荧光寿命.
氯化镉(CdCl2),西陇化工厂有限公司;硫脲(TU),天津市福晨化学试剂厂;磷酸钠(Na3PO4)、聚丙烯酸(PAA)、氧化铕(Eu2O3),国药集团化学试剂有限公司;使用二次蒸馏水,所用试剂均为分析纯.
1.2 实验方法
1.2.1 CdS QDs的合成 取1.0mL,0.01mol·L-1CdCl2于三颈瓶中,加入180mL二次蒸馏水,然后再加入5.0mL,0.6%PAA,0.3mL,0.01mol·L-1硫脲,用1.0mol·L-1NaOH 溶液调pH 值至11.5左右,于100℃下加热回流4h.
1.2.2 CdS-Eu(Ⅲ)测PO3-4取1.0mL CdS QDs于10mL比色管中,加入0.5mL pH 值为8.01的Tris缓冲溶液,然后加入0.6mL,1.0×10-4mol·L-1Eu3+和适量PO3-4标准溶液或样品溶液,用二次蒸馏水定容至5mL,1h后测定其荧光光谱及紫外-可见吸收光谱,紫外灯下用数码相机成像.
2 结果与讨论
2.1 CdS QDs的光谱特征
PAA稳定CdS QDs的荧光光谱和吸收光谱,如图1所示.由图1(a)可知:在回流时间大于2h时,CdS QDs的荧光强度达到最大;当反应时间在2~4h内,荧光强度基本一致,但其发射峰发生红移,在紫外灯照射下发出黄色荧光.由图1(b)可以看出:硫脲在235nm处的吸光度随着反应时间的增加逐渐下降,而CdS QDs带边吸收却逐渐增加.这充分说明:在碱性条件下,随着加热回流时间的延长,硫脲释放出S2-的量逐渐增加,CdS QDs的量也随之增加,因而荧光强度不断增长.

图1 CdS QDs的荧光和吸收光谱Fig.1 Fluorescence spectra and absorption spectra of CdS QDs
2.2 CdS-Eu(Ⅲ)体系测定磷酸根离子

图2 Eu3+浓度对CdS QDs荧光光谱的影响Fig.2 Effect of the concentration of Eu3+on the fluorescence spectra of CdS QDs
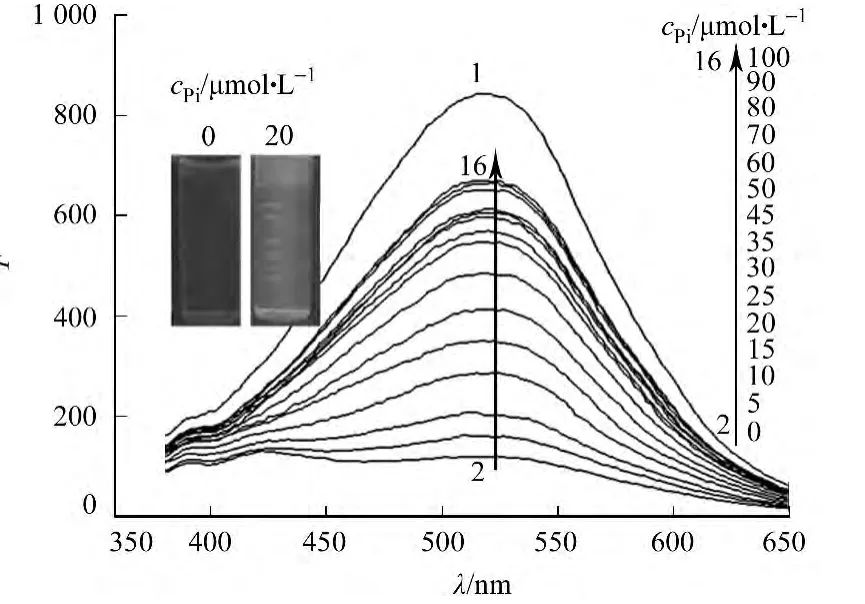
图3 PO3-4 与CdS-Eu(Ⅲ)作用的荧光光谱Fig.3 Fluorescence spectra of the reaction between CdS-Eu(III)and PO3-4
2.2.2 pH值的影响 pH值越高,硫脲释放出S2-的速度快,CdS纳米粒子的形成也较快,如图4所示.由图4可知:当pH值小于10.53时,合成的CdS QDs的荧光强度较低,随着pH值的增加,CdS QDs的荧光强度也逐渐增加;当pH值为11.5时,CdS QDs的荧光强度达到最大;若继续增加pH值,CdS QDs的荧光强度反而减少.图5为溶液pH值对CdS-Eu(Ⅲ)与作用的影响.由图5可知:随着pH值的增大,CdS-Eu(Ⅲ)的荧光强度有缓慢增加的趋势(曲线1);当加入后体系荧光强度也随之增加;当溶液pH值为8.01时,荧光强度增量达到最大;pH继续增加,体系荧光强度增加量却逐渐降低(曲线2).因此,选用pH值为8.01的Tris-HCl缓冲溶液来调节溶液pH值.

图4 pH值对CdS QDs荧光强度的影响Fig.4 Effect of the pH value on the fluorescence intensity of CdS QDs

图5 pH值对CdS-Eu(Ⅲ)与作用的影响 Fig.5 Effect of the pH value on the reaction between CdS-Eu(Ⅲ)and
2.2.3 PAA加入量的影响 PAA表面富含羧基对CdS QDs具有稳定作用,如图6所示.由图6可知:PAA(0.6%)加入量越小,PAA对CdS QDs的稳定作用越小,合成的CdS QDs的荧光强度较弱;随着PAA量增加,CdS QDs的荧光强度达到最大时,所需回流时间延长,CdS QDs的荧光强度也随之增加;当PAA加入量达到5~6mL时,CdS QDs的荧光强度达到最大且较为稳定.由图7线1可知:当PAA加入量小于6mL时,Eu3+对CdS QDs的荧光猝灭率(ηq)约为90.0%;当PAA加入量大于6mL时,PAA量越多,Eu3+对CdS QDs的荧光猝灭率也随之减弱.PAA加入量对CdS-Eu(Ⅲ)体系的荧光恢复率(ηr)也有较大的影响.当PAA量大于6mL时,加入后CdS-Eu(Ⅲ)体系的荧光强度基本没有恢复;当PAA量小于6mL时,加入后CdS-Eu3+体系的荧光强度有明显恢复,且5mL PAA稳定的CdS QDs其荧光强度恢复最好.因此,选用5mL PAA(0.6%)作为合成CdS QDs稳定剂.

图6 PAA加入量对CdS QDs荧光强度的影响Fig.6 Effect of the concentration of PAA on the fluorescence intensity of CdS QDs

图7 PAA加入量对CdS-Eu(Ⅲ)与作用的影响 Fig.7 Effect of the concentration of PAA on the reaction between CdS-Eu(Ⅲ)and
2.2.4 TU加入量的影响 碱性条件下,TU分解产生的S2-作为合成CdS QDs的硫源.因此,TU加入量对CdS QDs的荧光强度有较大的影响,如图8所示.由图8可知:随着回流时间增加,CdS QDs的荧光强度先增加后降低;TU(0.01mol·L-1)加入量越多,CdS QDs的荧光强度达到时所需的时间越短,但形成QDs的荧光强度越低;当TU加入量为0.3~0.4mL,回流时间为2~4h时,可以获得发光强度高且相对稳定的CdS QDs.考察对CdS-Eu(Ⅲ)体系荧光恢复的影响,如图9所示.由图9可知:当TU加入量为0.2~0.5mL时,CdS QDs与Eu(Ⅲ)作用后,其荧光强度随着的增加均有显著的恢复,且体系的荧光强度随着浓度的增加呈线性增加;而TU的量太小或太高,CdS QDs荧光强度都较低(图8).因此,选用0.3mL TU(0.01mol·L-1)合成的CdS QDs用于的检测.
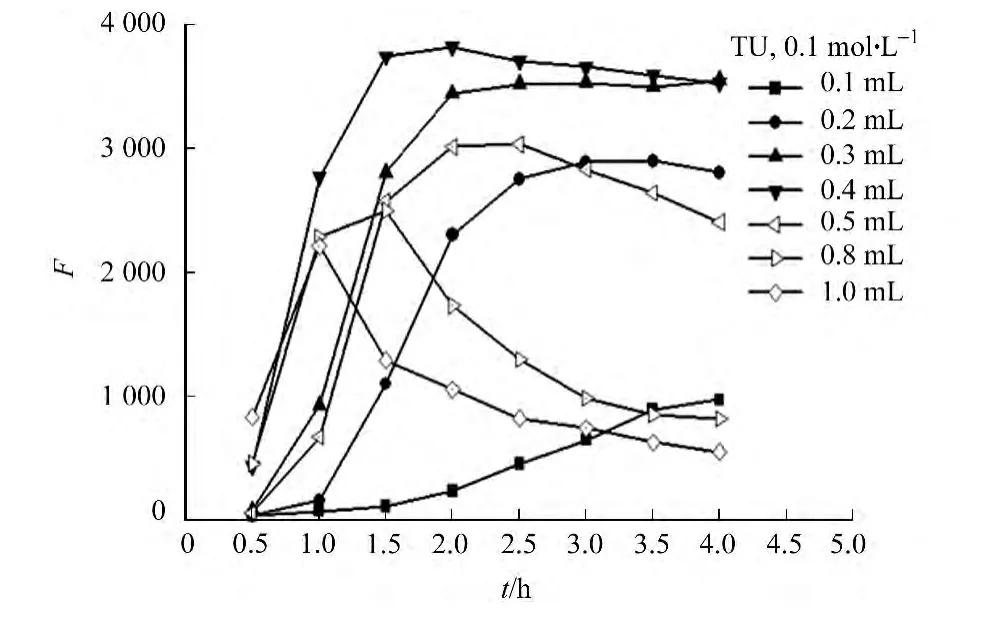
图8 TU加入量对CdS QDs荧光强度的影响Fig.8 Effect of the concentration of TU on the fluorescence intensity of CdS QDs

图9 TU加入量对CdS-Eu(Ⅲ)与作用的影响 Fig.9 Effect of the concentration of TU on the reaction between CdS-Eu(Ⅲ)and
2.2.5 共存物质的影响 考察了常见的金属离子、阳离子和阴离子对CdS-Eu(Ⅲ)体系测定的影响.实验结果表明:常见的金属离子Na+,K+,Zn2+的最大允许浓度为1.0mmol·L-1;Ca2+,Mg2+,Fe3+,Pb2+的最大允许浓度为100μmol·L-1;Cd2+,Ni2+,Mn2+,Fe2+,Ag+的最大允许浓度为20 μmol·L-1;Co2+,Cu2+的最大允许浓度为2μmol·L-1.虽然允许浓度相对较小,但实际样品测定中可用巯基棉除去可能共存的重金属离子[13].常见的阴离子,,NO2-,,卤素离子,三聚磷酸根,六偏磷酸根没有干扰,最大允许浓度大于1.0mmol·L-1.说明CdS-Eu(Ⅲ)体系用于的测定具有较好的选择性.
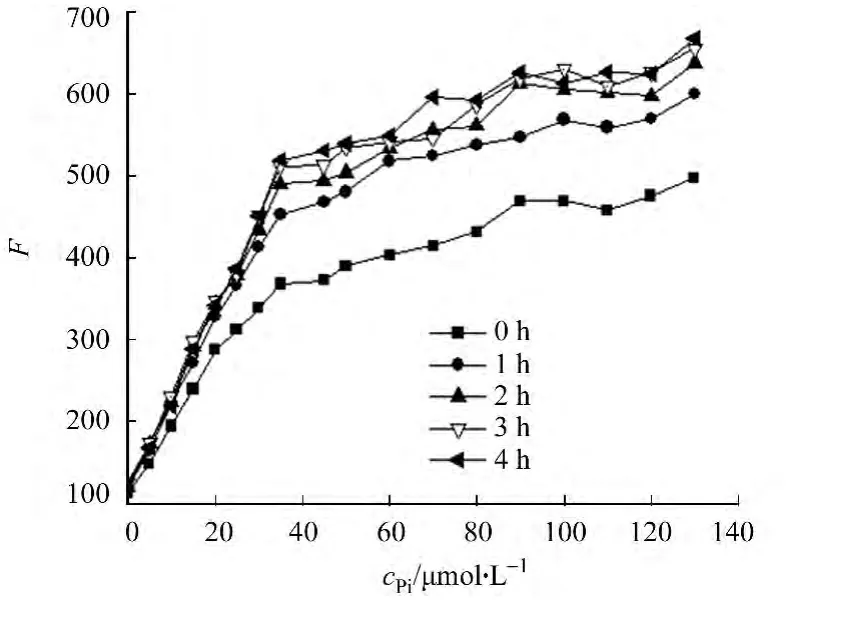
图10 反应时间的影响Fig.10 Effect of the reaction time
2.3 标准曲线及样品测定
为考察文中方法的可行性,通过标准加入法对白鹭池水样(按GB 11893-1989《水质总磷的测定钼酸铵分光光度法》对水样进行处理)中,浓度进行测定并与分光光度法比较,结果如表2所示.表1,2的反应条件为:1.0mL CdS QDs;12μmol·L-1Eu3+;pH值为8.01;Ex=340nm;Em=515nm.表2中:c1,c2分别为文中方法和分光光度法测得的的浓度;ca为标准溶液的加入量;cPO3-4水样中磷酸根的测得值;η为回收率.由表2可知:测定结果与分光光度测定结果相近,说明本方法有很强的实用性.
表1 测定分析参数Tab.1 Analytical parameters for the determination of PO3-4

表1 测定分析参数Tab.1 Analytical parameters for the determination of PO3-4
·-1 t/h 线性回归方程 线性范围/μmolLk R 0 ΔF=10.9+7.27c 1.03~35 7.27 0.978 7 1 ΔF=7.5+9.56c 0.78~35 9.56 0.995 2 2 ΔF=5.1+10.39c 0.72~35 10.39 0.994 7 3 ΔF=-2.5+10.99c 0.68~35 10.99 0.993 1 4 ΔF=-12.5+11.54c 0.64~35 11.54 0.996 6

表2 理想水样品测定的结果Tab.2 Determination results for real water samples
2.4 机理探讨
量子点的透射电镜图,如图11所示.由图11(a)可知:电镜图表明PAA稳定的CdS QDs具有较好的分散特性,紫外灯照射下发黄色荧光.Eu3+加入后,CdS QDs发生明显聚集(图11(b)),黄色荧光猝灭;但是加入后,CdS QDs又重新得到分散、黄色荧光恢复(图11(c)).这是由于PAA稳定的CdS QDs表面富含羧基,Eu3+与QDs表面的羧基螯合,导致QDs聚集形成紧密堆集的QDs簇,从而增加了量子点之间能量转移的效率,导致黄色荧光猝灭.又因为与Eu3+的结合能力远大于羧基与Eu3+的结合能力.因此,加入后,QDs聚集体被瓦解其分散程度明显增加,从而阻断了QDs间的能量转移、黄色荧光得到恢复.从荧光寿命测量可以进一步得到证实,如图12所示.由图12可知:当Eu3+加入后,CdS QDs的发射寿命由67.01ns减小到57.42ns,这是由于QDs聚集体作为能量接受体,提供了多个附加衰减通道所致[13];当加入后,发射寿命从57.42ns恢复到64.66ns,证明随着QDs分散程度的增加,原来QDs聚集体中作为能量受体的粒子所提供的附加衰减通道消失、荧光恢复.
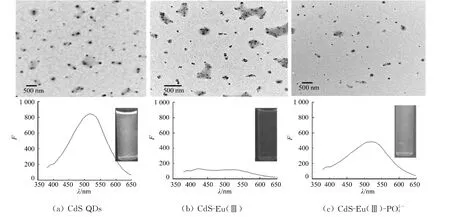
图11 量子点的透射电镜图Fig.11 TEM images of QDs

图12 荧光衰减曲线图Fig.12 Fluorescence decay curves
3 结束语
用PAA为稳定剂、硫脲为硫源成功合成了水溶性、表面富含羧基的CdS QDs.实验结果表明:Eu3+能与PAA稳定的CdS QDs作用形成CdS QDs簇,并诱导CdS QDs簇之间的能量转移,导致QDs荧光猝灭,而却能把Eu3+从CdS QDs间的位置竞争下来,阻断QDs之间的能量转移,致使CdS-Eu(Ⅲ)体系荧光恢复.由此发展了一种简单的荧光恢复可视化荧光测定的新方法.该法具有灵敏度高、选择性好、可视化等特点,可用于环境水样中的分析测定.
[1] 俞林.水质监测分析方法标准实务手册[M].北京:中国环境科学出版社,2002:1015-1019.
[2] COLINA M,GARDINER P H E.Simultaneous determination of total nitrogen,phosphorus and sulphur by means of microwave digestion and ion chromatography[J].J Chromatogr:A,1999,847(1/2):285-290.
[3] CHENG Wan-ling,SUE Jun-wei,CHEN Wei-chung,et al.Activated nickel platform for electrochemical sensing of phosphate[J].Anal Chem,2010,82(3):1157-1161.
[4] RAHMAN M A,PARK D S,CHANG S C,et al.The biosensor based on the pyruvate oxidase modified conducting polymer for phosphate ions determinations[J].Biosens Bioelectron,2006,21(7):1116-1124.
[5] 杨传孝,孙向英,刘斌.数码成像比色法测定水样中的总磷[J].分析化学,2007,6(6):850-853.
[6] CHIN P T K,BUCKLE T,de MIGUEL A A,et al.Dual-emissive quantum dots for multispectral intraoperative fluorescence imaging[J].Biomaterials,2010,31(26):6823-6832.
[7] 杨传孝,孙向英.三聚磷酸钠稳定硫化镉量子点荧光猝灭法测定痕量铁[J].华侨大学学报:自然科学版,2011,32(5):537-542.
[8] SUN Xiang-ying,LIU Bin,XU Yi-bang.Dual-emission quantum dots nanocomposites bearing an internal standard and visual detection for Hg2+[J].Analyst,2012,137(5):1125-1129.
[9] ZHANG Kui,ZHOU Hai-bo,MEI Qing-song,et al.Instant visual detection of trinitrotoluene particulates on various surfaces by ratiometric fluorescence of dual-emission quantum dots hybrid[J].J Am Chem Soc,2011,133(22):8424-8427.
[10] SONG Ying-ying,CAO Xue-bo,GUO Yang,et al.Fabrication of mesoporous CdTe/ZnO@SiO2core/shell nanostructures tunable dual emission and ultrasensitive fluorescence response to metal ions[J].Chem Mater,2009,21(1):68-77.
[11] YANG Chun-xiao,LIU Bin,SUN Xiang-ying.Visual and trap emission spectrometric detections of Ag(I)ion with mesoporous ZnO/CdS@SiO2core/shell nanocomposites[J].Anal Chim Acta,2012,746:90-97.
[12] ROGACH A L,KLAR T A,LUPTON J M,et al.Energy transfer with semiconductor nanocrystals[J].J Mater Chem,2009,19(9):1208-1221.
[13] 曹春,刘玫瑰,曹明.基于自然尺寸分布的单一CdTe量子点样品中Eu(Ⅲ)诱导的能量转移测定磷酸根离子[J].中国科学:化学,2010,40(4):379-385.
