利福平/OCS-PLGA纳米缓释微球的制备及体外释放性能
2014-10-09李彦艳任国栋柳峰松魏建荣
李彦艳,任国栋,柳峰松,魏建荣
(河北大学生命科学学院,河北保定 071002)
聚合物胶束是两亲性聚合物在选择性溶液中形成的具有亲水性外壳和疏水性内核的胶束体系,具有低临界胶束浓度、高度热力学稳定性、长循环、增溶药物、缓释、靶向等功能,已成为一种新型药物传递系统[1].聚合物胶束载药体系的制备,可通过化学结合法、物理法和静电作用3种途径包埋药物[2-4],其中物理包埋法操作简单,载药范围很广.
壳聚糖(chitosan,CS)[(1,4)-2-氨基-2-脱氧-β-D-葡聚糖],具有良好的生物可降解性、生物相容性、无免疫活性等特点,近年来被广泛地应用于药物传递系统[5].在壳聚糖分子中引入疏水长链使其成为一种两亲性聚合物,在水溶液中可以自动聚集成胶束[6-8].但是所形成的胶束是一个动态体系,药物与疏水性内核的作用仅依赖于较弱的分子间作用力,如范德华力、氢键、静电引力等,因此在体内很容易松散、解离甚至药物渗漏、暴释,有待进一步改善.
利福平(RFP)为一类抗生素类药物,是目前临床应用最广泛的一种抗结核病药物,对革兰氏阴性菌和阳性菌有明显的抗菌作用.在临床上可用作肝炎、肺炎等,但如果口服剂量过大,往往有毒副作用,引起不良反应等.用壳聚糖胶束包裹利福平制成纳米微球,可以做成皮下埋植或静脉注射制剂,可减缓药物释放,提高疗效.
本文对壳聚糖进行化学修饰得到两亲性聚合物油酰壳聚糖,用乳化溶剂蒸发法制备油酰壳聚糖包被的聚乙丙交酯(PLGA)纳米微球.PLGA的加入是为了增加载药纳米微球的稳定性和释放时的物理屏障,PLGA是一种可生物降解、吸收的高分子聚合物.检测了纳米微球形态、稳定性等特征.用疏水性药物利福平做为模型药物,检测了纳米微球制备过程中一些因素如PLGA浓度、OCS浓度等对纳米微球包封率和释药效果的影响,进一步分析纳米微球形态与释放方式、释放速度的相关性,为壳聚糖在医用缓释材料领域的应用方面提供了依据.
1 材料与方法
1.1 材料
壳聚糖(分子质量38ku,脱乙酰度85%);PLGA(50-150,分子质量60ku);透析袋(截留分子质量10 000~14 000ku);利福平(浙江江北制药厂);其他试剂均为分析纯试剂.
1.2 仪器
均质机(PRO Scientific Inc);扫描电镜(SEM,JSM-T330A,Nihon Denshi,Japan);恒温磁力振荡器(上海智诚分析仪器有限公司);T6紫外可见分光光度计(北京普析通用);LGJ0-5冷冻干燥机(北京四环科学仪器厂).
1.3 方法
1.3.1 油酰壳聚糖包被的PLGA纳米微球制备
油酰壳聚糖的制备采用油酰氯和壳聚糖反应[9].
准确称量一定量PLGA溶于二氯甲烷中(油相);一定量油酰壳聚糖溶于体积分数0.5%的乙酸溶液中,得到油酰壳聚糖溶液(水相);待PLGA在二氯甲烷中完全溶解后,将油相加入到水相中;以16 000r/min的速率均质20min,得到纳米微球悬浮液.纳米微球干粉为将纳米微球离心后冷冻干燥方法制备.载利福平纳米微球的制备为先将利福平和PLGA一起溶解在二氯甲烷中,其他操作同上.
1.3.2 红外光谱检测
样品在50℃条件下真空干燥10h后,将2mg OCS包被的PLGA纳米微球与KBr充分研磨混匀,用压片机制成样品,然后用傅里叶变换红外光谱仪在400~4 000cm-1对样品进行分析.
1.3.3 微球形态观察
将所制备的纳米微球干粉用SEM检测以观察形态.
1.3.4 微球载药效率测定
微球的包封率和载药量测定方法见文献[10].
1.3.5 体外释放实验
利福平体外释放实验方法见文献[11],根据利福平标准曲线计算其含量,并补以同样体积的缓冲溶液以保持总体积不变.每个样品测定做3个平行,取平均值.释放介质分别为pH 3.8醋酸缓冲液和pH 6.8磷酸缓冲液.
1.3.6 微球缓释效果的优化
通过改变OCS和PLGA浓度、释放介质pH等条件下,检测微球各项指标和阿霉素体外释放效果,探讨OCS-PLGA NPs微球形态与缓释效果的相关性.
2 结果
2.1 纳米微球的形成
聚合物胶束的制备方法有透析法、直接溶解法、自组装溶剂蒸发等方法[12].经过疏水修饰的油酰壳聚糖是一种两亲性聚合物,在水溶液中能够自聚集成纳米胶束,这种胶束在水性环境中其疏水基团聚集形成疏水性内核并被亲水性链段构成的栅栏所包围.将油酰壳聚糖溶解于水得到水相,PLGA溶解于有机溶剂得到油相,在乳化作用下就会形成以包含有PLGA的有机溶剂为核心,油酰壳聚糖疏水基指向核心,亲水基指向水溶液的结构.将有机溶剂二氯甲烷蒸发除去,PLGA留在了疏水内核中,PLGA的存在会增加药物释放时的屏障和物理阻力,降低药物释放速度.
2.2 红外图谱
图1所示的是OCS纳米微球和OCS包被的PLGA纳米微球的红外图谱.从图1可以看出,OCS纳米微球(图1a)在1 182cm-1(CH2),1 464cm-1(δCH2),2 854cm-1(νsCH2),2 924cm-1(νsCH2)有较强的特征吸收峰,说明在OCS分子中—CH2数量较多.OCS包被的PLGA纳米微球(图1b)红外图谱与OCS纳米微球发生了很大的变化,出现了PLGA的特征吸收峰:1 100cm-1(C—O),1 750cm-1(═C O),2 400cm-1,3 326cm-1(C—H).可以看出微球具有各种材料的特征吸收峰.

图1 OCS包被的PLGA纳米微球的红外图谱Fig.1 FT-IR of OCS nanoparticles and OCS-coated PLGA NPs
2.3 纳米微球形态检测
图2所示的是OCS包被的PLGA纳米微球的扫描电子显微镜照片.扫描电镜显示:所制备的OCS包被的PLGA纳米微球密度较大,且粒径在纳米尺度;微球形态规整,分布较窄,表面光滑,没有明显的小孔、裂纹;微球之间有一定的粘连.

图2 OCS包被的PLGA纳米微球的扫描电子显微镜照片Fig.2 SEM images of OCS-coated PLGA NPs
2.4 微球载药效率
表1所示的是PLGA质量浓度对包封率和载药量的影响.从表1可以看出,所制备的载药纳米微球具有较高的包封率和载药量,包封率能达到80%以上,PLGA质量浓度对纳米微球对RFP的包封率的影响不大.

表1 不同PLGA质量浓度的微球负载RFP的载药量和包封率Tab.1 Drug loading and encapsulation efficiency of RFP-loaded OCS-coated PLGA NPs with different PLGA mass concentrations
表2所示的是OCS质量浓度对包封率和载药量的影响.从表2中可以看出,随着OCS质量浓度的增大包封率呈现上升趋势,这是由于OCS质量浓度的增加导致利福平载体数量增加,因而包封率随之增大.
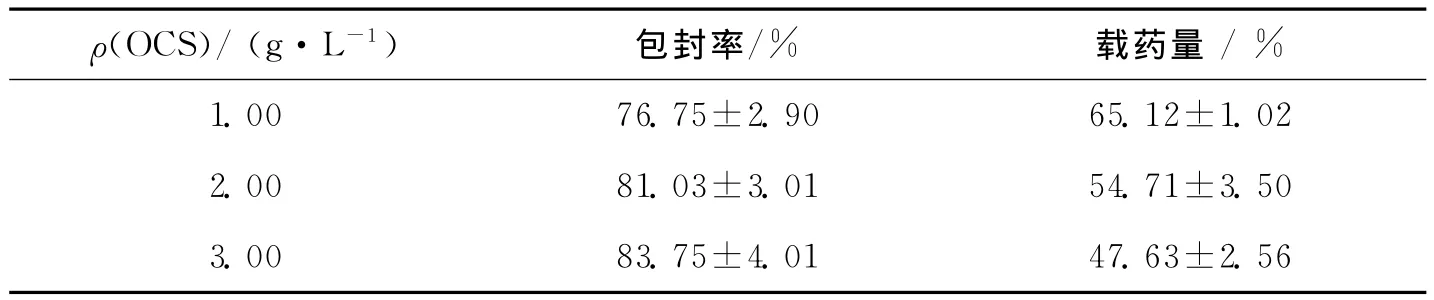
表2 不同OCS质量浓度的微球负载RFP的载药量和包封率Tab.2 Drug loading and encapsulation efficiency of RFP-loaded OCS-coated PLGA NPs with different OCS concentrations
2.5 体外释药实验
PLGA质量浓度对所形成的纳米微球的释药影响如图3所示.从图3可以看出,随着PLGA质量浓度的增加,RFP释放减慢.不加PLGA的纳米微球36h释放了59.12%,PLGA质量浓度为0.65g/L的样品36h释放了46.08%,PLGA质量浓度为2.00g/L的纳米微球36h释放了35.46%.说明PLGA的加入具有很好的增加药物缓释效果.
PLGA的加入改变了疏水性内核的构造,在内核中形成网络状屏障,从而降低了药物的释放速度.当PLGA质量浓度较大时,所形成的疏水内核中PLGA含量增高,当药物释放时,对药物的物理屏障作用增强,因此缓释效果增强.
OCS质量浓度对所形成的纳米微球的释药影响如图4所示.从图4可知,OCS质量浓度越大的微球,药物释放速度越慢.OCS质量浓度为1.00,2.00,3.00g/L的载药纳米微球36h分别释放了52.87%,46.08%,39.13%.

图3 PLGA质量浓度对RFP载药微球体外释放的影响Fig.3 Mean percent drug release of RFP from OCS-coated PLGA NPs with different PLGA mass concentrations
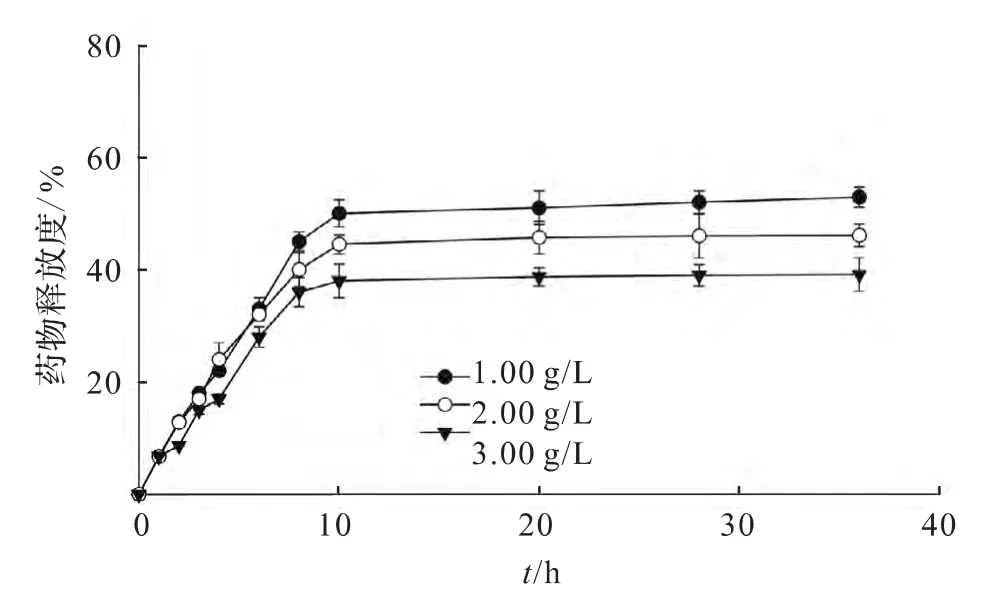
图4 OCS质量浓度对RFP载药微球体外释放的影响Fig.4 Mean percent drug release of RFP from OCS-coated PLGA NPs with different OCS mass concentrations
OCS质量浓度增大引起药物缓释效果增强的原因主要有2个:1)OCS分子中具有亲水基团和疏水基团,有一定的表面活性,可以降低乳滴的表面自由能.表面活性剂可以在所形成的液滴表面形成一层保护膜,从而防止小液滴聚集成大液滴,使体系中的液滴保持在稳定、细小、均匀的状态;2)随着OCS浓度增大,形成的胶束的外壳的厚度和致密性增强.因此,OCS质量浓度增大,增加了纳米微球的稳定性,也增加了纳米微球外壳的厚度和致密性,增强了药物释放过程中的物理屏障,降低了药物释放速度.
图5所示的是释放介质pH对RFP载药微球体外释放的影响.从图5可知,RFP在pH3.8的释放介质中的释放,比在pH6.8的介质中释放慢.在pH6.8和3.8介质中达到平衡的时间分别为10h和34h.
OCS的溶解性与CS类似,由于氨基的质子化,使得它们在低于pH6.5条件下溶解性较好,高于此pH条件溶解性较差.因此制得的微球在pH6.8条件下比在pH3.8条件下稳定性差,微球中药物就容易释放出来.

图5 释放介质pH对RFP载药微球体外释放的影响Fig.5 Mean percent drug release of RFP from OCS-coated PLGA NPs with different pH
3 讨论
聚合物胶束可做为一种药物载体,不同形态的胶束作为药物载体具有不同的释放原理与释放方式,是近年来的研究热点.
本文对壳聚糖进行化学修饰,制备了两亲性聚合物油酰壳聚糖(OCS).通过乳化溶剂蒸发法制备了OCS包被的PLGA纳米微球,所制备的纳米微球具有较好的稳定性,扫描电镜观察微球,发现微球粒径在纳米尺度,微球密度较大;微球形态规整,分布较窄,表面光滑,没有明显的小孔、裂纹.
选择利福平作为模型药物,并检测了PLGA和OCS质量浓度对包封率和体外释药的影响.所制备的纳米微球具有较高的包封率和载药量,随着OCS质量浓度的增大载药量呈现上升趋势.随着PLGA质量浓度的增加,RFP释放减慢.这是因为PLGA的加入改变了疏水性内核的构造,在内核中形成网络状屏障,从而降低了药物的释放速度.OCS质量浓度越大的微球,药物释放速度越慢.这是因为OCS质量浓度增大,增加了纳米微球的稳定性,也增加了纳米微球外壳的厚度和致密性,增强了药物释放过程中的物理屏障,降低了药物释放速度.RFP在pH6.8释放介质中的释放,比在pH3.8的介质中释放快.
所制备的OCS包被的PLGA纳米微球具有较稳定的纳米结构,较好的缓释效果,并且随着PLGA和OCS质量浓度的增加缓释效果增强.
[1] CHRIS OERLEMANS,WOUTER BULT,MARISKA BOS,et al.Polymeric micelles in anticancer therapy:targeting,imaging and triggered release[J].Pharmaceutical Research,2010,27(12):2569-2589.
[2] HIDENORI OTSUKA,YUKIO NAGASAKI,KAZUNORI KATAOKA.Self-assembly of poly(ethyleneglycol)-based block copolymers for biomedical applications[J].Current Opinion in Colloid &Interface Science,2001,6(1):3-10.
[3] NISHIYAMA N,KATAOKA K.Preparation and characterization of size-controlled polymeric micelle containing cis-dichlorodiammineplatium(Ⅱ)in the core[J].Journal of Controlled Release,2001,74(1-3):83-94.
[4] HU Fuqiang,ZHAO Mengdan,YUAN Hong,et al.A novel chitosan oligosaccharide-stearic acid micelles for gene delivery:Properties and in vitro transfection studies[J].International Journal of Pharmaceutics.2006,315(1-2):158-166.
[5] 孟祥君,李彦艳,任国栋.羧甲基油酰壳聚糖纳米粒的抑菌活性[J].河北大学学报:自然科学版,2011,31(6):632-637.MENG Xiangjun,LI Yanyan,REN Guodong.Antibacterial activity of oleoyl-carboxymethyl chitosan nanoparticles[J].Journal of Hebei University:Natural Science Edition,2011,31(6):632-637.
[6] HU Fuqiang,REN Guofei,YUAN Hong,et al.Shell cross-linked stearic acid grafted chitosan oligosaccharide self-aggregated micelles for controlled release of paclitaxel[J].Colloids and Surfaces B:biointerfaces,2006,50(2):97-103.
[7] WANG Bingqing,HE Chunbai,TANG Cui,et al.Effects of hydrophobic and hydrophilic modifications on gene delivery of amphiphilic chitosan based nanocarriers[J].Biomaterials,2011,32(20):4630-4638.
[8] SONIA T A,REKHA M R,CHANDRA P SHARMA.Bioadhesive hydrophobic chitosan microparticles for oral delivery of insulin:in vitro characterization and in vivo uptake studies[J].Journal of Applied Polymer Science,2011,119(5):2902-2910.
[9] LI Yanyan,CHEN Xiguang,YU Liangmin,et al.Aggregation of hydrophobically modified chitosan in solution and at the air-water interface[J].Journal of Applied Polymer Science,2006,102(2):1968-1973.
[10] 张娜,郭圣荣.双嘧达莫嵌段共聚物胶束的制备及体外药物释放[J].河北大学学报:自然科学版,2010,30(6):667-700.ZHANG Na,GUO Shengrong.Preparation of dipyridamole block copolymer micelle and research of in vitro drug release[J].Journal of Hebei University:Natural Science Edition,2010,30(6):667-700.
[11] 尹华峰,杨林,刘碧林,等.分光光度法测定利福平磺丁基醚-β-环糊精包合物[J].光谱实验室,2012,29(4):2372-2375.YIN Huafeng,YANG Lin,LIU Bilin,et al.Determination of rifampicin sulfonylurea butyl ether-β-Cyclodextrin inclusion complex by spectrophotometry[J].Chinese Journal of Spectroscopy Laboratory,2012,29(4):2372-2375.
[12] 张晓君,王东凯,韩晓.聚合物胶束作为药物传递系统的研究进展[J].中国药剂学杂志,2009,7(3):177-183.ZHANG Xiaojun,WANG Dongkai,HAN Xiao.Progress of polymeric micelles as drug delivery carriers[J].Chinese Journal of Pharmaceutics,2009,7(3):177-183.
