两种万古霉素藻酸盐微缓释球释放曲线的对比研究
2014-09-27侯天勇许建中第三军医大学西南医院骨科全军矫形外科中心重庆400038
侯天勇,许建中 (第三军医大学西南医院骨科,全军矫形外科中心,重庆 400038)
抗感染治疗是创伤所致的开放性骨折、骨髓炎以及外科术后处理中必不可少的重要措施。常规抗感染治疗主要通过口服或静脉给药,虽然可以取得一定疗效,但对于严重骨组织感染的患者,感染骨组织周围的血流量减少,容易导致药物在血液中浓度高而局部骨组织中浓度低的现象,降低了治疗效果。目前,应用生物相容性好、可降解的包裹材料制备成药物缓释载体并移植在骨折局部的给药方法,实现了直接给药、增强药物疗效的作用。为此,笔者对纤维蛋白包裹的万古霉素藻酸盐微球(fibrin-gel-coated vancomycin alginate beads,FG-Vanco-AB)进行制备和优化,为其在骨组织抗感染治疗中的可行性提供实验依据。
1 材料与方法
1.1 万古霉素藻酸盐微球的制备和优化
将藻酸盐(美国Sigma公司,低粘度细胞培养级)溶解于去离子水,制成4%、8%、12%、16%和20%的溶液,分别与等体积的10、20和50 mg/mL的万古霉素溶液混合。用注射器抽取后,加压使混合溶液缓慢滴注到搅动的1.01%(w/v)氯化钙水溶液中。10 min后,将从氯化钙水溶液中收集的藻酸盐微球用去离子水洗净,-70℃冻存6 h后再低压冻干6~8 h,直至重量不再变化后分装保存。称取相同质量的由不同浓度藻酸盐和万古霉素溶液制备的微球,用5 mL的5%(w/v)柠檬酸三钠溶液裂解微球,收集裂解液,以10 000 r/min离心10 min,取上清液在高效液相色谱仪上测定万古霉素浓度。万古霉素含量(%)=微球中万古霉素质量/藻酸盐微球的质量×100%。
1.2 FG-Vanco-AB 的优化
16%藻酸盐溶液与50 mg/mL万古霉素的混合溶液制备的万古霉素藻酸盐微球冻干后,每组分3份,分别置入0、30、60、75和90 mg/mL的纤维蛋白原的磷酸二氢钾(0.05 mol/L)溶液中缓慢搅动。10 min后浸入到400 IU/mL凝血酶中缓慢搅动,促进凝胶在微球表面形成一层膜,即FG-Vanco-AB,然后将其捞出,室温风干,称量包裹后的微球重量。增重比率(%)=(包裹后微球质量-包裹前微球质量)/包裹前微球质量×100%。
1.3 FG-Vanco-AB的体外释放
将上述不同浓度纤维蛋白包裹的微球15 mg放置在10 mL体积的DMEM/F-12培养基(美国Hyclone公司)中,于37℃恒温箱中每天更换液体,收集培养基,以10 000 r/min离心10 min,取上清液在高效液相色谱仪上测定万古霉素浓度。
1.4 毒性试验
抽取体质量为25 kg雄性山羊(第三军医大学动物中心提供)髂骨骨髓10 mL,按照文献[1]方法获取山羊间充质干细胞(mesenchymal stem cells,MSCs)。取第3 代 MSCs,以 2 ×104/mL的密度接种到24孔板中,每孔加入已收集的经不同浓度纤维蛋白包裹的微球缓释液1 mL,以普通培养基作为对照,观察MSCs的生长情况。在培养后1、3、5和7 d,各组选取3孔,用PBS溶液洗3次,加入1 mL普通培养基,加入100 μl的CCK-8 kit(日本Dojindo Lab公司)液体,在37℃孵育2 h,然后取100 μl孵育液到96孔板,通过酶标仪在450 nm测得吸光度(A)值。相对存活系数(%)=(样本的 A值/对照的 A值)×100%。
1.5 万古霉素的浓度与活性测定
分别将收集的样本液进行高效液相(Waters 510泵,484紫外检测器)分析,测得其中万古霉素的含量。具体方法为:取上清液10~50 μl进样,流动相为乙腈和KH2PO4溶液(0.05 mol/L),8︰92 混合,磷酸调 pH 值至 3.2,流速 1.0 mL/min,检测波长236 nm。通过试管稀释法测定万古霉素对金黄色葡萄球菌(ATCC 25923)最小的抑菌浓度。万古霉素被用含有0.5 mL附加阳离子的M-H肉汤连续倍加稀释。每一组试管的葡萄球菌接种物是0.5 mL过夜的含有5.0×105/mL菌落单位的培养基。最小抑菌浓度是在37℃孵育24 h后能够阻止菌液混浊的最低抗生素浓度。测定最小抑菌浓度后,取每一干净试管中0.01 mL液体铺在血液琼脂平皿上。最小杀菌浓度是在37℃孵育24 h后,使平皿上菌落数目为10个或是以下的抗生素的最低浓度。
1.6 统计学处理
2 结果
2.1 缓释微球的性状
万古霉素藻酸盐溶液在氯化钙溶液中可形成浅白色的球状物,随着时间延长,微球颜色逐渐加深,变成乳白色,球体的硬度增加。球体的大小主要取决于滴注的藻酸盐液滴的大小。本研究中藻酸盐微球的大小在5 mm左右,冻干后藻酸盐微球的体积明显减小,缩减至大约3 mm。被纤维蛋白凝胶包裹后的藻酸盐万古霉素微球体积无明显变化,经0、30、60、75和90 mg/mL纤维蛋白溶液浸泡,再经凝血酶塑形而形成通透膜包裹的微球的增重比率分别为(-0.27±3.65)%、(3.53±2.03)%、(6.17 ±2.22)%、(8.34 ±2.09)%、(8.79 ±2.00)%,表面变得更光滑。
2.2 藻酸盐微球中万古霉素的含量
在混合液中万古霉素浓度相同的条件下,随着藻酸盐溶液浓度的升高,最后成形的微球中万古霉素的含量逐渐增加。起始藻酸盐溶液达到16%时所制备的微球中万古霉素的含量最高,至20%时开始减低。在藻酸盐浓度相同的条件下,微球中万古霉素的含量随着制备混合液中万古霉素浓度的增加而显著增加(图1)。由50 mg/mL万古霉素和16%藻酸盐的混合液制备的微球,万古霉素的含量最高,达(27.36±0.90)%。

图1 不同浓度的万古霉素和藻酸盐溶液混合后制备的微球中万古霉素的含量
2.3 FG-Vanco-AB释放的万古霉素
万古霉素对金黄色葡萄球菌标准株(ATCC 25923)的最小抑菌浓度和杀菌浓度分别为1.20 mg/L和2.10 mg/L,药物敏感的折点值为5 mg/L。以万古霉素敏感的折点值作为最低浓度标准,放置未包裹的万古霉素藻酸盐微球的溶液中万古霉素的浓度超过此值的连续时间为11 d,而由30、60、75和90 mg/mL纤维蛋白溶液形成包裹的FG-Vanco-AB溶液中,释放的万古霉素的浓度超过5 mg/L的时间分别为13、17、19和19 d(图2)。
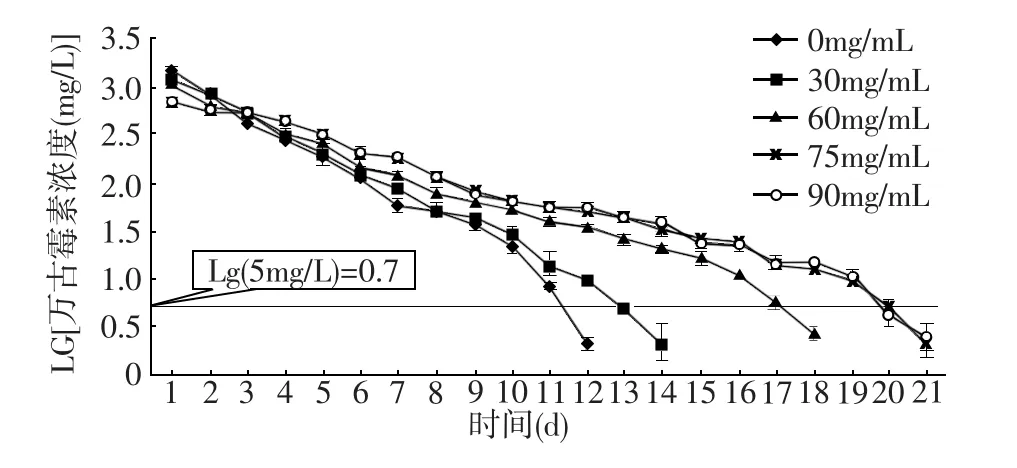
图2 不同浓度纤维蛋白凝胶包裹的万古霉素藻酸盐微球在体外释放的万古霉素的浓度。图中横线表示对标准菌株(ATCC 25923)具有敏感杀灭作用的折点值的万古霉素的浓度(5 mg/L)
2.4 毒性试验
MSCs在各实验组中均表现较明显的增殖趋势,细胞形态正常。各组相对生存率在培养后1 d均有不同程度的降低,3 d降低较明显,5 d至最低(各组之间差异无统计学意义);培养后7 d各组的相对生存率均出现不同程度的升高(图3)。

图3 不同浓度纤维蛋白凝胶包裹的万古霉素藻酸盐微球对共培养的MSCs增殖的影响
3 讨论
藻酸盐是天然的可吸收材料,属于多糖类物质,主要从褐藻中提取,其主要成分为β-D-甘露糖醛酸(M残基)和α-L-古洛糖醛酸(G残基),具有优良的生物相容性和可降解特性,在钙离子溶液中即可形成热稳定凝胶,不需要高温或有机化学试剂交联,有利于其作为可溶性缓释药物的包裹材料[2-3]。目前,利用藻酸盐优良的生物学特性制备的局部抗生素控释微球已经被用于慢性骨髓炎的治疗研究,取得了较好的治疗效果[4]。但是,单纯的万古霉素藻酸盐缓释微球释放的药物达到有效治疗浓度的持续时间还不足够长[5],已有左旋多聚赖氨酸被用于包裹藻酸盐抗生素微球,其药物有效释放时间得到延长[3]。笔者设计了FG-Vanco-AB缓释系统,对相应的条件进行优化,万古霉素的有效释放时间较前有所延长。
大量的抗生素可供临床和实验研究使用,但是,针对目前骨组织感染的救治现状,大量的耐药菌株的出现以及藻酸盐的包裹特性,万古霉素是最佳的选择对象。万古霉素是一种糖肽类抗生素,对引起骨感染常见的革兰阳性菌具有很强的杀灭能力,其中包括金黄色葡萄球菌和表皮葡萄菌(包括耐甲氧西林菌株),以及链球菌(包括化脓性链球菌)等[6-7]。同时,万古霉素易溶于水,可同藻酸盐制成混合溶液,通过滴注形成缓释微球。万古霉素无明显的毒副作用,不像青霉素类会引起强烈的变态反应。
用于局部埋置的药物缓释包裹材料的选择应当具有以下特点:生物相容性好,降解成分可被人体吸收;载药量高,可以满足局部用药的需要;所包裹的药物释放平缓,具有较低的突释率,避免瞬间形成可引起副作用的高药物浓度。藻酸盐具有良好的生物相容性和可降解特性,已被广泛用作细胞载体和药物缓释载体[8-9]。而异体和(或)异种纤维蛋白凝胶也因为其良好的生物相容性和黏附特性在临床中得以使用。如果使用患者自身的血浆制备凝胶,则可以完全避免潜在的诱导炎症和免疫反应的危险。
在本研究中,通过调整制备微球的藻酸盐和万古霉素的起始浓度,优化筛选万古霉素含量最高的缓释微球,提高单位质量微球的载药量,可以减少局部用药时缓释载体的放置量,避免过多的外源性物质对局部组织成骨可能造成的影响。同时,通过低压冻干和表面包裹纤维蛋白凝胶,使微球的储存更为方便,并延长了万古霉素的释放时间[10]。实验结果还表明,用于包裹藻酸盐微球的纤维蛋白凝胶的两种成分纤维蛋白原和凝血酶的浓度越高,微球中万古霉素的突释越少,其释放时间越长,这同 Jeon等[11]的研究相一致。具体原因在于形成纤维蛋白凝胶的主体是纤维蛋白原,凝血酶只是促进纤维蛋白原3条链当中的2条链αA和βB断裂,释放多肽A和B,使其转化为纤维蛋白单体,相互间自发聚集形成多聚体;同时凝血酶激活ⅩⅢ因子,激活的ⅩⅢ因子在Ca2+的作用下催化各纤维蛋白单体间的第三条链γ的谷氨酰胺残基和赖氨酸的ε-氨基形成共价键,最终形成网状的纤维蛋白多聚体[12]。纤维蛋白凝胶的包裹就像一层膜,纤维蛋白原的浓度越高,形成的膜越致密,孔径越小,限制了水分进入到藻酸盐微球,因而减少了万古霉素的洗脱。同时,高浓度成分形成的包裹外膜强度也高,限制了微球吸水后的膨胀,因而减慢了微球的崩解,延长了药物释放时间。凝血酶的浓度选定为400 IU/mL,而并未进行浓度优化,主要是基于以下考虑:形成的纤维凝胶蛋白膜的致密程度和强度主要是由纤维蛋白原的浓度决定的,凝血酶只是触发反应的酶;高浓度的凝血酶(如400 IU/mL)才可以保证在短时间内微球表面形成均匀一致的膜;缩短酶促反应时间,减少微球在溶液中浸泡的时间,避免微球中包含的药量因为浸泡而丢失。
药物缓释载体的安全性以及是否能够满足治疗需要也是本研究观察的重点。通过将不同方式处理的微球同MSCs共培养,观察细胞形态和活力的变化来评价其安全性,我们发现细胞的形态良好,活力轻度受抑制,体现了较好的安全性。对于缓释微球疗效的评价,主要是定时收集微球缓释的溶液并以高效液相色谱仪测定其中万古霉素浓度,以标准的ATCC 25923金黄色葡萄球菌株作为参照,通过测定万古霉素对其具有敏感杀灭作用的折点值,观察微球释放的万古霉素浓度可以满足杀灭金黄色葡萄球菌的时间长短。研究显示,有效的释放天数最长可达19 d,较其他包裹方式有所延长[3]。同时,高效液相色谱仪的应用,一方面可以提高溶液中万古霉素浓度检测的灵敏度,另一方面,根据待测物质出现峰形的时间,还可以判断是否为万古霉素而非其他物质。
总之,通过优化万古霉素和藻酸盐混合溶液的不同比例,筛选高含量的万古霉素藻酸盐微球。再通过调整包裹万古霉素藻酸盐微球的纤维蛋白凝胶的构成成分纤维蛋白原的浓度,筛选万古霉素缓释时间长的微球,在此基础上进一步检测其对共培养细胞的毒性和对标准菌株的活性。结果显示FG-Vanco-AB释放的万古霉素浓度体外达到可杀灭标准菌株的时间为19 d,对共培养细胞增殖影响微弱,提示其在骨科抗感染治疗中具有潜在的应用价值。
[1]侯天勇,罗 飞,许建中.山羊骨髓间充质干细胞的分离培养及鉴定[J].局解手术学杂志,2008,17(6):376 -378.
[2]Keshaw H,Forbes A,Day RM.Release of angiogenic growth factors from cells encapsulated in alginate beads with bioactive glass[J].Biomaterials,2005,26(19):4171 -4179.
[3]Ueng SW,Lee SS,Lin SS,et al.Biodegradable alginate antibiotic beads[J].Clin Orthop Relat Res,2000,(380):250 -259.
[4]Xing J,Hou T,Luobu B,et al.Anti-Infection Tissue Engineering Construct Treating Osteomyelitis in Rabbit Tibia[J].Tissue Eng Part A,2013,19(1 -2):255 -263.
[5]Chun KH,Kwon IC,Kim YH,et al.Preparation of sodium alginate micropheres containing hydrophilic β-lactam antibiotics[J].Arch Pharm Res,1996,19(1):106 -111.
[6]Mckee MD,Wild LM,Schemitsch EH,et al.The use of an antibiotic-impregnated,osteoconductive,bioabsorbable bone substitute in the treatment of infected long bone defects:early results of a prospective trial[J].J Orthop Trauma,2002,16(9):622 -627.
[7]Calhoun JH,Mader JT.Treatment of osteomylitis with a biodegradable antibiotic implant[J].Clin Orthop Relat Res,1997,(341):206 -214.
[8]Mehlhorn AT,Schmal H,Kaiser S,et al.Mesenchymal stem cells maintain TGF-beta mediated chondrogenic phenotype in alginate bead culture[J].Tissue Eng,2006,12(6):1393 -1403.
[9]Mierisch CM,Cohen SB,Jordan LC,et al.Transforming growth factorbeta in calcium alginate beads for the treatment of articular cartilage defects in the rabbit[J].Arthroscopy,2002,18(8):892 -900.
[10]Esquisabel A,Hernández RM,Igartua M,et al.Production of BCG alginate-PLL microcapsules by emulsification/internal gelation[J].J Microencapsul,1997,14(5):627 -638.
[11]Jeon O,Ryu SH,Chung JH,et al.Control of basic fibroblast growth factor release from fibrin gel with heparin and concentrations of fibrinpgen and thrombin[J].J Control Release,2005,105(3):249 -259.
[12]Sakiyama-Elbert SE,Hubbell JA.Development of fibrin derivatives for controlled release of heparin-binding growth factors[J].J Control Release,2000,65(3):389 -402.
