Cd和水分复合胁迫对玉米幼苗叶片抗氧化酶的活性与MDA含量影响
2014-09-25朱丹
朱 丹
(安徽中医药高等专科学校,安徽 芜湖 241000)
随着现代工业的迅猛发展及全球水资源的日益短缺,污水灌溉等行为的日益加剧,干旱地区的土壤重金属污染问题也日趋严重。研究表明活性氧(ROS)是植物对生物和非生物胁迫反应的典型特征,它可以使植物体内产生氧化胁迫,导致细胞膜脂过氧化以及蛋白质、核酸等生物大分子的氧化损伤甚至导致植物死亡[1-2]。植物则可启动抗氧化防御机制来应对胁迫所产生ROS,以减轻对细胞造成的伤害。对于植物ROS清除系统而言,主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等物质[3-4]。
近年来,对水分、重金属单一因素胁迫,不同重金属之间的复合胁迫已见诸多研究[5-7],而水分、重金属复合胁迫报道则不多。Cd是剧毒环境污染物,对植物具有明显的毒害作用[6]。玉米是旱地作物中需求量最大,对水分胁迫很敏感的作物之一,干旱是影响玉米产量的重要原因之一[8]。本试验以玉米为材料,以聚乙二醇6000(PEG6000)模拟水分胁迫条件,研究重金属Cd、水分复合胁迫对玉米叶片的抗氧化酶活性影响情况,为玉米幼苗对重金属和水分复合胁迫耐性研究提供理论依据。
1 材料与方法
1.1 材料及处理
供试玉米(Zea mays L.)为杂交种‘农大108’。用1%NaClO浸泡消毒后,于25℃催芽48h,挑选发芽一致的种粒在温度28/22℃(光/暗)、光照强度200μmol m-2s-1、光周期14/10 h(光/暗)的条件下培养,直至幼苗第二片叶完全展开。从茎基部快速割取玉米幼苗地上部分后,于蒸馏水处理1 h以洗脱伤害,然后进行各种处理。Cd设置三个浓度:200mmol/L、400mmol/L、800mmol/L;用PEG6000模拟水分胁迫共设置三个浓度:10%、20%、40%,分别对玉米幼苗叶片进行复合胁迫处理,组合方式为Cd 200+PEG 10%、Cd 200+PEG 20%、Cd 200+PEG 40%、Cd 400+PEG 10%、Cd 400+PEG 20%、Cd 400+PEG 40%、Cd 800+PEG 10%、Cd 800+PEG 20%、Cd 800+PEG 40%。每个处理共12株幼苗,分别供SOD、CAT、POD、MDA等4个指标,3次重复测定,每次测定时选取1株幼苗,叶片选取第二片,对照组为蒸馏水处理,时间均为8 h,取第二片叶液氮冻存后贮藏在超低温冰箱中,以备测定之需。
1.2 测定方法
MDA的含量采用硫代巴比妥酸(TBA)法[9];SOD活性采用氯化硝基四氮唑蓝(NBT)法测定[10],以抑制NBT光氧化还原50%的酶量为一个活性单位,以U/g为单位;CAT活性采用紫外吸收法[11],用△A 240表示POD活性;POD的活性采用愈创木酚法[11],用△A 470表示POD活性。
1.3 数据统计分析
数据采用Microsoft Excel软件进行作图,用DPS软件进行显著性分析。
2 结果与分析
2.1 Cd、水分单一及复合胁迫对玉米幼苗叶片SOD含量的影响
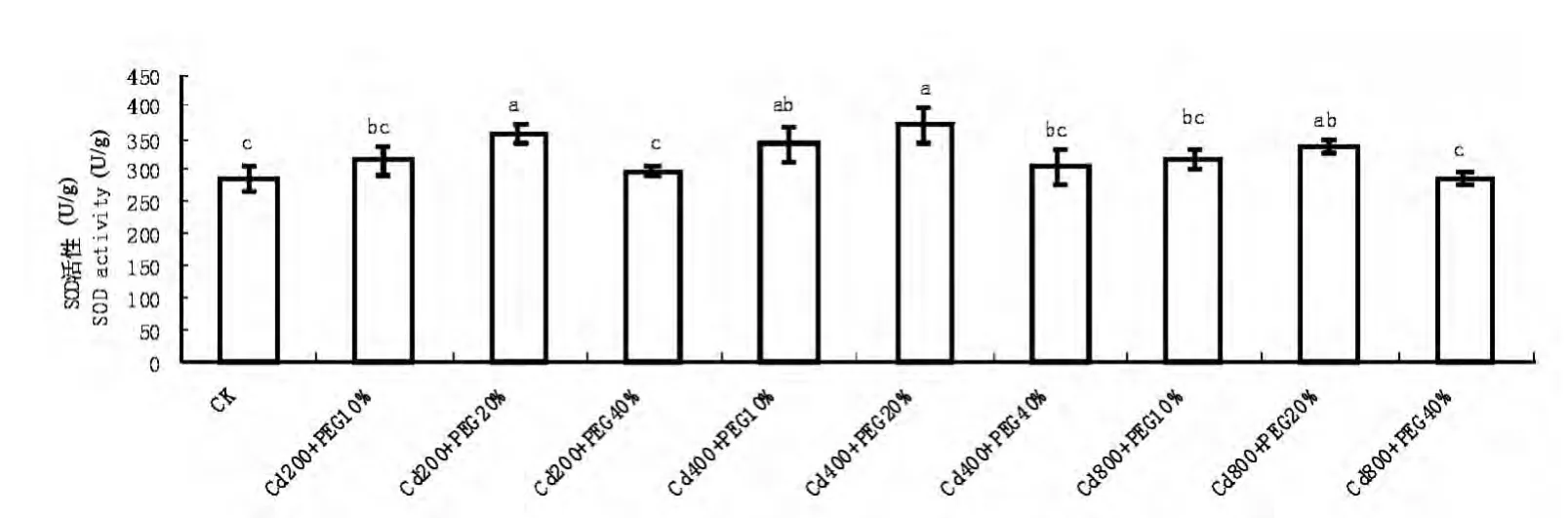
图1 Cd、水分复合胁迫对玉米幼苗叶片SOD活性的影响Fig.1 Effects of combined stress of Cd and water on SOD activity in leaves of maize seedlings
由图1可见,随着Cd和水分复合胁迫程度的加剧,玉米幼苗叶片SOD活性变化趋势较为复杂,但从整体上呈现出先升高后降低的趋势。在不同的Cd浓度处理下,随着水分胁迫程度的加剧,SOD活性都呈现出先升高后降的趋势。在Cd(400mmol/L)和PEG(20%)的复合处理下,SOD活性达到最大为对照的129.21%,在Cd(800mmol/L)和PEG(40%)的复合处理下,SOD活性最小,与对照差异不显著。
2.2 Cd、水分单一及复合胁迫对玉米幼苗叶片POD含量的影响
由图2可知,随着Cd和水分复合胁迫程度程度的加剧,玉米幼苗叶片POD活性变化趋势呈现出先升高后降低的趋势。即在低浓度Cd处理下,随着水分胁迫程度的加剧,玉米幼苗叶片内的POD活性逐渐升高,在Cd(200mmol/L)和PEG(40%)处理下,POD活性达到最大,且显著高于对照,为对照的233.33%;在中浓度Cd处理和高浓度Cd处理下,随着水分胁迫程度的加剧,玉米幼苗叶片内的POD活性呈现逐渐下降的趋势,在Cd(800mmol/L)和PEG(40%)处理下,POD的活性为对照的104.0%。
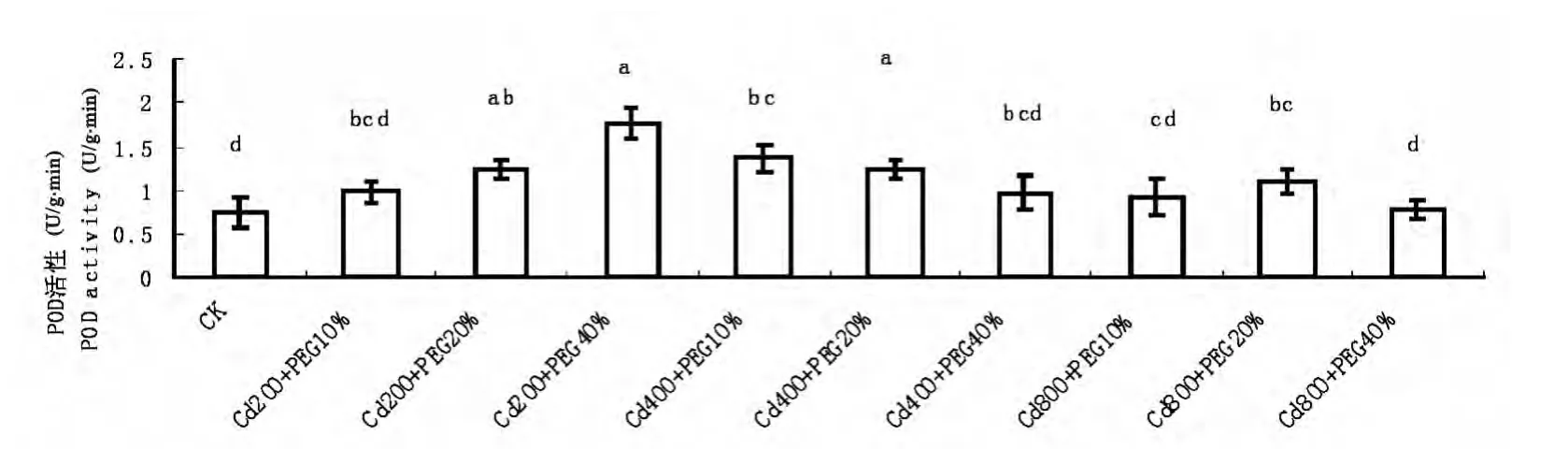
图2 Cd、水分复合胁迫对玉米幼苗叶片POD活性的影响Fig.2 Effects of combined stress of Cd and water on POD activity in leaves of maize seedlings
2.3 Cd、水分单一及复合胁迫对玉米幼苗叶片CAT含量的影响
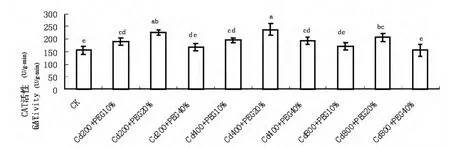
图3 Cd、水分复合胁迫对玉米幼苗叶片CAT活性的影响Fig.3 Effects of Cd and water combined stress on CAT activity in leaves of maize seedlings
图3显示,随着Cd浓度的增大和水分胁迫的加剧,玉米幼苗叶片的CAT含量变化与SOD类似:即在不同Cd浓度处理下,随着水分胁迫的加剧,玉米幼苗叶片CAT活性亦先升高后下降。其中在Cd(200mmol/L)和PEG(20%)复合处理下,CAT活性最大,为对照的146.73%;在Cd(800mmol/L)和PEG(40%)复合处理下,CAT活性最小,与对照差异不显著。
2.4 Cd、水分单一及复合胁迫对玉米幼苗叶片MDA含量的影响
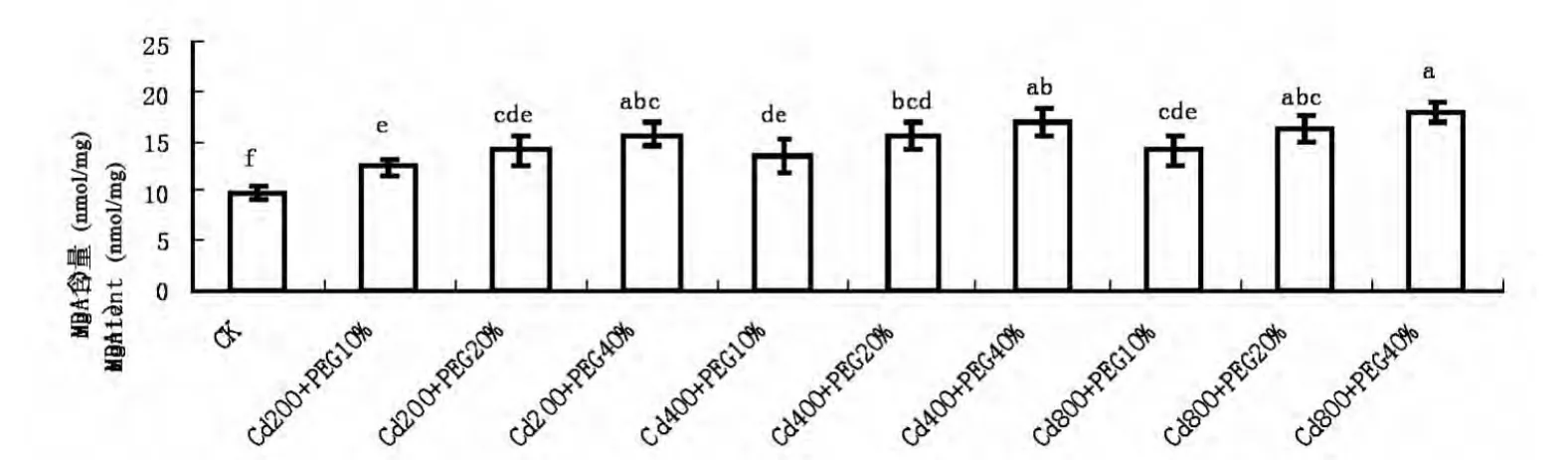
图4 Cd、水分复合胁迫对玉米幼苗MDA含量的影响Fig.4 Effects of Cd and water single and combined stress on MDA content in leaves of maize seedlings
由图4可知,随着Cd浓度的增大和水分胁迫的加剧,玉米幼苗叶片的MDA含量变化整体逐渐升高。即在低浓度、中浓度、高浓度Cd处理下,随着水分胁迫程度的加剧,MDA含量呈现逐渐升高的趋势,在Cd(800mmol/L)和PEG(40%)处理下,玉米幼苗叶片内的MDA含量达到最大值,为对照的188.38%。
3 结论与讨论
植物体内的抗氧化酶在清除植物体内产生的ROS,抑制膜脂过氧化,保护细胞免受伤害等方面起到了重要的作用。SOD是抵御活性氧自由基介导的氧化损伤的第一道防线,可通过Haber-weiss反应清除植物体内多余的超氧阴离子,是保护酶体系中的关键酶[12];CAT是一种包含血红素的4聚体酶,存在于所有的植物细胞中,它可将H2O2迅速分解为H2O和O2;POD与CAT共同作用消除由SOD作用产生过量的H2O2,使H2O2维持在一个较低的水平。MDA是膜脂过氧化的最终产物[13],其含量可直接反映出植物在逆境胁迫下所受到的伤害程度[14]。玉米幼苗叶片中的MDA含量随Cd处理水平的提高和水分胁迫程度的加剧而呈现逐渐增加的趋势,说明Cd和水分胁迫对生物膜系统造成伤害.影响植株的正常代谢。
本研究中,随着Cd和水分复合胁迫程度程度的加剧,玉米幼苗叶片SOD、CAT、POD活性表现出先升高后降低的趋势,这与前人研究结论一致,并且符合一般植物的应激性规律[15-16]。其中POD活性变化最为明显,在低浓度Cd(200mmol/L)条件下,随着水分胁迫的加剧,POD活性持续升高,直到与高浓度PEG(40%)复合胁迫时POD活性达到至高点后酶活不再上升;SOD和CAT的活性变化从整体上体现出先升后降的趋势,并且在低浓度、中浓度、高浓度Cd的同一水平下,随着水分胁迫的加剧,酶活变化值也是先增大后降低。同时,抗氧化酶达到最高值所对应的复合胁迫组合略有不同,如SOD达到最高值时的复合胁迫处理组合为Cd(400mmol/L)和PEG(20%),POD达到最高值时的复合处理组合为Cd(200mmol/L)和PEG(40%),CAT达到最高值时复合处理组合为Cd(200mmol/L)和PEG(20%),并显著高于对照。以上研究均表明,在不同浓度的Cd和不同程度的水分复合胁迫下,随着内源ROS清除剂的SOD、CAT和POD活性的升高,可在玉米幼苗叶片体内清除过剩的ROS,维持ROS代谢平衡,保护膜结构,使玉米幼苗叶片具有一定的抵抗复合胁迫的能力;但是玉米叶片抗氧化能力也有一定的局限性,当SOD、POD、CAT活性下降的时,说明玉米幼苗叶片体内ROS的增加超过了自身歧化能力,抗氧化能力开始减弱。这与本研究中MDA含量随着Cd和水分复合胁迫条件下数值上升趋势结论逻辑一致。数据显示,在复合胁迫组合Cd(800mmol/L)和PEG(40%)条件下,SOD、POD、CAT活性均达到最小并与对照差异不显著,同样复合胁迫处理下,MDA含量数值在所有复合胁迫组合中达到了最大,说明当玉米幼苗膜脂过氧化最大程度上受伤时,其抗氧化能力也达到了最弱。
由此可以认为在Cd和水分复合胁迫下,SOD、CAT、POD能在一定程度上可以缓解自由基积累与膜脂过氧化,但当复合胁迫超出了玉米幼苗叶片抗氧化能力的时候,抗氧化酶活性即可下降或被破坏。
:
[1]Dhindsa R S,Dhindsa P P,Reid D M.Leaf senescence and lipid peroxidation:Effects of some phytohormone and scavengers of free racdicals and singlet oxygen.Physiol Plant,1982:456 -457.
[2]李合生.现代植物生理学[M].北京:高等教育出版社,2002:415,419.
[3]周希琴,莫灿坤.植物重金属胁迫及其抗氧化系统[J].新疆教育学院学报,2003,6(2):103-108.
[4]闫成仕.水分胁迫下植物叶片抗氧化系统的响应研究进展[J].烟台师范学院学报:自然科学版,2002,18(3):220-225.
[5]桑建荣,陆军,蒋明义.水分胁迫和ABA处理对玉米叶片亚细胞器抗氧化酶活性的影响[J].江苏农业科学,2010(1):110-111.
[6]刘建新,赵国林,王毅民,等.Cd,Zn复合胁迫对玉米幼苗膜脂过氧化和抗氧化酶系统的影响[J].农业环境科学学报,2006,25(1):54 -58.
[7]王芳,姬茜茹,邱宗波,等.不同玉米品种对增强UV-B辐射与干旱复合胁迫的生理响应[J].农业环境科学学报,2009,28(3):438-442.
[8]王士谦.玉米抗旱性的研究进展(综述)[J].河北科技师范学院学报,2005,19(3):76-80.
[9]陈建勋,王晓锋.植物生理学实验[M].广州:华南理工大学出版社,2002.
[10]张志良.植物生理学实验指导[M].北京:高等教育出版社,1990.
[11]李合生,孙群,赵世杰.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000:125-128.
[12]郑荣梁,黄中洋.自由基医学与农学基础[M].北京:高等教育出版社,2001.
[13]Shah K,Kumar R G,Verma S,et al.Effect of cadmium on lipid peroxidation,superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J].Plant Sci,2001,161:1135 -1144.
[14]郑荣梁,黄中洋.自由基医学与农学基础[M].北京:高等教育出版社,2001.
[15]刘璐璐,柴明良,徐晓薇,等.γ射线辐照对春兰根状茎生长及抗氧化酶活性的影响[J].核农学报,2008,22(1):23-27.
[16]王广林,张金池,王丽,等.铜、锌胁迫对丁香蓼生理指标的影响[J].南京林业大学学报:自然科学版,2009,33(4):43-47.
