能斯特方程在电化学分析法中的分析研究
2014-09-22胡一雯河北联合大学以升创新教育基地河北唐山063009
胡一雯(河北联合大学 以升创新教育基地 河北唐山063009)
孙嬿 李春生(河北联合大学 化学工程学院 河北唐山 063009)
一、能斯特方程在电化学分析法中的分析
电化学分析法是借助电化学响应信号来测试未知待测体系物质浓度和组成,其在电位分析法、电解分析法、极谱分析法中均有关键体现[1-5]。
1.能斯特方程在电位分析法中应用
电位分析法是根据化学电池的电极电位的变化与溶液活度或浓度之间的关系进行分析的方法;可分为直接电位法和电位滴定法两大类。(1)直接电位法是利用测得的电位差值,直接计算出被测物质的活度或浓度,其核心在于电位差值与待测组分活度(浓度)之间的内在关系;(2)电位滴定法是通过测量滴定过程中指示电极的电位变化来确定滴定终点的分析手段,其关键要点在于根据滴定过程中电极电位的变化与滴定中消耗标准溶液的体积和浓度之间的关系来计算[2-5]。
2.能斯特方程在电解分析法中应用
电解分析法是将被测液置于电解装置中,使被测离子在电极上以金属或其它固体形式析出,再根据电解后所增加的重量来求算出对应物质含量的方法;[1,3,6]其包括电重量法和汞阴极分离法。(1)电重量法是通过称量待测元素在电极上以纯金属或难溶化合物形式存在的沉积物的重量,从而确定待测元素含量的方法;(2)汞阴极分离法则是通过将溶液中较易还原的金属析出在汞阴电极上,而使之与其他金属离子有效分离的技术。
因电解过程存在过电位η,而使得实际分解电压E2大于整个电池理论电压值E1。整个电池存在如下关系式:

在实际测量中,整个电池理论电压值E1取决于阳极理论电势EA与阴极理论电势EB的差值(E1=EA-EB)。然而,阴极和阳极理论电势均要应用能斯特方程来精确计算(公式2):
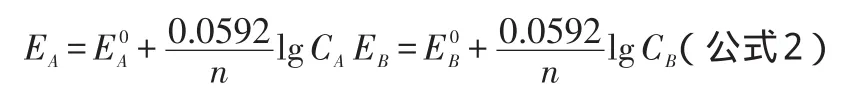
3.能斯特方程式在极谱分析法中应用
极谱分析法是工作电极选用滴汞电极、参比电极为面积很大的饱和甘汞电极(SCE),然后对待测液进行电解分析;其根据测量特殊条件下电解过程中的电流—电位或电流—时间曲线来分析的方法。这种方法将溶液电阻(iR)和金属在汞上的过电位(η)降低到极小而可忽略、面积很大的饱和甘汞参比电极的恒定电位为标准(Ea=0);从而使得电解过程中外加电压和电极电位之间的关系式(公式3)可简化成V=-Ede(vs.SCE)。此时,电极电位同样符合能斯特方程(公式4)。

结论
综上所述,本论文通过分析研究能斯特方程在电化学分析法中各个章节的联系,启发创新思维、不断激发电分析过程的研究热情,从而为电位分析法、电解分析法、极谱分析法的系统应用提供必要的理论基础和实践经验。
[1]张胜涛.电分析化学[M].四川:重庆大学出版社,2004.
[2](美)王(Wang J.)著;朱永春,张玲译.分析电化学[M].北京:化学工业出版社,2009.
[3]卢小泉,薛中华,刘秀辉.电化学分析仪器[M].北京:化学工业出版社,2010.
[4]刘玉海,杨润苗.电化学分析仪器使用与维护[M].北京:化学工业出版社,2011.
[5]李启隆等著.电化学与电分析化学—李启隆学术论文选[M].北京:北京师范大学出版社,2011.
[6]李启隆,胡劲波.电分析化学(第二版)[M].北京:北京师范大学出版社,2007.
