氧化石墨烯增强鲁米诺-过氧化氢化学发光测定姜黄素
2014-09-21张建霞刘希东
刘 霜,张建霞,2,刘希东
(1.重庆文理学院材料与化工学院,重庆 永川 402160;2.重庆市綦江实验中学,重庆 綦江 401420)
石墨烯(Graphene)是Novoselov、Geim等人于2004年首次发现的,它是一种由sp2杂化碳原子紧密堆积的单原子层结构的二维原子晶体,是构成包括石墨、碳纳米管、富勒烯等在内的碳的同素异形体的基本组成单元,属新型二维平面纳米材料.从Novoselov首次报道人工制备的石墨烯以来,研究发现石墨烯表现在力、热、电、光等物理学方面的优异性能,使之成为10年来物理学、化学、材料科学等多个领域的国际研究前沿和热点[1]. 氧化石墨烯(Graphene Oxide,简称GO)是石墨烯重要的含氧衍生物,它和石墨烯相比,在六角环形片状体碳原子上引入了羰基、羟基、羧基、环氧基等含氧极性官能团.由于氧化石墨烯表面带有的官能团具有亲水性,因此,具有一定的润湿性能和表面活性[2],在水中可以较好地分散.Wang Ying[3]等研究发现,GO 能增强CdTe量子点的电化学发光信号,并已将其应用于谷胱甘肽的电化学发光分析中;Dong Xiaoli[4]等利用GO具有表面积大和吸附作用强等特点,将GO作为固体萃取吸附剂应用于角鲨烯的测定,建立了角鲨烯的时间分辨质谱测定方法,实现了GO在固相中的分离与检测;冯亚娟[2]等基于GO和辣根过氧化物酶的相互作用将其应用于过氧化氢的测定;Song Yujun[5]等研究发现,氧化石墨烯本身也具有过氧化物酶的功能,能催化葡萄糖反应生成过氧化氢,由此建立了血液和果汁中葡萄糖的间接测定方法.虽然GO在分析测定方面已有了一定的应用研究,但总体上GO在分析化学领域的应用还处于探索阶段,特别是将GO应用于光分析方面的研究较少,因此探究其在光分析化学中的应用具有一定的价值和研究前景.
化学发光分析法已广泛应用于药物分析、环境分析、材料分析和临床分析等领域[6].在碱性介质中,Luminol能被H2O2氧化产生稳定的化学发光信号,已成为应用最广泛的化学发光体系之一.文献报道,许多纳米材料对H2O2-Luminol化学发光体系的发光具有增强作用[7-8].GO特殊的单原子层片层结构决定了其在电学、光学方面的特殊性质[3,5].本文采用化学发光分析法,研究GO对H2O2-Luminol发光体系的影响,发现GO在H2O2-Luminol体系中起着催化作用,能明显增敏该发光反应.
姜黄素(Curcumin)(结构如图1所示)是姜科姜黄属植物中的有效成分之一,从药用植物姜黄中提取的姜黄素,除姜黄素外还包括少量去甲氧基姜黄素和双去甲氧基姜黄素.研究表明:姜黄素[9,10]具有抗氧化、抗炎等多种生物活性,对肿瘤的发生发展等多个阶段均有抑制作用,作为天然色素的姜黄素色泽稳定,毒性极低,已广泛应用于食品添加剂和医药等领域[11],同时,也有研究表明其具有一定的细胞毒性[12],因此评价姜黄属植物中姜黄素的含量具有实际意义.姜黄素的测定方法主要有电化学法[13]、毛细管电泳法[14]、光分析法[15]、化学发光法[16]、高效液相色谱法[17]等.其中,化学发光法灵敏度高,检测限低而被广泛应用.本文通过实验研究发现姜黄素对GO增强H2O2-Luminol化学发光具有明显的抑制作用,结合流动注射技术,建立了流动注射-化学发光法定量测定姜黄素含量的分析方法.实验表明:该方法用于市售姜黄中姜黄素的测定,结果令人满意.
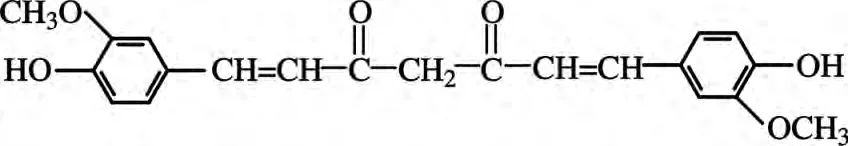
图1 姜黄素的结构式
1 实验部分
1.1 仪器与试剂
RFL-1型超微弱化学发光/生物发光检测仪、IFIS-C型智能流动注射进样器、IFFL-A型多功能化学发光检测器(西安瑞迈分析仪器有限公司).
Luminol储备溶液(1.0×10-2mol/L):准确称取0.443 0 g Luminol(Fluka),溶于0.1 mol/L的NaOH溶液中,用0.1 mol/L的NaOH溶液定容于250 mL棕色容量瓶中,4℃冰箱保存,使用时用0.1 mol/L的NaOH溶液稀释至所需浓度.
H2O2溶液(0.75 mol/L):用30﹪H2O2溶液配制,现配现用.
姜黄素标准储备溶液(1.00×10-3mol/L):准确称取0.092 0 g姜黄素(国药集团化学试剂有限公司),溶于75﹪乙醇溶液中,用75﹪乙醇溶液定容于250 mL棕色容量瓶中,4℃冰箱保存,操作溶液用75﹪乙醇溶液逐级稀释储备溶液,现配现用.
实验试剂均为分析纯,实验用水均为二次蒸馏水.
1.2 实验方法及装置
如图2所示流路装置,二次蒸馏水作载流,样品溶液通过八通阀随载流溶液注入到GO与H2O2的混合溶液中,经三通混合后再注入到Luminol溶液,混合液在流通池中发生氧化反应,反应产生的化学发光信号由RFL-1型超微弱化学发光/生物发光检测仪检测,以相对发光强度△I定量.

图2 流动注射化学发光分析流程图
2 结果与讨论
2.1 发光体系和流路参数的选择
H2O2在碱性条件下能氧化Luminol产生化学发光,实验发现GO对Luminol-H2O2化学发光反应具有很强的增敏作用,而姜黄素对GOLuminol-H2O2三元体系的化学发光强度具有明显的抑制作用.当选择流动注射系统如下流路参数时:流通管内径0.8 mm,采样环长度15 cm,阀池距16 cm,Luminol浓度2.0×10-3mol/L,H2O2浓度0.75 mol/L,GO 浓度 0.8 mg/mL,试验了流路参数对反应体系的相对化学发光强度的影响.结果表明,体系的相对化学发光强度随泵速的增加而增大,该反应体系属快速化学发光体系,选择高泵速有利于提高体系的灵敏度.但泵速提高,试剂消耗也显著增加.综合考虑各种因素,调整P1、P2的泵速均为85 r/min,体系可获得最大信噪比.
2.2 NaOH浓度和Luminol浓度的影响
Luminol能溶于NaOH溶液,而且Luminol的化学发光反应在碱性条件下能顺利进行,其化学发光强度大而稳定,NaOH浓度明显影响体系的化学发光强度.实验考察了用浓度为0.01~1.0 mol/L的NaOH溶液配制的Luminol溶液对体系相对化学发光强度的影响,结果表明,当NaOH溶液浓度为0.1 mol/L时,体系的相对化学发光强度最大.因此,实验用0.1 mol/L NaOH溶液配制Luminol溶液.实验考察了1.0×10-5~1.0×10-2mol/L浓度范围内的Luminol溶液对化学发光强度的影响.如图3所示,Luminol在低浓度时,体系的相对化学发光强度较低,微小增大Luminol浓度,体系的相对化学发光强度迅速增强,当Luminol浓度为2.0×10-3mol/L时,体系的相对化学发光强度达到最大;当其浓度超过2.0×10-3mol/L时,体系的背景发光强度也迅速增大,相对化学发光强度缓慢降低,实验选择Luminol的浓度为2.0×10-3mol/L.
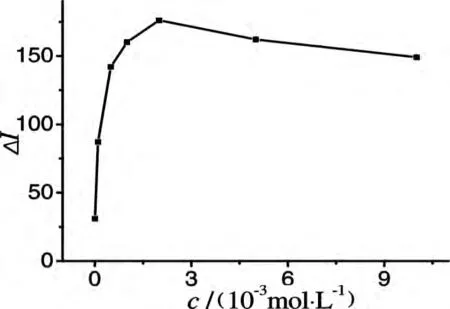
图3 Luminol浓度的影响
2.3 过氧化氢浓度的影响
在GO-Luminol-H2O2三元化学发光体系中,作为氧化剂的H2O2,其浓度将会影响体系的化学发光强度,实验考察了0.1~2.0 mol/L浓度范围的H2O2溶液对体系化学发光强度的影响.结果表明,体系的化学发光强度随H2O2浓度的增加而增强,当H2O2的浓度为0.75 mol/L时,体系的化学发光强度最大,随后伴随H2O2浓度的增加,基线漂移不稳定,体系的相对化学发光强度缓慢降低,实验选择H2O2浓度为0.75 mol/L.
2.4 GO浓度的影响
在GO-Luminol-H2O2化学发光体系中,GO作为反应体系的催化剂,不同的GO浓度,对体系的影响程度也不同.当姜黄素浓度为1.0×10-5mol/L、H2O2浓度为 0.75 mol/L、Luminol浓度为2.0×10-3mol/L时,实验考察了GO在0.15~1.50 mg/mL浓度范围内对体系的相对化学发光强度的影响.如图4所示,体系的相对化学发光强度随GO浓度的增加而增强,随后缓慢减弱,实验选择GO浓度为0.8 mg/mL.
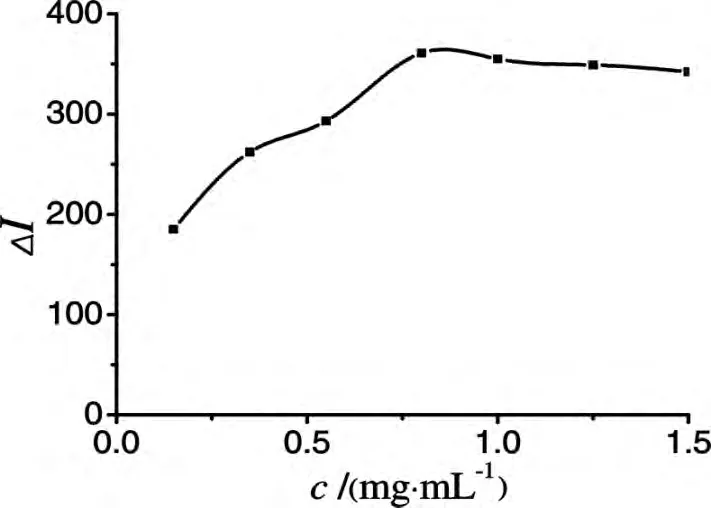
图4 GO浓度的影响
2.5 校准曲线、检出限和精密度实验
按照实验方法和在优化的实验条件下,测定了不同浓度的姜黄素对体系相对发光强度的影响.如图5所示,姜黄素在5×10-8~1.0×10-5mol/L浓度范围内与相对化学发光强度呈良好的线性关系,线性方程为△I=0.1636c+106.027,R2=0.9989(c的数量级及单位为10-8mol/L);以11次空白测定值标准偏差的3倍计算方法的检出限(3σ)为6.3×10-9mol/L.对浓度为5×10-6mol/L的姜黄素平行测定9次,相对标准偏差为2.6﹪.
2.6 共存物质的干扰
文献报道[18],姜黄的活性成分除姜黄素外,还含有糖类、挥发性油类及微量金属元素等.在优化的实验条件下,试验了一些常见物质对测定姜黄素的影响.结果表明,50倍量的葡萄糖、蔗糖、淀粉、草酸、柠檬酸,5 倍量的 Zn2+、Al3+、Mg2+、Mn2+、Ca2+、Co2+,等倍量的 Cu2+、Fe3+对于5.0 ×10-6mol/L浓度的姜黄素的测定无干扰.
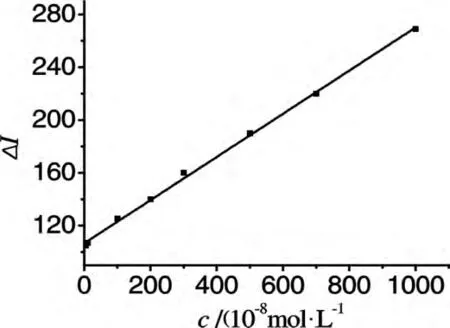
图5 校准曲线
2.7 样品的测定
取姜黄药材适量,粉碎,准确称取0.200 g姜黄粉末,用50 mL乙醇(75﹪)超声提取30 min,过滤;取残渣加入50 mL乙醇(75﹪)中再次超声提取30 min,过滤,合并两次滤液用乙醇(75﹪)定容至250 mL,得待测样品溶液,由于姜黄素极易被氧化,因此姜黄素的标准溶液和样品溶液均应避光于4℃冰箱中保存.
取一定量的样品溶液,用乙醇(75﹪)溶液适度稀释,按照实验方法测定姜黄素总量,同时做样品回收率实验,结果与文献[15]的紫外分光光度法结果基本一致.

表1 姜黄样品中姜黄素总量的测定结果
3 结论
在碱性条件下,H2O2氧化Luminol产生化学发光,GO能显著增强Luminol化学发光反应.实验发现姜黄素对GO-Luminol-H2O2化学发光体系有抑制作用,GO能使体系的相对化学发光强度明显降低,结合流动注射分析技术,建立了姜黄素的化学发光分析测定新方法.此法用于药用姜黄中总姜黄素的测定,结果与文献[15]报道的紫外分光光度法测定结果基本一致.
[1]Novoselov K S,Geim A K,Morozov S V,et al.Electric field effect inatomically thin carbon films[J].Science,2004,306:666-669.
[2]冯亚娟,魏玉萍,赵晓慧,等.氧化石墨烯在辣根过氧化物酶传感器中的应用研究[J].化学研究与应用,2011,23(4):444-450.
[3]Wang Y,Lu J,Tang L H,et al.Graphene oxide amplified electrogenerated chemiluminescence of quantum dots and its selective sensing for glutathione from Thiol-containing compounds[J].Analytical Chemistry,2009,81(23):9710-9715.
[4]Dong X L,Cheng J S,Li J H,et al.Graphene as a novel matrix for the analysis of small molecules by MALDI-TOF MS[J].Analytical Chemistry,2010,82(14):6208-6214.
[5]Song Y J,Qu K G,Zhao C,et al.Graphene oxide:intrinsic peroxidase catalytic activity and its application to glucose detection[J].Advanced Materials,2010,22(19):2206-2210.
[6]石文兵,张小丹,何少慧,等.化学发光法快速筛选纳米颗粒模拟酶[J].中国科学:化学,2013,43:1591-1598.
[7]Li S F,Zhang X M,Du W X,et al.Chemiluminescence reactions of a luminol system catalyzed by ZnO nanoparticles[J].Journal of Physical Chemistry C,2008,113(3):1046-1051.
[8]Xie J X,Huang Y M.Co3O4nanoparticles-enhanced luminol chemiluminescence and its application in H2O2and glucose detection[J].Analytical Methods,2011,3(5):1149-1155.
[9]王玉玲,吴振,张喜轩.姜黄素类化合物的抗肿瘤活性[J].中国医科大学学报,2006,35(4):380-381.
[10]梁广,田吉来,邵丽丽,等.姜黄素的构效关系及以其为先导物的抗肿瘤化合物研究进展[J].化学通报,2008(2):110-117.
[11]肖小河,苏中武,乔传卓,等.姜黄属药用植物研究进展[J].中草药,1997,28(2):114-119.
[12]Chan W H,Wu H Y,Chang W H.Dosage effects of curcumin on cell death types in a human osteoblast cell line[J].Food and Chemical Toxicology,2006,44(8):1362-1371.
[13]程司,刘智广,曹云新,等.姜黄素的化学测定的新方法[J].第四军医大学学报,2000,21(2):241-243.
[14]袁凯龙,翁前锋,张宏颖,等.毛细管电泳法测定尿中的姜黄素[J].色谱,2004,22(6):609-612.
[15]刘红星,陈福北,黄初升,等.紫外分光光度法在姜黄素类化合物提取中的应用[J].广西师范学院学报:自然科学版,2008,25(3):68-72.
[16]刘爱林,蔡怡珊,陈伟.反向流动注射化学发光法测定姜黄素[J]. 分析试验室,2010,29(12):8-11.
[17]Jayaprakasha G K,Jagan Mohan Rao L,Sakariah K K.Improved HPLC method for the determination of curcumin,demethoxy curcumin,and bis demethoxy curcumin[J].Journal of Agricultural Food Chemistry,2002,50(13):3668-3672.
[18]葛跃伟,高慧敏,王智民.姜黄属药用植物研究进展[J].中国中药杂志,2007,32(23):2461-2467.
