AgO的制备及影响因素分析
2014-09-21吴军李丰朱刚陈大鹏周章华
吴军,李丰,朱刚,陈大鹏,周章华
(武汉船用电力推进装置研究所,武汉 430064)
0 引言
过氧化银因具有特殊的电磁性能、电化学性能,在蓄电池比功率要求较高的军事、航空航天等高新技术领域有重要的应用[1]。由于对于AgO的化学制备方法研究较少,制备的AgO粒度大,纯度较低[2],有些方法污染严重[3],严重地阻碍过氧化银的生产和应用。
采用液相沉淀法,以过硫酸钾为氧化剂,以转化率为评价指标,分析了反应温度、时间、摩尔比等工艺参数对制备AgO含量的影响,确定了AgO的最佳制备工艺;利用XRD、SEM等分析了制备的AgO粉末的物相组成、形貌及粒度分布,以期为AgO的应用提供理论依据。
1 实验
1.1 实验试剂及仪器
过硫酸钾(分析纯),氢氧化钠(分析纯),硝酸银(分析纯),碘化钾溶液(4﹪),盐酸(3 M),硫代硫酸钠(0.1 M),淀粉指示剂(0.5﹪)。
扫描电子显微镜为荷兰FEI公司的Quanta 200型扫描电子显微镜。粉末衍射仪为日本理学公司生产的Dmax- 2550型粉末衍射仪。
1.2 实验原理
采用化学法制备过氧化银。主要原理如下:

根据上述原理,将加入AgNO3溶液的烧瓶恒温水浴锅内保温,再加入NaOH溶液,反应5 min后加入K2S2O8溶液,反应数小时。反应完成后将产物用去离子水洗涤至溶液呈中性并不含离子为止,过滤得到AgO湿粉,置于60℃真空烘箱内6 h,得到AgO粉。
2 结果与讨论
2.1 制备工艺对AgO含量的影响2.1.1 反应温度
在m(K2S2O8)/m(AgNO3)=1.2,m(NaOH)/m(AgNO3) = 2.5,t=8h的条件下选取不同的反应温度进行试验,得到表1所示结果。由表1可以看出,当温度为30~60℃时,AgO含量呈现增加趋势;当温度大于60℃时,AgO含量减小。而温度过高时,AgO热稳定性较差,会自行分解放出氧气,发生以下反应:

从而导致AgO含量降低。而且,过量的K2S2O8会发生分解,产生以下反应:
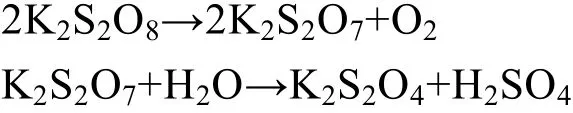
K2S2O8分解生成K2S2O7(焦硫酸钾),而焦硫酸钾水溶液呈强酸性,会与AgO发生反应,导致AgO产量大幅降低。因此,制备AgO需要一个合理的温度,通过上述试验结果可知,最佳反应温度为60℃。

表1 反应温度对AgO含量的影响
2.1.2 K2S2O8用量
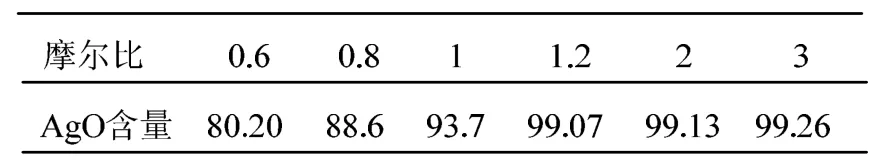
在m(NaOH)/m(AgNO3)=2.5,T=60℃,t=8h并选取不同的氧化剂用量的条件下进行试验,得到表2所示结果。从表2可以看出m(K2S2O8)/m(AgNO3)对AgO含量的影响分为两个阶段,当比值在0.6~1.2之间,AgO含量呈上升趋势。当继续增加比值到1.2~3后,转化率增加趋势缓慢。
K2S2O8与AgNO3用量的理论比应为0.5,然而此反应需要在强氧化氛围下发生且K2S2O8受热会分解,所以K2S2O8要适当过量。
由化学反应速率方程:

可知K2S2O8的增加可加快反应速度,然而当m(K2S2O8)/m(AgNO3)到1.2后,转化率已经很高,反应速度不是制约因素。
另根据吉布斯自由能公式:

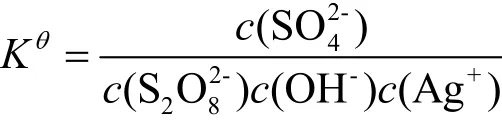
当K2S2O8用量增加时促进反应向正方向进行,但当K2S2O8用量过多时,K2S2O8分解的SO42-就会促进反应向逆方向进行。所以选取m(K2S2O8)/m(AgNO3)为1.2时是比较适宜的。
表2 K2S2O8用量对AgO含量的影响
?
2.1.3 NaOH用量
在m(K2S2O8)/m(AgNO3)=1.2,T=60℃,t=8h并选取不同的NaOH用量的条件下进行试验得到表3所示结果。m(NaOH)/m(AgNO3)的理论值应为2,然而需要一部分NaOH来中和K2S2O8受热分解所产生的硫酸以防止生成的AgO溶解,所以NaOH应适当过量。由表3可以看出当比值等于2时,AgO含量已经较高,当达到2.5后,AgO含量增加并不明显。由此选择m(NaOH)/m(AgNO3)比值为2.5是比较合适的。

表3 NaOH用量对AgO含量的影响
2.1.4 反应时间
在m(K2S2O8)/m(AgNO3)=1.2,m(NaOH)/m(AgNO3) = 2.5,T=60℃的条件下选取不同的反应时间进行试验得到表4所示结果。由表4可以看出,在反应时间小于8 h时,AgO含量是随反应时间的延长而增加的。而当反应时间超过8h后,AgO含量的含量反而有所下降,这是由于AgO的热稳定性差,AgO分解造成的。故反应时间8h是比较适宜的。

表4 反应时间对AgO含量的影响
综上所述,以AgNO3为原料,NaOH为沉淀剂,K2S2O8为氧化剂,制备AgO粉末的最佳制备工艺参数为:反应温度为60℃,m(K2S2O8)/m(AgNO3)=1.2,反应时间为8 h,m(NaOH)/m(AgNO3)=2.5。制备的粉末中AgO含量为
99.07%。
2.2 AgO的表征
2.2.1 XRD分析
对用最佳工艺制备的AgO粉末进行XRD测试,其结果如图1所示。由图1可见,在2θ为32.040°、32.279°、34.160°、37.180°、39.418°、53.836°、以及56.719°处均出现很强的衍射峰,分别对应AgO的(200)、(11)、(002)、(111)、(02)、(11) 、(113)晶面。图中②为AgO标准PDF卡,编号为PDF No.43-1038,与测试结果十分吻合。
根据XRD测试结果,由Scherrer公式估算AgO的晶粒尺寸约为52nm,检索鉴定晶相归属得到AgO的晶体结构属于单斜晶系。

图1 AgO粉末的XRD图谱
2.2.2 SEM分析

图2 AgO粉末的SEM照片
图2为按最佳工艺制备所得AgO粉末SEM图。从图中可以看到制备的粉末粒度为约1~3 μm,大部分为短棒状,少部分为片状。这与XRD分析得到的AgO晶系归属符合,为单斜晶系晶体。
3 结论
实验采用液相沉淀法制备AgO粉体,并研究了各种工艺参数的影响,得出如下结论:
1)以AgNO3为原料,NaOH为沉淀剂,K2S2O8为氧化剂,用液相沉淀法制备了AgO粉体。制备AgO粉末的最佳工艺参数为:反应温度60℃,m(NaOH)/m(AgNO3)=2.5,m(K2S2O8)/m(AgNO3)=1.2,反应时间为8 h,制得的AgO含量为99.07%,粒度约1~3 μm,为短棒状形貌。
2)此工艺相比沈文宁[4]、尹海顺[5]等的纳米银粉制备工艺时间长,原因是其K2S2O8用量为AgNO3的五倍,从而大大缩短了反应时间。而此工艺优点在于K2S2O8用量较少,且制得AgO粉为微米级,振实密度较纳米银粉大,作为电池正极时便于压制。
[1]David F Smit h, George R, Graybill, Robert K Grubbs and J ames A Gucinski. New development s in very high rate silver oxide elect rodes [J ]. Power Sources,1997, 65 : 47252.
[2]Xiao Xuesong, Zhou Guoguang, Chen Kanget al.Journal of East China University of Science and Technology[J], 2005, 31(5): 620
[3]Zhang Yu, Pan Junqing, Wan Pingyuet al. China Patent, 1994891A[P], 2007.
[4]沈文宁, 冯拉俊, 雷阿利, 孔珍珍. 超细过氧化银粉末的制备及其表征, 稀有金属材料与工程, 2011,Vol.40.
[5]尹海顺, 毛健, 白昱, 高跃生, 文贵华, 涂铭旌. 液相沉淀法制备纳米AgO 粉体影响因素的正交分析,化工新型材料, 2009.
