miR-503通过靶定IGF-1R基因抑制胃癌生长与侵袭
2014-09-21胡俊华喻琴杨艳果王琦卢光新
胡俊华,喻琴,杨艳果,王琦,卢光新
(1.湖北医药学院附属人民医院消化内科,十堰 442000;2.湖北医药学院附属人民医院儿科,十堰 442000)
胃癌(gastric carcinoma)是源自胃黏膜上皮的恶性肿瘤,是我国最常见的恶性肿瘤之一,其发病率占消化道全部恶性肿瘤的首位。我国每年约有17万人死于胃癌,几乎为恶性肿瘤致死的全部患者的1/4。研究[1-4]表明,微小 RNA(miRNA)与胃癌的发生发展密切相关,多种miRNA在非恶性组织和胃癌组织中差异性表达。研究[5]发现,miR-503在胃癌细胞中可以抑制胃癌细胞的生长及细胞间质转化,但是关于miR-503在胃癌中作用机制的研究尚不明确。本实验利用实时定量PCR(Real-time PCR)证实了miR-503在胃癌中呈现低表达,可以抑制胃癌细胞生长,并且探索了miR-503对胃癌细胞生长和侵袭能力的影响机制及其发挥该作用的靶基因胰岛素样生长因子1受体(IGF-1R),为胃癌的治疗提供了新的靶点。
1 材料与方法
1.1 材料和试剂
1.1.1 病理样本 10例胃癌及癌旁组织样本,由天津肿瘤医院病理科提供,并已通过病理学验证。
1.1.2 细胞 人胃癌细胞系 MGC-803和SGC-7901,购于上海中科院细胞库。
1.1.3 主要试剂 胎牛血清购自Hyclone公司;DMEM高糖培养基、1640细胞培养基及转染用OPTI-MEM 均购自 Gibico公司;转染试剂LipofectamineTM2000购自Invitrogen公司(美国);miR-503模拟物、模拟物对照、IGF-1R 干扰RNA、干扰RNA对照均购买于上海吉玛技术制药有限公司;反转录酶及Real-time PCR试剂盒购自Takara公司;体外细胞侵袭的Transwell小室购自Millipore公司;兔抗人IGF-1R、GAPDH(内参)多克隆抗体以及羊抗兔二抗购自Abcam公司。
1.2 方法
1.2.1 细胞培养 人胃癌细胞系MGC-803使用90%DMEM高糖培养基+10%胎牛血清培养;SGC-7901使用1640培养基+10%胎牛血清培养。培养条件为37℃,5%CO2的细胞培养箱培养。
1.2.2 细胞转染 在转染前16~20h,将贴壁的细胞消化下来,铺在6孔板中。调整细胞密度,使其接种时细胞汇合度达到70%~80%,然后按照Lipofectamine TM 2000说明书进行转染。
1.2.3 RNA提取和Real-time PCR 用Trizol提取组织样品中的总RNA,然后使用Nano-Drop分光光度仪器进行RNA浓度测定,琼脂糖凝胶电泳鉴定RNA的质量。应用特异miR-503的反转录引物,同时用U6作为内参;对于大片段基因的检测,用 Oligo(dT)作为通用引物,β-actin作为内参。Real-time PCR总反应体系20μL,其中包括cDNA和primer各1μL、SYBR荧光染料10μL、ddH2O 7 μL,反应程序为95℃,变性2min;95℃15s,60℃45s条件下40个循环。
1.2.4 Western blot检测蛋白表达水平 将转染48h处理后的细胞用PBS清洗,使用裂解液RIPA(50mM Tris-Cl pH 7.2,150mM NaCl,1%TritonX-100和0.1%SDS)裂解后提取蛋白,利用BCA方法测定蛋白浓度,最后用40μg蛋白上样,进行SDS-PAGE电泳检测。100V2h分离,横流转膜,5%脱脂奶室温封闭2h后,IGF-1R一抗(1∶1 000)4℃摇床孵育过夜,TBST清洗后使用HRP标记的二抗(1∶10 000)室温孵育2h,TBST清洗后应用化学发光法曝光显影。
1.2.5 平板细胞克隆形成实验 将转染后的胃癌细胞按照200个细胞/孔的密度接种到12孔板,使单个细胞分散均匀,并放置于37℃,5%CO2的细胞培养箱内培养。每隔2d换液,当细胞形成肉眼可见(超过50个细胞)的克隆时,终止培养,然后用PBS清洗细胞,利用5%结晶紫进行染色并拍照计数。各细胞样本接种3个复孔。
1.2.6 Transwell检测细胞迁移能力 在转染前16~20h,将贴壁的细胞消化下来,铺在24孔板中。调整细胞密度,使其接种时细胞汇合度达到70%~80%,然后按照Lipofectamine TM 2000说明书进行转染。转染24h后,将细胞接种在Matrigel覆盖的Transwell上层小室内(2×105细胞/孔),重悬在无血清培养基中,而小室底部是10%血清的培养基。待迁移24h后,将小室取出来,用甲醛和乙酸混合液固定15min,1×PBS清洗,用棉签将小室内未穿过的细胞擦掉,结晶紫染色后用1×PBS冲洗。随机性选择3个视野进行拍照计数,计算平均每个视野下发生侵袭的细胞数目。
1.3 统计学方法
应用Excel 2010对数据进行统计学分析,计量数据以均数±标准差(±s)表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Real-time PCR检测人胃癌及癌旁组织中miR-503及IGF-1RmRNA的表达情况
选取10例临床胃癌及其癌旁组织样本提取RNA,利用Real-time PCR检测其 miR-503及IGF-1RmRNA的表达情况。miR-503在胃癌样本中的表达量明显低于癌旁组织的表达量(P<0.01);IGF-1RmRNA的表达情况正好相反,在胃癌样本中的表达量明显高于癌旁组织(P<0.01)(见图1A、图1B)。
2.2 平板细胞克隆形成实验检测miR-503对胃癌细胞增殖的影响
用平板细胞克隆形成实验检测人胃癌细胞系MGC-803和SGC-7901的增殖能力,与对照组比较,转染了 miR-503模拟物的 MGC-803和SGC-7901细胞的克隆数目均有明显减少,差异具有统计学意义 (P<0.05)(见图2)。
2.3 Transwell小室实验检测miR-503对胃癌细胞侵袭能力的影响
用Transwell小室实验检测细胞的迁移能力,结果显示,相较于对照组,转染miR-503模拟物的MGC-803和SGC-7901的细胞穿透膜数目均明显减少,差异具有显著统计学意义(P<0.01)(见图3)。
2.4 Western blot检测miR-503对IGF-1R蛋白水平的影响
用IGF-1R一抗孵育,进行 Western blot实验检测miR-503对IGF-1R是否有影响。结果显示,转染miR-503模拟物的两种胃癌细胞MGC-803和SGC-7901中IGF-1R的蛋白水平相比于对照组,均有明显降低(见图4)。
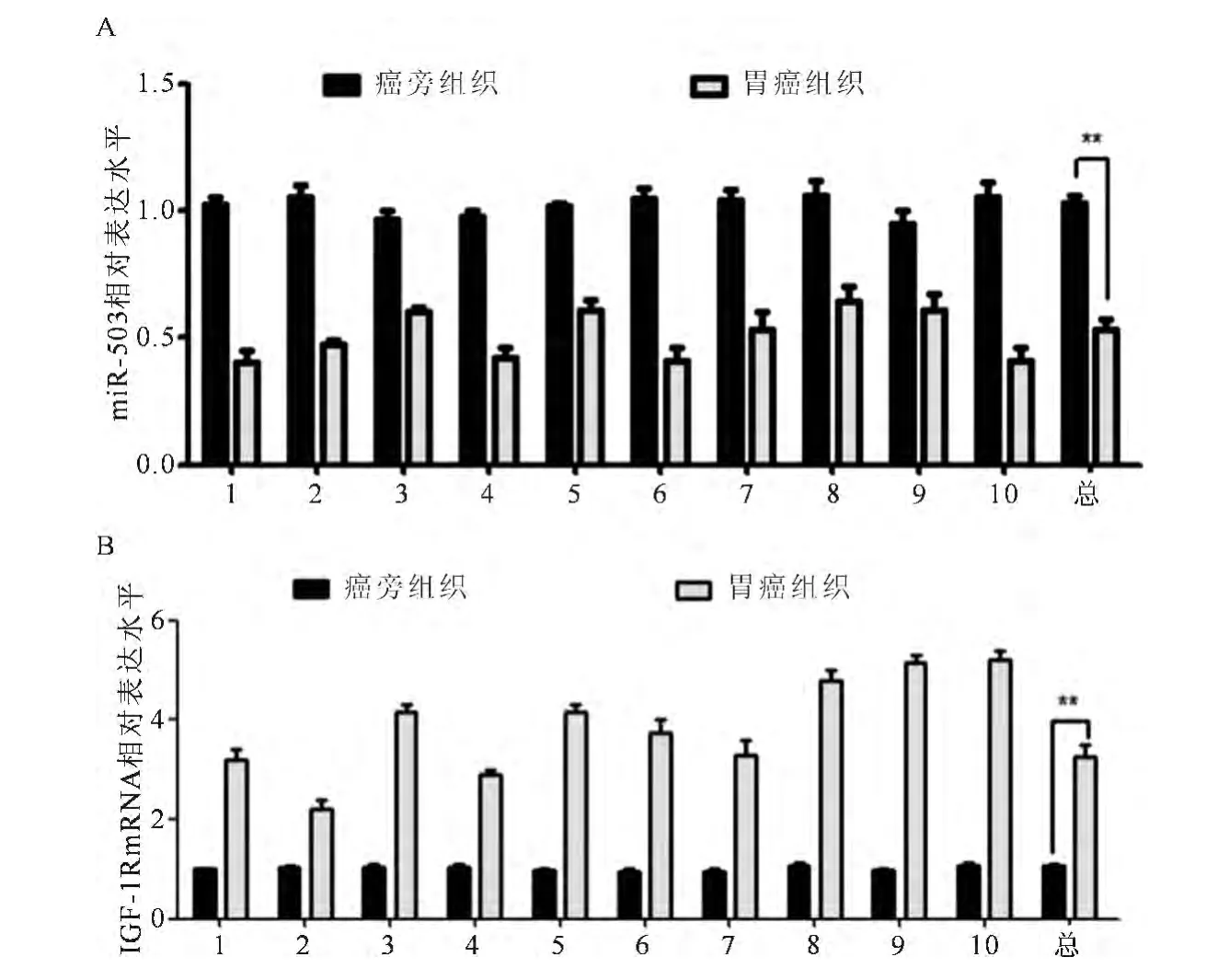
图1 miR-503和IGF-1RmRNA在胃癌及癌旁组织中的表达情况
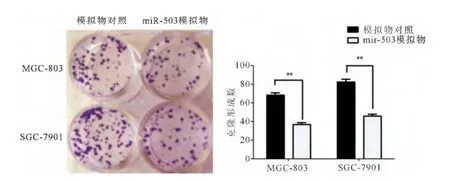
图2 平板细胞克隆形成实验检测miR-503过表达对胃癌细胞增殖的影响
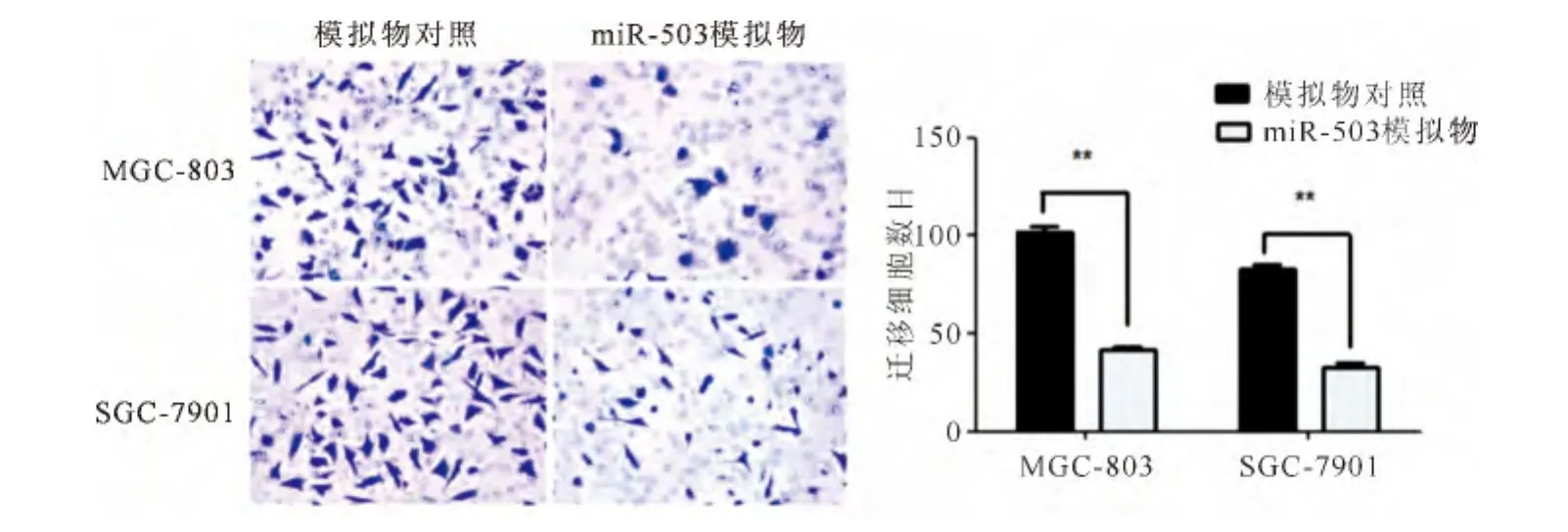
图3 Transwell小室实验检测过表达miR-503对胃癌细胞侵袭的影响
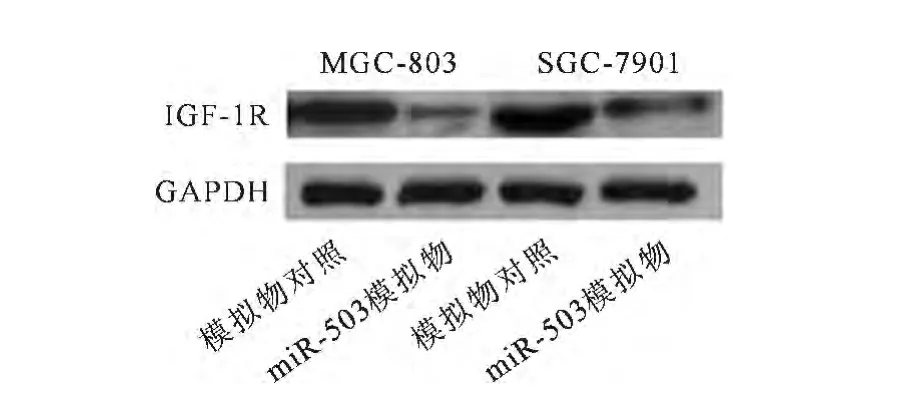
图4 Western blot检测过表达miR-503对IGF-1R蛋白水平的影响
2.5 RNA干扰IGF-1R基因表达对胃癌细胞生长和侵袭的影响
利用 Western blot检测IGF-1R的表达情况,相较于干扰RNA对照组,转染了IGF-1R干扰RNA的胃癌细胞中IGF-1R的表达明显降低。通过平板克隆形成实验结果显示,与对照组相比,转染了的IGF-1R干扰RNA的细胞克隆数目均减少,差异有显著统计学意义(P<0.01);通过Transwell小室实验显示,转染IGF-1R干扰RNA的细胞穿透膜数目较对照组均明显减少,差异有显著统计学意义(P<0.01)(见图5A、图5B和图5C)。
3 讨论
MicroRNA是Lee等[6]于1993年在真核生物中发现的一类具有调控功能的内源性非编码RNA,其大小约20~25个核苷酸,通过与目的mRNA序列中的部分碱基序列相互配对,从而调控部分编码蛋白的基因表达,进而调控各种不同的生物进程。近年来研究[1-4]表明,miRNA与包括胃癌在内的多种癌症的发生相关,且多种miRNA可定位于基因组上与癌症相关的脆性位点,可见其在癌症的发生过程中起着至关重要的作用。因此,miRNA越来越多地引起研究者关注,这也将使miRNA成为疾病诊断潜在的生物学标记,还可能使这一分子成为药物靶标,或是模拟miRNA分子进行新药物研发,可能会给人类疾病的治疗提供一种新的手段。
越来越多的研究表明,miRNA在肿瘤中起着原癌基因或抑癌基因的作用,与胃癌有着密切的关系。Chan等[7]通过研究发现,大部分胃癌患者中miR-21都在肿瘤中出现过度表达;Liu等[8]研究发现,miR-27a在胃腺癌中表现上调,抑制miR-27a将明显抑制胃癌细胞的生长;Arisawa等[9]发现,miR-27a基因区域多态性可能是促进胃黏膜萎缩的重要因子。
最新研究[10,11]发现,miR-503在肝癌、肺癌中有明显表达差异。此外,miR-503在胃癌细胞中低表达[5]。本实验通过 Real-time PCR对10例胃癌组织和癌旁组织进行检测,证实了miR-503在胃癌组织中确实呈现低表达。在 MGC-803和SGC-7901的两种人胃细胞转染miR-503模拟物,平板细胞克隆形成实验结果表明,过表达miR-503可以明显抑制胃癌细胞的增殖,同时Transwell实验表明,过表达miR-503的胃癌细胞侵袭能力明显减弱。两种细胞的实验结果一致,提示miR-503可能作为一种抑癌基因,参与抑制了肿瘤的生长和侵袭。
IGF-1R是IGF信号通路的关键蛋白,包括三阴性乳腺癌、胃癌[12,13]在内的多种恶性癌症中均有高表达。大量流行病学以及临床病理学的实验结果显示,由于胰岛素样生长因子1(IGF-1)的上调,IGF-1R在多种肿瘤细胞中均存在过量表达,其表达量和肿瘤发生率呈高度相关,因此,可以认为IGF-1R是具有良好开发前景的肿瘤治疗靶点,寻找新的IGF-1R高选择性的抑制剂则具有重要的临床意义和应用前景。研究[14]表明,miR-503在神经胶质母细胞瘤中可以通过抑制IGF-1R的表达来发挥抑癌基因的作用。本研究通过Western blot的检测结果显示,过表达 miR-503的胃癌细胞 MGC-803和SGC-7901的IGF-1R蛋白水平均有明显降低;且通过siRNA敲除人胃癌细胞系 MGC-803和SGC-7901中的IGF-1R后,平板克隆形成实验和Transwell小室实验结果显示,敲除IGF-1R的表达后,细胞克隆形成能力和侵袭能力表现出相似的降低趋势,进一步证实了miR-503通过靶定IGF-1R基因调控胃癌细胞的生长和侵袭,发挥着抑癌基因的作用。
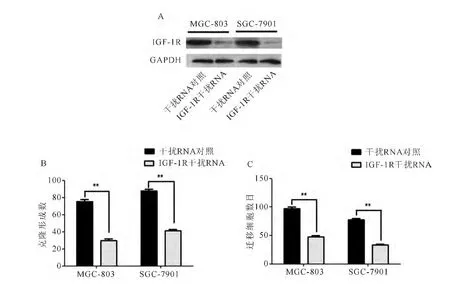
图5 RNA干扰IGF-1R基因表达对胃癌细胞生长和侵袭的影响
综上所述,在人胃癌细胞中miR-503通过靶定IGF-1R基因进而调控胃癌细胞的生长和侵袭,发挥着抑癌基因的作用,该结果为探索治疗胃癌的新分子标记物提供了新策略。
[1]Wang D,Luo L,Guo J.miR-129-1-3p inhibits cell migration by targeting BDKRB2in gastric cancer[J].Med Oncol,2014,31(8):98.
[2]Li X,Wang F,Qi Y.MiR-126inhibits the invasion of gastric cancer cell in part by targeting Crk[J].Eur Rev Med Pharmacol Sci,2014,18(14):2031-2037.
[3]Shen ZY,Zhang ZZ,Liu H,etal.miR-375inhibits the proliferation of gastric cancer cells by repressing ERBB2 expression[J].Exp Ther Med,2014,7(6):1757-1761.
[4]Duan Y,Hu L,Liu B,etal.Tumor suppressor miR-24 restrains gastric cancer progression by downregulating RegIV[J].Mol Cancer,2014,13(1):1-13.
[5]Peng Y,Liu YM,Li LC,etal.microRNA-503inhibits gastric cancer cell growth and epithelial-to-mesenchymal transition,[J].Oncol Lett,2014,7(4):1233-1238.
[6]Lee RC, Feinbaum RL, Ambros V.The C.elegantsheterochronic gene lin-4encoded small RNAs with antisense complementarity to lin-14 [J].Cell,1993,75(5):843-854.
[7]Chan SH,Wu CW,Li AF,etal.miR-21MicroRNA Expression in Human Gastric Carcinomas and its Clinical Association[J].Anticancer Res,2008,28(2A):907-911.
[8]Liu T,Tang H,Lang Y,etal.MicroRNA-27afunctions as an oncogene in gastric adenocarcinoma by targeting prohibitin[J].Cancer Lett,2009,273(2):233-242.
[9]Arisawa T,Tahara T,Shibata T,etal.A Polymorphism of microRNA-27aGenome Region Is Associated With the Development of Gastric Mucosal Atrophy In Japanese Male Subjects[J].Dig Dis Sci,2007,52(7):1691-1697.
[10]Xiao F,Zhang W,Chen L,etal.MicroRNA-503inhibits the G1/S transition by downregulatingcyclin D3and E2F3in hepatocellular carcinoma[J].J Transl Med,2013,22(11):195.
[11]Qiu T,Zhou L,Wang T,etal.miR-503regulates the resistance of non-small cell lung cancer cells to cisplatin by targeting Bcl-2[J].Int J Mol Med,2013,32(3):593-598.
[12]Terwisscha van Scheltinga AG,Berghuis P,Nienhuis HH,et al.Visualising dual downregulation of insulin-like growth factor receptor-1and vascular endothelial growth factor-A by heat shock protein 90inhibition effect in triple negative breast cancer[J].Eur J Cancer,2014,S0959-8049(14):752-757.
[13]Xu L,Qu X,Hu X,etal.Lipid raft-regulated IGF-1R activation antagonizes TRAIL-induced apoptosis in gastric cancer cells[J].FEBS Lett,2013,587(23):3815-3823.
[14]Zhang Y,Chen X,Lian H,etal.MicroRNA-503acts as a tumor suppressor in glioblastoma for multiple antitumor effects by targeting IGF-1R[J].Oncol Rep,2014,31(3):1445-1452.
