维生素B1对5~15周龄鹅营养物质利用率、肠道形态及微生物菌群的影响
2014-09-20王宝维葛文华张名爱徐晨晨贾玉辉史雪萍
王宝维 王 姣 葛文华 张名爱 岳 斌 徐晨晨 贾玉辉 史雪萍
(青岛农业大学优质水禽研究所,青岛 266109)
肠道为动物消化吸收的主要器官,对生长发育具有重要的作用。肠道的发育以及肠内环境的状况决定了营养物质消化与吸收的情况,进而影响到饲料的利用率。维生素B1是维持动物生长必不可少的一种水溶性维生素,它作为糖代谢中间产物丙酮酸氧化脱氢酶的组成部分,能够调节神经及胃肠功能[1]。当动物缺乏维生素B1时,体内糖代谢紊乱,血液及组织的糖代谢过程中就会产生丙酸和乳酸,二者积累会造成酸中毒[2]。维生素B1缺乏因阻断了丙酮酸生成乙酰辅酶A而导致组织能量生成受阻,从而导致神经纤维不能传导神经冲动,进而影响到消化系统的功能[3]。众多研究发现,维生素B1对动物的消化系统有一定的影响。孟昭聚等[4]研究发现,仔鹅缺乏维生素B1时,胃内有炎症,肠壁变薄,十二指肠溃疡并有萎缩现象。徐存华等[5]剖检维生素B1缺乏的青年母鸡发现,肌胃角质膜薄而干枯,呈深褐色,难剥离,小肠(特别是十二指肠)发生溃疡,黏膜粗糙,肠壁变厚。王忠[6]也发现,绵羊缺乏维生素B1导致肠黏膜脱落,肠壁变薄,并伴有出血现象。Tafaj等[7]研究发现,饲粮维生素B1水平与瘤胃液中维生素B1含量呈二次负相关,且瘤胃液中维生素B1含量与短链脂肪酸浓度呈正相关,与瘤胃pH呈负相关。迄今为止,关于动物维生素B1营养缺乏症方面的研究较多,维生素B1对鹅营养物质利用率、消化道发育、肠道微生物及组织学的影响未见系统报道,本试验以5~15周龄肝用型青农灰鹅为研究对象,探讨饲粮中添加不同水平维生素B1对鹅营养物质利用率、肠道形态及微生物菌群的影响,旨在进一步探明维生素B1与动物消化功能的关系,并为鹅饲粮中维生素B1营养需要量的确定提供理论依据。
1 材料与方法
1.1 基础饲粮
基础饲粮营养水平参照 NRC(1994)[8]家禽营养需要量设计配方。基础饲粮组成及营养水平见表1。维生素 B1含量的测定采用 GB/T 14700—2002的方法。5~15周龄鹅基础饲粮中维生素B1含量为0.80 mg/kg。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.2 试验设计
1.2.1 饲养试验设计
选择5周龄体重相近的健康大型青农灰鹅(法国米朗德、阿蒂盖品种杂交配套选育而成)360只,随机分为6个处理,每个处理6个重复,每个重复10只鹅(公母各占1/2)。5~15周龄饲粮中维生素B1水平(基础饲粮中维生素B1含量+添加量)分别为 0.8(Ⅰ组)、2.6(Ⅱ组)、4.4(Ⅲ组)、6.2(Ⅳ组)、8.0(Ⅴ组)、9.8 mg/kg(Ⅵ组)。Ⅰ组为对照组,试验期为11周。
1.2.2 代谢试验设计
在饲养试验第12周龄时从每个重复中随机抽取体重相近的健康鹅1只,每组6只,共36只,单笼饲养,自由采食和饮水。预试期4 d,再禁食1 d,正式试验饲喂3 d后,采用全收粪法按时收集3 d的粪便。再禁食2 d后连续3 d饲喂无氮饲粮(表2),并每天收集排泄物作为内源样品进行内源校正(在禁食12 h时适当补充6%的葡萄糖水)。试验期间,每天饲喂120 g饲粮,同时记录剩料量,计算采食量。收集到的粪便要剔除其中的鹅毛及皮屑等杂物,再用10%的盐酸固氮,放入烘箱中烘干,以便测定营养物质利用率。
1.3 饲养管理
试验鹅全期舍饲,自由采食和饮水,地面平养,少喂勤添。育雏期给予正常光照和温度。每天记录饲喂量、耗料量和死淘数等数据,观察鹅的生长状况,并按正常免疫程序进行免疫。
1.4 测定指标及方法
1.4.1 营养物质利用率测定
将粪样放在65~75℃的烘箱中烘干,然后再在自然状态下回潮24 h制成风干样,最后用小型粉碎机将干粪粉碎,置于干燥器中保存待测。

表2 无氮饲粮组成Table 2 Composition of nitrogen-free diet %
1.4.2 肠道形态的测定
饲养试验的15周龄末时,从每个重复组中分别抽取2只,共测定72只,抽测的鹅体重接近该组平均体重,称重后放血屠宰,迅速剖开腹腔,摘取全部消化道,并按十二指肠、空肠、回肠、盲肠(单侧)的顺序测量各段长度。按下列公式计算肠长指数和肠体指数:
肠长指数(%)=[肠长(cm)/体斜长(cm)]×100;
肠体指数(mg/g)=肠重(mg)/活体重(g)。
1.4.3 微生物的测定
取15周龄末处死的试验鹅,分别取1 g盲肠内容物于盛有9 mL灭菌稀释液的灭菌试管中,用漩涡振荡器混匀,制成10-1稀释液,然后用微量移液器移取1 mL该稀释液于另一盛有9 mL灭菌稀释液的试管中,振荡混匀,制成10-2稀释液,依次进行稀释,得到10-3~10-6稀释液,每个稀释度各3滴分别接种于相应的培养基上,每个梯度设2个重复,其中大肠杆菌采用伊红美蓝琼脂培养基(EMB培养基),双歧杆菌采用双歧杆菌选择性培养基(BBL培养基),乳酸杆菌采用乳酸细菌培养基(MRS培养基)。大肠杆菌37℃需氧培养24 h后计数,双歧杆菌和乳酸杆菌35℃厌氧培养48 h后计数,以30~300个菌落的稀释度作为计数用。细菌数量采用平板菌落计数法进行统计,按公式(每克肠道内容物中细菌数量=菌落数×滴数×稀释倍数)计算出每克内容物中的细菌数量,最后以每克肠道内容物中细菌个数的对数值[lg(CFU/g)]表示。
1.4.4 切片制作方法
取15周龄末处死的试验鹅,在空肠中段处剪下约1 cm的肠段,用0.9%的生理盐水洗净后放入10%的甲醛固定液中固定。将固定好的小肠组织修理后用乙醇脱水,二甲苯透明,石蜡包埋进行切片,最后用苏木精-伊红(HE)染色,在显微镜下观察并照相。
1.5 统计分析
试验数据采用SPSS 17.0中单因素方差分析中的LSD法进行多重比较。数据结果以“平均值±标准差”表示。
2 结果与分析
2.1 维生素B1对鹅营养物质利用率的影响
由表3可知,各组间干物质(DM)、有机物(OM)和中性洗涤纤维(NDF)利用率差异不显著(P>0.05)。粗蛋白质(CP)利用率Ⅲ组显著高于对照组(P<0.05);粗脂肪(EE)利用率Ⅳ组显著高于对照组(P<0.05);粗纤维(CF)利用率Ⅳ、Ⅴ组极显著高于对照组(P<0.01),Ⅱ、Ⅲ、Ⅵ组均显著高于对照组(P<0.05);酸性洗涤纤维(ADF)利用率Ⅱ组显著高于对照组(P<0.05);钙(Ca)利用率Ⅱ、Ⅲ、Ⅳ组极显著高于对照组(P<0.01),Ⅴ组显著高于对照组(P<0.05);磷(P)利用率Ⅲ组显著高于对照组(P<0.05),其他各组与对照组间均差异不显著(P>0.05)。当维生素 B1水平为2.6 mg/kg时,ADF和Ca的利用率均达到最高;当维生素B1水平为4.4 mg/kg时,CP和P的利用率均达到最高;当维生素B1水平为6.2 mg/kg时,EE和CF的利用率均达到最高。
由此表明,饲粮中添加不同水平维生素B1能够极显著提高鹅对饲粮中CF和Ca的利用率,显著提高CP、EE、ADF和P的利用率。
2.2 维生素B1对鹅肠道形态的影响
2.2.1 肠长指数
由表4可知,15周龄时,Ⅴ组十二指肠肠长指数最大,显著高于对照组(P<0.05),其他各组间差异不显著(P>0.05);Ⅴ组空肠肠长指数最大,Ⅱ、Ⅲ、Ⅳ、Ⅴ组均显著高于Ⅰ组(P<0.05)。Ⅳ组回肠肠长指数最大,Ⅳ、Ⅴ组显著高于Ⅰ组(P<0.05);Ⅳ组盲肠肠长指数最大,显著高于Ⅰ组(P<0.05)。
由此表明,饲粮中添加6.2~8.0 mg/kg维生素B1对肠道肠长指数有显著影响。

表3 维生素B1对鹅营养物质利用率的影响表3 Effects of vitamin B1on nutrient digestibility of geese %

表4 维生素B1对鹅肠道肠长指数的影响Table 4 Effects of vitamin B1on intestinal length index of geese %
2.2.2 肠体指数
由表5可知,15周龄时,Ⅳ组十二指肠肠体指数最大,Ⅳ组极显著高于对照组(P<0.01),Ⅲ、Ⅴ、Ⅵ组显著高于对照组(P<0.05);Ⅴ组空肠肠体指数最大,Ⅱ、Ⅲ、Ⅳ组显著高于对照组(P<0.05),Ⅴ组极显著高于对照组(P<0.01);Ⅴ组回肠肠体指数最大,Ⅲ、Ⅴ组极显著高于对照组(P<0.01);盲肠肠体指数Ⅱ、Ⅲ、Ⅳ、Ⅵ组显著高于对照组(P<0.05)。
由此表明,饲粮中添加不同水平的维生素B1对各种肠体指数有不同程度的影响。
2.3 维生素B1对鹅盲肠微生物菌群的影响
由表6可知,15周龄时,Ⅲ组大肠杆菌数量最少,Ⅲ、Ⅳ组极显著低于对照组(P<0.01),Ⅱ、Ⅴ组显著低于对照组(P<0.05);Ⅴ组双歧杆菌数量最多,Ⅱ、Ⅲ、Ⅴ组显著高于对照组(P<0.05);Ⅱ组乳酸杆菌数量最多,Ⅱ、Ⅲ、Ⅵ组显著高于对照组(P<0.05)。
由此表明,饲粮中添加适宜水平维生素B1对盲肠中大肠杆菌、双歧杆菌和乳酸杆菌的数量有显著影响。

表5 维生素B1对鹅肠道肠体指数的影响Table 5 Effects of vitamin B1on intestinal body index of geese mg/g
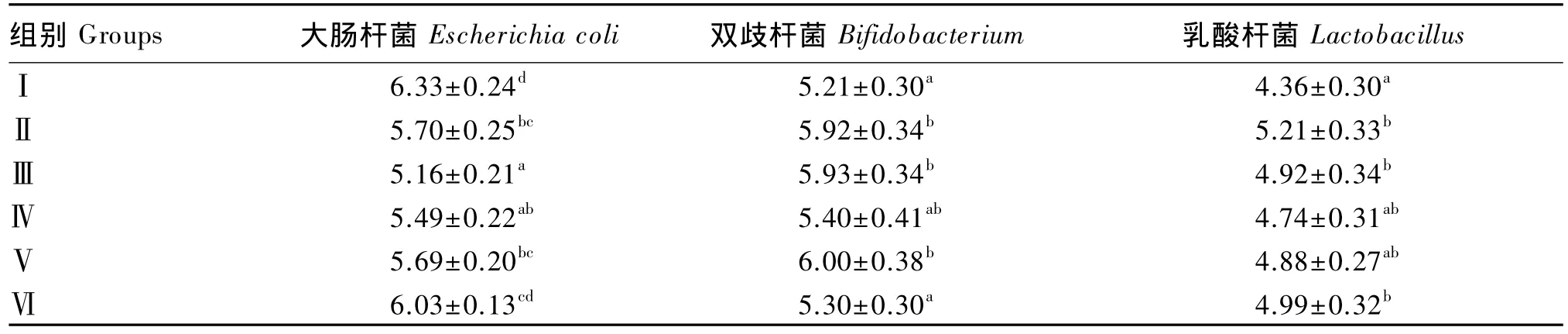
表6 维生素B1对鹅盲肠微生物菌群的影响Table 6 Effects of vitamin B1on microbial flora in cecum of geese lg(CFU/g)
2.4 肠道组织形态
2.4.1 空肠绒毛形态
由表7可知,15周龄时,Ⅲ组绒毛高度最高,Ⅲ、Ⅳ组显著高于对照组(P<0.05);肠壁厚度Ⅲ组显著低于对照组(P<0.05);隐窝深度Ⅲ组极显著低于对照组(P<0.01),Ⅳ组显著低于对照组(P<0.05);Ⅲ组绒毛高度/隐窝深度最高,Ⅲ组极显著高于对照组(P<0.01)。
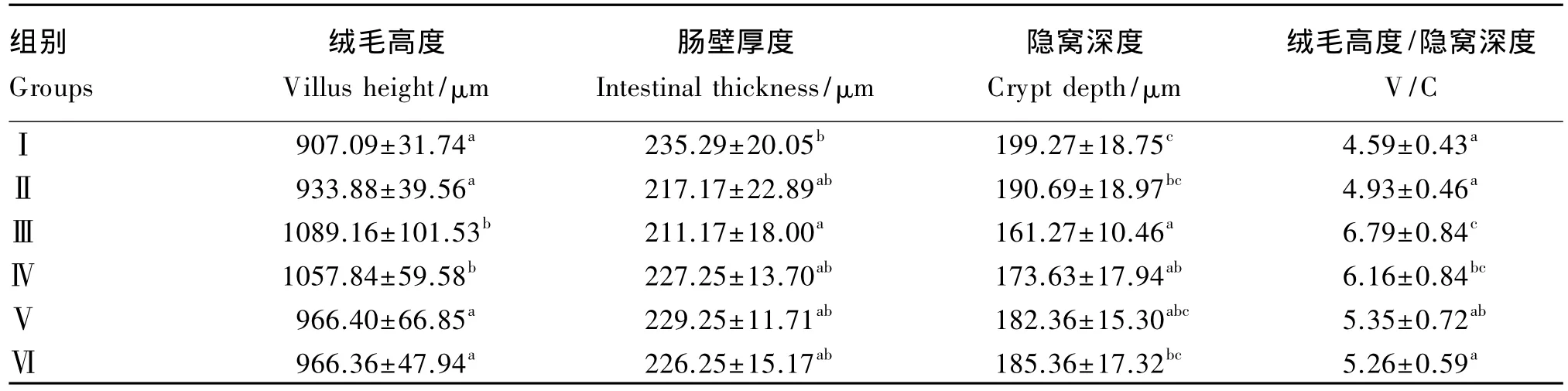
表7 维生素B1对鹅空肠绒毛形态的影响Table 7 Effects of vitamin B1on jejunum villi shape of geese
2.4.2 空肠绒毛组织学切片
采用日本OLYMPUS生物显微镜(10×10倍)对15周龄空肠绒毛组织切片进行观察,其组织结构变化情况见图1。
由图1可以看出,对照组空肠绒毛细且短,长度Ⅱ~Ⅵ组均短,且隐窝较深、肠壁较厚。Ⅱ~Ⅴ组绒毛较长且排列整齐、隐窝较浅、肠壁较薄。
肠道组织形态表明,饲粮中维生素B1水平为2.6~8.0 mg/kg时对15周龄鹅肠道发育具有显著影响,进而影响鹅的消化生理活动,调节营养物质的消化吸收。
2.5 空肠绒毛形态与营养物质利用率的相关性
由表8可知,鹅空肠绒毛高度与 DM、OM、CP、EE、CF、NDF、Ca、P 的利用率呈极显著正相关(P<0.01);肠壁厚度与 DM、CP、ADF 和 Ca的利用率呈显著负相关(P<0.05),与P的利用率呈极显著负相关(P<0.01);隐窝深度与DM、OM、CP、EE、NDF和 P的利用率呈极显著负相关(P<0.01),与CF和Ca的利用率呈显著负相关(P<0.05);除ADF外,绒毛高度/隐窝深度与饲粮各营养物质利用率均呈极显著正相关(P<0.01)。
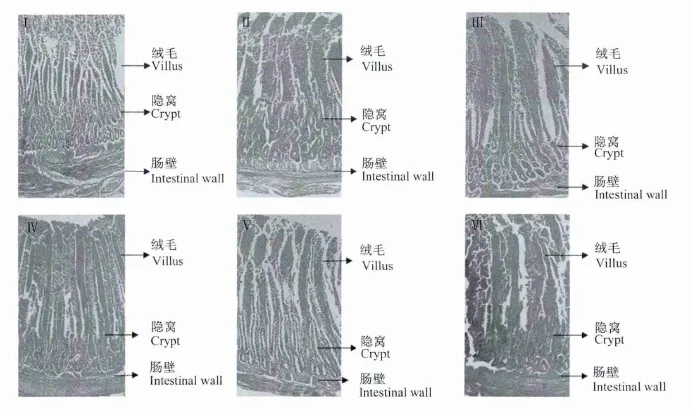
图1 空肠绒毛组织切片Fig.1 Jejunal villi tissue slice
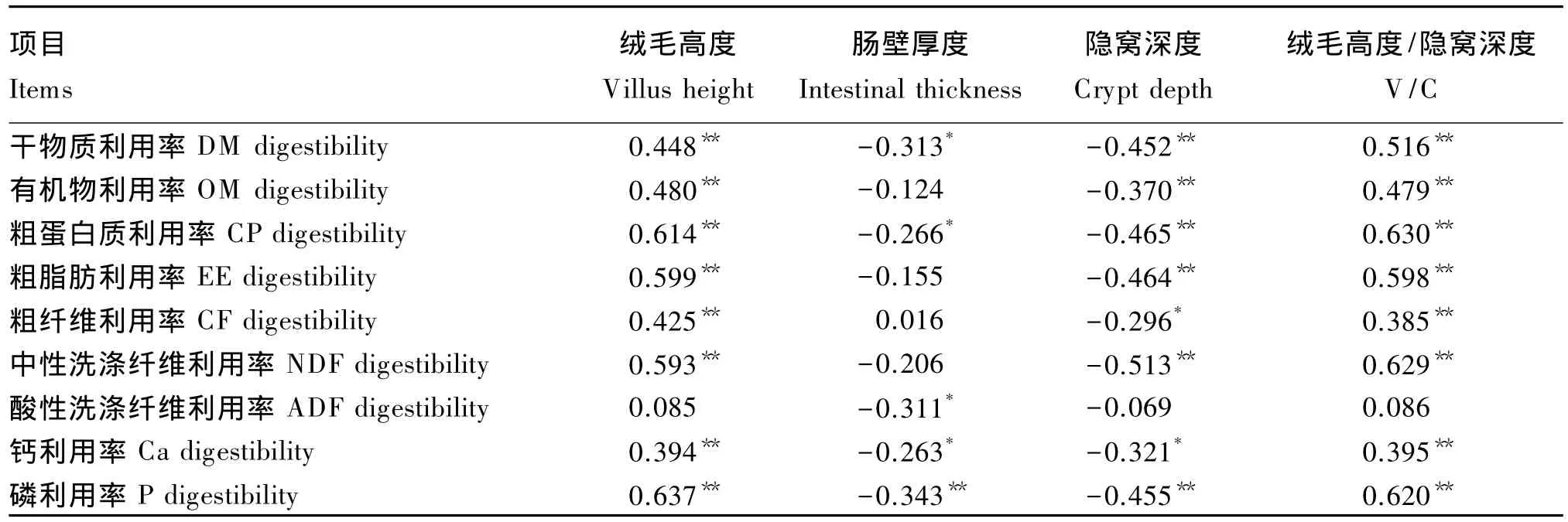
表8 鹅空肠绒毛形态与营养物质利用率的相关性Table 8 Correlation between jejunum villi shape and nutrient digestibility of geese
由此表明,饲粮中添加不同水平维生素B1可对鹅的肠道形态变化和营养物质利用率产生显著影响。鹅肠道的形态变化与饲粮营养物质利用率密切相关。
3 讨论
3.1 维生素B1对鹅饲粮营养物质利用率的影响
家禽饲粮常规营养成分的评定主要是测定饲粮中 DM、OM、CP、EE、CF、NDF、ADF、Ca、P 等营养物质的利用情况。目前,关于维生素B1添加水平对畜禽饲粮营养物质利用率影响的研究未见系统报道。本研究结果表明,不同水平维生素B1对鹅DM、OM和NDF的利用率无显著影响,但对CP、EE、CF、ADF、Ca、P 的利用率均有显著影响,表明适宜水平维生素B1能够促进鹅对饲粮中CP、EE、CF、ADF、Ca、P 的利用。分析其主要机制有以下2点:1)维生素B1在小肠上部可被吸收,吸收后的维生素B1在肝脏被磷酸化。维生素B1的磷酸化形式包括硫胺素一磷酸(TMP)、硫胺素焦磷酸(TPP)以及硫胺素三磷酸(TTP)。焦磷酸硫胺素能促进重要的神经介质乙酰胆碱的合成,抑制胆碱酯酶对乙酰胆碱分解。增加维生素B1时,乙酰胆碱合成增加,同时由于胆碱酯酶活性的降低,乙酰胆碱的分解减缓,神经传导活跃,加强了消化系统的功能。如胃肠蠕动加快,食物通过胃肠的时间加速,消化酶分泌增加,消化机能加强,从而提供了鹅的饲粮营养物质利用率。2)据王娇等[9]研究结果表明,维生素B1显著提高鹅肝脏中硫胺焦磷酸激酶(TPK1)基因的表达量,且TPK1基因的表达量与胃蛋白酶、胰脏脂肪酶、肠淀粉酶活性呈极显著正相关;各种消化酶活性的增加,有利于营养物质消化吸收,导致饲粮营养物质利用率的提高。关于维生素B1改善鹅饲粮营养物质利用率的化学信号通路还需要进一步深入研究。
3.2 维生素B1对鹅消化道发育的影响
肠道的发育尤其是肠黏膜的正常结构与功能是营养物质充分消化与吸收的基本保证。而肠重、肠体指数等指标在一定程度上可以反映肠道的生长发育状况[10]。黄慧华[11]研究表明,维生素B1能促进幼健鲤肠道的生长和发育。本研究结果表明,饲粮中添加2.6~8.0 mg/kg维生素B1显著提高15周龄的十二指肠、空肠、回肠、盲肠的肠长指数和肠体指数,与上述有关文献研究结果相同。本试验结果表明,维生素B1对5~15周龄鹅肠道形态变化有显著影响。由于维生素B1促进了后备种鹅肠道良好的发育,将有利于产蛋期营养的消化吸收,并对生产性能和繁殖性能产生良好影响,此结果对指导种鹅生产具有重要指导意义。关于维生素B1促进鹅肠道发育的机制比较复杂,还需要进一步深入研究。
3.3 维生素B1对盲肠微生物菌群的影响
动物消化系统对营养物质的消化吸收能力,部分依赖于肠道中寄生的微生物菌群分布及其总量;饲粮成分和营养物质含量的变化对肠道微生物菌群数量有显著的影响[12]。而盲肠又是消化道微生物活动最多和最适宜的器官,其中厌氧菌占主导地位(主要是双歧杆菌、乳酸杆菌等)[13]。Wang等[14]研究表明,双歧杆菌、芽孢杆菌和乳酸杆菌是成年鹅肠道的优势菌群,盲肠段极显著高于其他肠段。Liu等[15]研究表明,通过16s RNA基因序列分析在盲肠内容物中,芽孢杆菌是第一大优势菌群,占58.7%;拟杆菌是第二大优势菌群,占26.9%。鹅能够通过盲肠微生物发酵利用饲粮中的部分CF,肠道蠕动使小肠内容物进入盲肠,逆蠕动则使直肠内容物倒流入盲肠,盲肠本身缓慢蠕动与逆蠕动使内容物得以充分混合,为微生物发酵作用创造了良好条件[16]。只有肠道内微生物有益菌群和有害菌群的种类和数量处于平衡状态才能够保证动物消化道内环境的稳定,从而提高动物的消化能力和饲料利用率。
本研究结果表明,15周龄时,适宜水平维生素B1能极显著降低盲肠大肠杆菌数量,显著增加双歧杆菌和乳酸杆菌数量;维生素B1水平为4.4 mg/kg时,大肠杆菌数最少,维生素B1水平分别为8.0、2.6 mg/kg时,双歧杆菌和乳酸杆菌数最多。结果表明,饲粮中维生素B1适宜水平能够改善5~15周龄鹅盲肠内微生物环境,增加双歧杆菌和乳酸杆菌等有益菌的繁殖速度,优化了肠道优势菌群结构;同时抑制大肠杆菌等有害菌的繁殖,降低了有害菌的数量,从而提高了机体健康水平,促进了饲粮营养物质的利用率。关于肠道菌群代谢产物对机体营养物质利用率的影响机制还有待于继续研究。
3.4 维生素B1对空肠绒毛形态的影响
绒毛高度影响小肠吸收面积,绒毛高度越高,越利于营养物质的吸收。隐窝深度反映细胞的生成率,隐窝越浅,细胞成熟率越高,分泌功能越强。绒毛高度/隐窝深度则综合反映小肠的功能状态,比值下降,表示消化吸收功能下降,常伴随腹泻的发生;比值上升,表示消化吸收能力增强,腹泻率下降[17]。
本研究结果表明,饲粮中维生素B1水平在2.6~8.0 mg/kg时,能够显著增加15周龄鹅空肠绒毛高度和绒毛高度/隐窝深度,并显著降低隐窝深度和肠壁厚度。表明适量的维生素B1水平能够改善5~15周龄鹅的肠道组织形态结构,从而间接改善鹅的营养物质利用率和生长发育。关于维生素B1对鹅肠道组织形态影响和维生素在机体内的协同或拮抗作用机制还有待于继续研究。
4 结论
① 饲粮中添加2.6~6.2 mg/kg维生素B1能够极显著提高鹅对饲粮中CF和Ca的利用率,显著提高CP、EE、ADF和P的利用率。
②饲粮中添加不同水平维生素B1对各种肠肠长指数和肠体指数有不同程度显著影响。
③ 饲粮中添加2.6~8.0 mg/kg维生素B1能够促进肠道形态的变化和有益微生物菌群的增殖。
④空肠绒毛形态与营养物质利用率显著相关。
[1]SJAASTAD O V,HOVE K,SAND O.Physiology of domestic animals[M].New York:Scandinavian Veterinary Press,2010.
[2]GUBLER C J.Studies on the physiological functions of thiamine[J].The Journal of Biological Chemistry,1961,236(12):3112-3121.
[3]PPEPPARD R F,MARTIN W R W,CLARK C M,et al.Cortical glucose metabolism in Parkinson’s and Alzheimer’s disease[J].Journal of Neuroscience Research,1990,27(4):561-568.
[4]孟昭聚.仔鹅硫胺素缺乏症的诊断及防制[J].中国兽医杂志,1994,20(12):21-22.
[5]徐存华.青年母鸡硫胺素缺乏症[J].中国家禽,1988(1):14.
[6]王忠.绵羊维生素B1缺乏症的诊治[J].当代畜禽养殖业,2004(11):13.
[7]TAFAJ M,SCHOLLENBERGER M,FEOFILOWA J,et al.Relationship between thiamine concentration and fermentation patterns in the rumen fluid of dairy cows fed with graded concentrate levels[J].Journal of Animal Physiology and Animal Nutrition,2006,90(7/8):335-343.
[8]NRC.家禽营养需要[M].9版.北京:中国农业科技出版社,1994.
[9]王姣,王宝维,葛文华,等.VB1对育雏和育成鹅生长性能、消化酶活力、肝脏TPK1基因表达量的影响及相关性研究[J].畜牧兽医学报,2013,44(7):1090-1098.
[10]CHEN H Y,WU F C,TANG S Y.Thiamin requirement of juveniles shrimp(Penaeus monodon)[J].The Journal of Nutrition,1991,121(12):1984-1989.
[11]黄慧华.硫胺素对幼建鲤生长性能、消化吸收功能和免疫功能的影响[D].硕士学位论文.雅安:四川农业大学,2009.
[12]APAJALAHTI J,KETTUNEN A,GRAJAM H.Characteristics of the gastrointestinal microbial communities,with special reference to the chicken[J].World’s Poultry Science Journal,2004,60(2):223-232.
[13]LEY R E,HAMADY M,LOZUPONE C,et al.Evolution of mammals and their gut microbes[J].Science,2008,320(5883):1647-1651.
[14]WANG Z Y,SHI S R,XU M J,et al.16S rRNA-based analysis of bacterial diversity in the microbial flora of the geese intestinal tract[J].Journal of Animal and Feed Sciences,2009,18(3):531-540.
[15]LIU B Y,WANG Z Y,WANG H R,et al.Molecular profiling of bacterial species in the caecum of geese[J].Czech Journal of Animal Science,2011,56(4):192-203.
[16]张海棠,刘长忠,崔建勋,等.不同蛋白原料对生长鹅生长性能及盲肠微生物的影响[J].广东农业科学,2011,38(4):22-24.
[17]张勇,李冰,朱宇旌,等.黄芪多糖对肉鸡生长性能和小肠黏膜形态的影响[J].沈阳农业大学学报,2009,40(4):453-457.
