丙氨酰-谷氨酰胺二肽对仔猪小肠上皮细胞间紧密连接蛋白occludin定位与表达的影响
2014-09-20邓宸玺王自蕊游金明瞿明仁叶亚玲辛向荣
邓宸玺 王自蕊 游金明 瞿明仁 叶亚玲 辛向荣 潘 珂
(江西农业大学动物科技学院,南昌 330045)
仔猪小肠具有完整的黏膜屏障功能是保证其肠道健康的重要基础,而小肠上皮细胞间良好的紧密连接结构是维持小肠黏膜发挥正常屏障功能和吸收功能的前提。小肠上皮细胞间的这种紧密连接可封闭细胞旁间隙,使得上皮细胞仅仅对离子和氨基酸类营养物质选择性通过。研究表明,紧密连接是依靠一系列跨膜及外周蛋白相互作用形成的复合体,包括 occludin、claudin、ZO-1和JAM等多种蛋白。其中occludin最早被发现,是紧密连接中最重要的结构蛋白之一,其分子质量为64~82 ku,含有4个跨膜结构域、2个细胞外环和1个细胞内环,可与ZO-1等蛋白结合,共同构成紧密连接的骨架部分。occludin一旦进入紧密连接,其连接部位的膜通透性将大大降低,使大分子自由出入受阻,进而达到屏障保护作用[1]。仔猪早期断奶后,肠道通透性增加、肠屏障功能破坏可能归因于肠上皮细胞间紧密连接蛋白occludin mRNA表达量的下降[2]。在应激状态下,仔猪肠道几乎完全依赖谷氨酰胺(glutamine,Gln)来支持黏膜细胞和巨噬细胞的生理代谢以维持肠黏膜结构和功能的完整[3]。在断奶期间,由于无法获得母源性Gln,仔猪容易发生Gln缺乏。因此,通过补充外源性Gln对防止仔猪断奶应激具有十分重要的意义。然而,目前人工合成的Gln水溶性差,易转化为有害的焦谷氨酸和氨,且吸收率低,限制了其在生产中的广泛应用[4],而以丙胺酰-谷氨酰胺二肽(alanyl-glutamine dipeptide,Ala-Gln)作为Gln的供体,则可弥补Gln单体的缺陷[5]。Ala-Gln在保护仔猪肠道屏障功能方面已有一些研究,但Ala-Gln参与仔猪小肠屏障保护作用是否与小肠上皮细胞间紧密连接的形成有关?Ala-Gln是否可以上调紧密连接蛋白occludin的表达?目前鲜有报道。本试验旨在通过体外试验,以分离自仔猪空肠上皮的IPEC-1细胞为模型,利用免疫荧光定位和蛋白质印迹(Western Blot)方法,探讨Ala-Gln对仔猪小肠上皮细胞间紧密连接蛋白occludin定位与表达的影响,以期为揭示Ala-Gln促进肠黏膜屏障功能的作用机理提供新的线索。
1 材料与方法
1.1 试验材料
1.1.1 试验试剂
DMEM高糖培养基(不含Gln)购自Hyclone公司、胎牛血清购自Gibco公司、Ala-Gln、小牛血清白蛋白(BSA)、丙烯酰胺(acrylamide)、过硫酸铵(APS)、N,N,N',N'- 四 甲 基 乙 二 胺(TEMED)、三羟甲基氨基甲烷(Tris base)、甘氨酸(Gly)、十二烷基硫酸钠(SDS)、脱氧胆酸钠(sodium deoxycholate)购自 Sigma公司,青霉素、链霉素购自北京索莱宝公司,胰岛素铁硒传递蛋白(ITS)购自 Sciencell公司,鼠表皮生长因子(mEGF)、脱脂奶粉(skim milk powder)购自 BD公司,兔抗occludin C-term多克隆抗体购自Invitrogen公司,异硫氰酸荧光素(FITC)标记的羊抗兔免疫球蛋白G(IgG)购自中杉金桥公司,辣根过氧化物酶(HRP)标记的山羊抗兔 IgG(H+L)、HRP标记的山羊抗小鼠IgG(H+L)、鼠抗β-肌动蛋白(β-actin)单克隆抗体购自Jackson公司,磷酸盐缓冲液(PBS)、甲醛、聚乙二醇辛基苯基醚(Triton X-100)、苯甲基磺酰氟(PMSF)、甲叉双丙烯酰胺(bis-acrylamide)、吐温-20、溴酚蓝(bromphenol blue)、丽春红S(ponceau S)、乙基苯基聚乙二醇裂解液(NP-40)、细胞组织快速裂解液(RIPA)购自Amresco公司,动植物膜蛋白微量制备试剂盒、2 mg/mL牛血清白蛋白标准品、5×还原样品缓冲液、10×Tris-Gly-SDS电泳缓冲液、考马斯亮蓝、中分子质量预染蛋白Marker(7条带)、Stripping Buffer购自天恩泽,二辛可宁酸(BCA)蛋白质浓度测定试剂盒购自碧云天,免疫印迹化学发光剂(ECL)、0.45 μm孔径硝酸纤维素膜购自Millipore公司,二硫苏糖醇(DTT)购自Merck公司,蛋白酶抑制剂、磷酸酶抑制剂购自Roche公司,甲醇、氯化钠购自国药集团,璜基水杨酸购自北京金汇太亚化学试剂公司,三氯乙酸购自上海研拓公司。
1.1.2 试验培养基
基础培养基:95%DMEM高糖培养基(不含Gln)+5%胎牛血清 +5 μg/L mEGF+1‰ ITS+100 U/mL青霉素+100 U/mL链霉素。
配制 A、B、C、D、E、F共 6种试验培养基,即分别在基础培养基中加入 0、0.25、0.50、1.00、2.00和4.00 mmol/L(终浓度)的Ala-Gln。
1.1.3 试验细胞
试验用细胞为分离自仔猪空肠上皮的成熟的IPEC-1细胞,由中科院长沙亚热带研究所馈赠。
1.2 试验方法
1.2.1 IPEC-1细胞培养
取传代稳定的同代IPEC-1细胞,同时接种于底部放有盖玻片的分别标记为 A、B、C、D、E、F的6块6孔细胞培养板上,并分别加入含0、0.25、0.50、1.00、2.00 和 4.00 mmol/L(终浓度)Ala-Gln的试验培养基,置于培养箱中于37℃、5%CO2条件下培养。
1.2.2 occludin免疫荧光定位观察
待细胞融合达70%以上后,吸去培养基,用PBS洗涤5次,每次10 min。加入中性甲醛固定液固定15 min后,用PBS洗涤。随即加入0.5%Triton X-100处理10 min,经 PBS洗涤后,再用100 mL/L BSA封闭1 h,然后加入2 μg/mL的兔抗occludin C-term多克隆抗体,于37℃下温育1 h。用PBS洗涤后按1∶100加入FITC标记的羊抗兔IgG,经37℃温育1 h、PBS洗涤、蒸馏水冲洗后将盖玻片取出,用甘油封片,在荧光显微镜下观察各组样品occludin的定位情况并拍照。
1.2.3 occludin相对表达量测定
1.2.3.1 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)溶液配制
30%Acr-Bis储备液:取29 g丙烯酰胺和1 g甲叉双丙烯酰胺,溶于100 mL双蒸水。
1 mol/L Tris-HCl(pH 6.8):12.1 g Tris base溶于80 mL双蒸水,用浓HCl调节pH至6.8,定容至100 mL。
1 mol/L Tris-HCl(pH 8.8):12.1 g Tris base溶于80 mL双蒸水,用浓HCl调节pH至8.8,定容至100 mL。
10%SDS:取10 g电泳级SDS,加入90 mL双蒸水,加热至68℃助溶,再加入几滴浓HCl调节溶液的pH至7.2,用双蒸水定容至100 mL。
10%APS:将0.1 g APS溶于1 mL双蒸水。
TBST 缓冲液:Tris-base 2.42 g,NaCl 8.77 g,调pH至7.2~7.4,定容至1 000 mL,再加2 mL吐温-20。
5%脱脂奶粉-TBST缓冲液:在100 mL TBST缓冲液中加入5 g脱脂奶粉。
3%BSA-TBST缓冲液:在100 mL TBST缓冲液中加入3 g BSA。
另外,按照常规方法配制5%浓缩胶和12%分离胶。
1.2.3.2 细胞膜蛋白抽提及浓度调整
将培养好的各组细胞用PBS冲洗1遍,加入预冷的裂解液于冰上裂解10~20 min,将细胞刮下,用EP管收集,然后经100~200 W 超声波破碎细胞2次,每次3 s。于4℃下12 000×g离心5 min,弃去上清,将上述操作重复3次。采用动植物膜蛋白微量制备试剂盒提取细胞膜蛋白,于-80℃保存待测。
使用BCA蛋白质浓度测定试剂盒对细胞膜蛋白样品进行定量,以RIPA将各组细胞膜蛋白样品调成相同浓度。加入5×还原样品缓冲液后,使样品终浓度为0.8 mg/mL。
1.2.3.3 目的蛋白电泳及Western Blot预试验
将样品水浴煮沸5 min,上样时每孔目的蛋白量为8 μg。接好电源,浓缩胶中90 V恒压约20 min。待溴酚蓝跑至分界处,将电压调为160 V,约50 min后溴酚蓝跑出分离胶,终止电泳。小心取下2块胶,其中一块以考马斯亮蓝染色。以记号笔在玻璃板上画好标记线,依线小心切去浓缩胶及两边未加样泳道,并在凝胶底部最靠近左边切去一角,以示电泳方向及加样方向。同法操作另一块胶。
SDS-PAGE后将目的蛋白转至硝酸纤维素膜上,条件为:300 mA恒流,0.45 μm孔径硝酸纤维素膜,转膜约1 h。转膜完成后用丽春红S染色,并观察转膜效果。然后将硝酸纤维素膜完全浸没在装有3%BSA-TBST缓冲液的封口袋中,室温下轻摇2 h。弃封闭液,用兔抗occludin C-term多克隆抗体(3%BSA-TBST缓冲液稀释,1∶2 000)室温下孵育10 min,置于4℃冰箱过夜。取出硝酸纤维素膜,室温下孵育30 min。再使用TBST缓冲液(Tris-base 20 mmol/L,NaCl 150 mmol/L,pH 7.4,吐温-20 0.05%)清洗硝酸纤维素膜5次,每次5 min。加入HRP标记的山羊抗兔IgG(5%脱脂奶粉-TBST缓冲液稀释,1∶2 000)后,室温下轻摇1 h。TBST缓冲液清洗5次,每次5 min。加入ECL 2 mL,室温反应3~5 min,胶片曝光30~60 s,显影2 min,最后定影。胶片扫描后结果见图1。

图1 目的蛋白occludin Western Blot预试验条带Fig.1 Western Blot pre-experimental bands of target protein occludin
1.2.3.4 Western Blot正式试验
SDS-PAGE后将目的蛋白转至硝酸纤维素膜上,试验步骤与条件参照预试验。然后用Stripping Buffer在37℃下洗膜30 min,去离子水洗膜3次,TBST缓冲液洗膜3次,每次3 min,将硝酸纤维素膜完全浸没在3%BSA-TBST缓冲液中,室温下摇动0.5 h。将膜装入含有鼠抗β-actin单克隆抗体(用5%脱脂奶粉-TBST缓冲液稀释,1∶5 000)的封口袋中,室温下孵育2 h。TBST缓冲液洗膜,共洗5次,每次5 min。再用HRP标记的山羊抗鼠IgG(5%脱脂奶粉-TBST缓冲液稀释,1∶10 000)室温下孵育40 min。TBST缓冲液洗膜5次,每次5 min。加入ECL 2 mL,室温反应3~5 min,胶片曝光30~60 s,显影2 min,定影。胶片扫描后结果见图2。
1.3 统计分析
仔猪小肠上皮细胞间紧密连接蛋白occludin的相对表达量以样本与兔抗occludin C-term多克隆抗体结合后的灰度值与同一样本与鼠抗β-actin单克隆抗体结合后的灰度值的比值表示。各组occludin相对表达量数据采用SPSS 17.0软件进行方差分析,差异显著者用LSD法进行多重比较,结果以“平均值±标准差”表示。P<0.05为差异显著判断标准,P<0.01为差异极显著判断标准。

图2 目的蛋白occludin Western Blot试验条带Fig.2 Western Blot experimental bands of target protein occludin
2 结果与分析
2.1 Ala-Gln对仔猪小肠上皮细胞间紧密连接蛋白occludin定位的影响
由图3可知,对照组(A)IPEC-1细胞的胞质内存在明显的团状阳性荧光染色(实线箭头指示处),而细胞间连接处缺乏阳性荧光染色(虚线箭头指示处)。当培养基中加入Ala-Gln后发现,IPEC-1细胞间连接处的荧光信号明显增强,且随着Ala-Gln浓度的升高,IPEC-1细胞轮廓更加清晰,胞质内荧光信号逐渐减弱,细胞间连接处的荧光信号越发增强。而细胞核的荧光信号并无肉眼可见变化。
2.2 Ala-Gln对仔猪小肠上皮细胞间紧密连接蛋白occludin表达的影响
由表1可知,培养基中加入Ala-Gln后,小肠上皮细胞间紧密连接蛋白occludin的相对表达量均较对照组极显著升高(P<0.01)。随着Ala-Gln浓度的升高,occludin的相对表达量呈现先增后减的趋势,在添加量为2.00 mmol/L时达到峰值,极显著高于其他添加量(P<0.01)。这表明,Ala-Gln可以上调仔猪小肠上皮细胞间紧密连接蛋白occludin的表达,进而促进细胞间紧密连接结构的形成。
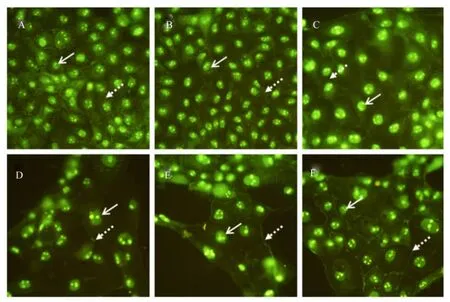
图3 仔猪小肠上皮细胞间紧密连接蛋白occludin免疫荧光定位Fig.3 Immunofluorescence localization of tight junction protein occludin in small intestinal epithelial cells from piglets
3 讨论
小肠黏膜具有屏障功能的一个重要解剖学基础是小肠上皮细胞间具有完整的紧密连接。一般来说,这种紧密连接可封闭细胞旁间隙,使得肠上皮细胞仅仅对离子和氨基酸类营养物质选择性通过。但在特殊情况(如断奶应激)下,紧密连接往往受到破坏,细菌、内毒素等有害物质通过肠黏膜屏障进入血液循环系统,引起机体炎症反应甚至多器官功能衰竭。occludin是构成小肠上皮紧密连接的主要结构蛋白之一,occludin一旦进入紧密连接,其连接部位的膜通透性将大大降低,使大分子自由出入受阻,进而达到屏障保护作用[6]。
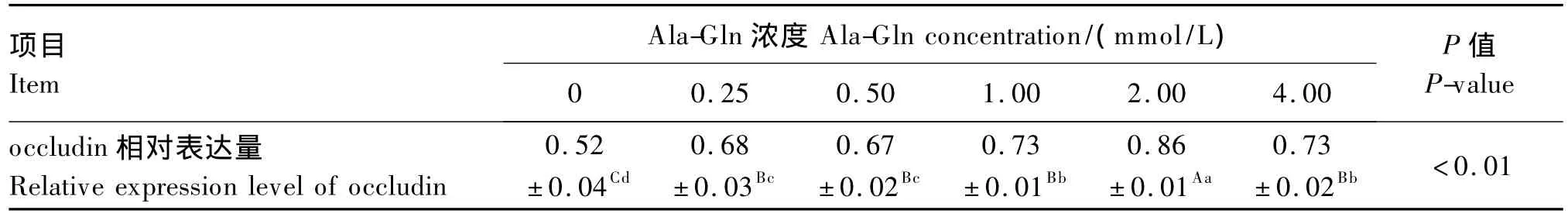
表1 Ala-Gln对仔猪小肠上皮细胞间紧密连接蛋白occludin表达的影响Table 1 Effects of Ala-Gln on the expression of tight junction protein occludin in small intestinal epithelial cells from piglets
occludin是一种跨膜蛋白,也是最早发现的细胞间紧密连接蛋白[7]。occludin含有2个细胞外环,其中一个细胞外环对屏障功能有调节作用,是紧密连接的最重要结构蛋白之一。occludin存在磷酸化和非磷酸化2种形式,磷酸化occludin为活性形式,主要集中于紧密连接纤维内,有一小部分occludin沿着细胞侧膜分布,不进入纤维内[8],连接相邻的细胞,封闭细胞间的空隙[9]。而非磷酸化occludin集中在细胞质中[10]。研究表明,Gln或其二肽通过上调肠上皮细胞紧密连接蛋白occludin的表达而降低肠上皮的通透性被认为是其发挥肠道屏障功能的一个可能机制。小肠黏膜对大分子物质的通透性是评价小肠黏膜屏障功能的一项重要指标[11]。在临床上,要直接观察细菌移位(bacterial translocation)比较困难,因此大多采用小肠对大分子的通透性来间接反映细菌易位的发生。据报道,Gln或其二肽可降低小肠对二乙烯三胺戊乙酸(DTPA)的通透率,其机理可能在于其可维护小肠黏膜屏障的完整性及小肠绒毛的形态,从而减少DTPA与腺凹细胞间的紧密连接及通透肠黏膜屏障的机会[12]。Gln或其二肽是目前应用非常广泛的肠黏膜保护剂,是维持肠道黏膜代谢、结构和功能的必需营养成分,对维护肠黏膜细胞的生长、分化和增殖具有重要的意义[13-17]。体内试验表明,Gln缺乏可使肠道黏膜萎缩,绒毛变稀变矮,屏障功能下降,而补充Gln后能明显增加大鼠肠黏膜质量、恢复绒毛高度、黏膜表面积和陷窝深度,加快肠上皮细胞更新速度,阻止肠黏膜萎缩及炎症所致的通透性增加,从而恢复并维持肠黏膜屏障功能[18-19]。Potsic 等[20]利用胃造口术研究大鼠后发现,Gln缺乏可引起大鼠肠上皮细胞间紧密连接结构的破坏。崔巍等[21]在对人的结肠癌细胞系Caco-2细胞试验中进一步表明,Gln缺乏会降低紧密连接蛋白occludin的相对表达量,增加肠上皮细胞屏障通透性,而补充Gln能够阻断这些改变。近来,有人利用Caco-2细胞建立缺氧/复氧模型,模仿肠缺血再灌注,然后用含有不同浓度Gln的培养基培养,研究了Gln对肠黏膜的保护作用。结果证实,Gln可上调紧密连接蛋白occludin的表达[22]。根据临床医学的研究进展,本试验应用IPEC-1细胞建立体外小肠上皮细胞屏障,探讨Ala-Gln对仔猪小肠上皮细胞间紧密连接相关蛋白occludin表达的影响,在对仔猪小肠上皮细胞进行免疫荧光定位后发现,培养基中不含Ala-Gln时仔猪小肠上皮细胞间的连接处荧光信号微弱,而细胞质的荧光信号较强。由此推测,对照组小肠上皮细胞中非磷酸化occludin含量较高,而起活性作用的磷酸化occludin含量较低。随着培养基中Ala-Gln浓度的增加,仔猪小肠上皮细胞胞质中的荧光信号逐渐减弱,并最终转为阴性。与此相反的是,细胞膜紧密连接处的荧光信号则随Ala-Gln浓度的增加而逐渐增强。此结果表明,Ala-Gln可以促进occludin的磷酸化及细胞间紧密连接结构的形成。在occludin功能的调节中,丝/苏氨酸的磷酸化状态较为重要,其主要受蛋白激酶C(PKC)的影响。PKC是一类磷脂依赖性蛋白激酶,通过催化多种蛋白质磷酸化,调节细胞的代谢、生长和分化。丝/苏氨酸磷酸化的occludin聚集在紧密连接处,而磷酸化残基较少的occludin则多分布在细胞质的基底膜侧[23]。而 Ala-Gln对occludin磷酸化的促进作用可能源于其对PKC活性的促进作用。试验进一步提取了仔猪小肠上皮细胞膜蛋白,分析了其中occludin的相对表达量。结果证实,随着Ala-Gln浓度的增大,occludin的相对表达量也逐渐增加,这与前面免疫荧光定位试验中所观察到的紧密连接结构越来越明显相吻合。由此表明,Ala-Gln可促进仔猪小肠上皮细胞膜上occludin的磷酸化,有效促进细胞间紧密连接结构的形成,进而降低仔猪小肠黏膜的通透性,增强小肠黏膜的屏障功能。
4 结论
Ala-Gln可以上调仔猪小肠上皮细胞间紧密连接蛋白occludin的表达,促进细胞间紧密连接结构的形成,进而增强仔猪小肠黏膜的屏障功能。
[1]FURUSE M,SASAKI H,FUJIMOTO K,et al.A single gene product,clauin-1 or 2,reconstitutes tight junction strands and recuits occluding in fibroblasts[J].The Journal of Cell Biology,1998,143(2):391-401.
[2]刘海萍,胡彩虹,徐勇.早期断奶对仔猪肠通透性和肠上皮紧密连接蛋白Occludin mRNA表达的影响[J].动物营养学报,2008,20(4):442-446.
[3]马永贤,蒋朱明,白满喜,等.创伤后肠黏膜屏障改变分子生物学机制的研究[J].中华外科杂志,1995,33(6):371-373.
[4]MURAKAMI A E,SAKAMOTO M I,NATALIM R M,et al.Supplementation of glutamine and vitamin E on the morphometry of the intestinal mucosa in broiler chickens[J].Poultry Science,2007,86(3):488-495.
[5]袁雪波,马黎,陈克嶙,等.丙氨酰谷氨酰胺二肽对哺乳仔猪生长性能、小肠形态学和血清生化指标的影响[J].动物营养学报,2011,23(1):94-101.
[6]刘铁民,吴衍忠.谷氨酰胺对过度运动大鼠肠黏膜屏障功能变化的干预机制[J].四川体育科学,2007(4):55-58.
[7]TSUKITA S,FURUSE M.Occludin and claudins in tight-junction strands:leading or supporting players[J].Trends in Cell Biology,1999,9(7):268-273.
[8]高志光,秦环龙.肠上皮细胞紧密连接的生物学功能及在肠屏障中的作用[J].肠外与肠内营养,2005,l12(5):299-302.
[9]KUBOTA K,FURUSE M,SASAKI H,et al.Ca2+-independent cell-adhesion activity of claudins,a family of integralmembrane proteins localized at tight junctions[J].Current Biology,1999,9(18):1035-1038.
[10]SAKAKIBARA A,FURUSE M,SATIOU M.Possible involvement of phosphorylation of occludin in tight junction formation[J].Journal of Cell Biology,1997,137(6):1393-1401.
[11]BJARNASON I,MACPHERSON A,HOLLANDER D.Intestinal permeability:an overview[J].Gastroenterology,1995,108(5):1566-1581.
[12]蒋建文,黎介寿,李幼生,等.甘氨酰谷氨酰胺二肽对猪自体移植小肠的营养作用[J].中华外科杂志,1999,37(11):677-679.
[13]SHIMIZU M,SON D O.Food-derived peptides and intestinal functions[J].Current Pharmaceutical Design,2007,13(19):885-895.
[14]WU X Q,SHU L H,SUN M,et al.Effect of glutamine on apoptosis of the small intestine in young rats with endotoxemia and its mechanism[J].Chinese Journal of Contemporary Pediatrics,2006,8(6):496-498.
[15]MARGARITIS V G,FILOS K S,MICHALAKI M A,et al.Effect of oral glutamine administration on bacterial tanslocation,endotoxemia,liver and ileal morphology,and apoptosis in rats with obstructive jaundice[J].World Journal of Surgery,2005,29(10):1329-1334.
[16]DE-SOUZA D A,GREENE L J.Intestinal permeability and systemic infections in critically ill patients:effect of glutamine[J].Critical Care Medicine,2005,33(5):1125-1135.
[17]ASSIMAKOPOULOS S F,NIKOLOPOULOU V N,SCOPA C D,et al.Beneficial effects of glutamine on intestinal barrier function in obstructive jaundice[J].World Journal of Surgery,2005,29(7):935-936.
[18]BOELENS P G,HOUDIJK A P,HAARMAN H J,et al.Glutamine-enriched enteral nutrition decreases infectious complications in trauma patients[J].American Journal of Clinical Nutrition,2002,76(1):253-254.
[19]KARINCH A M,PAN M,LIN C M,et al.Glutamine metabolism in sepsis and infection[J].Journal of Nutrition,2001,131(9):2535S-2538S,2550S-2551S.
[20]POTSIC B,HOLLIDAY N,LEWIS P,et al.Glutamine supplementation and deprivation:effect on artificially reared rat small intestinal morphology[J].Pediatric Research,2002,52(3):430-436.
[21]崔巍,闻颖,董亚珞,等.谷氨酰胺对体外培养肠上皮细胞屏障通透性的影响[J].世界华人消化杂志,2008,16(33):3729-3733.
[22]潘璠,刘成霞.谷氨酰胺对体外肠上皮细胞缺血再灌注损伤后occludin蛋白表达的影响[J].中华临床医师杂志,2012,6(10):2624-2627.
[23]张宇飞,嵇武,黎介寿.Occludin蛋白调控机制及临床意义的研究进展[J].肠外与肠内营养,2010,17(3):175-178.
