硫胺素对高精料底物瘤胃体外发酵培养液挥发性脂肪酸和乳酸浓度的影响
2014-09-20王梦芝郝志敏喻礼怀王洪荣
张 军 王梦芝 郝志敏 喻礼怀 王洪荣*
(1.扬州市扬大康源乳业有限公司,扬州 225009;2.扬州大学实验农牧场,扬州 225009;3.扬州大学动物科学与技术学院,扬州 225009)
目前,伴随着反刍动物生产性能的提高,反刍动物生产实践中精料补充饲料的比例也在不断加大。而众所周知的是,饲粮中精料比例的增加有可能导致瘤胃快速降解碳水化合物的爆发式降解,进而导致酸中毒等营养代谢病的发生,而最终将影响动物的健康和生产性能[1]。硫胺素(又称为维生素B1)属水溶性维生素,是动物体内能量代谢途径中重要的辅酶。它以硫胺素焦磷酸辅酶(TPP)的形式参与碳水化合物代谢过程中α-酮酸的氧化脱羧反应,是动物体内整个能量代谢过程和支链氨基酸代谢所必需的水溶性维生素[2]。高精料饲粮快速降解碳水化合物含量高,则其代谢中硫胺素的需求也高,这则可能会导致硫胺素的缺乏。而硫胺素缺乏可能导致中间代谢受阻,进而可能引发亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA),饲料和能量利用效率降低。近年来,关于硫胺素用于反刍动物SARA防治方面已有相关的研究报道[3]。本实验室前期的研究也已表明,奶牛在精粗比为3∶7条件下可以不添加硫胺素,而在6∶4 条件下则需要添加硫胺素[4],但迄今其具体的添加量还没有明确论断,为此,本试验在高精料条件下添加硫胺素,测定其培养液中挥发性脂肪酸(VFA)以及乳酸浓度的变化情况,以初步筛选高精料条件下硫胺素合适的添加量,为下一步体内试验添加量的确定提供一些参考,同时也为集约化饲养条件下反刍动物SARA的防治提供一些思路。
1 材料与方法
1.1 试验动物与饲养管理
由扬州市扬大康源乳业有限公司第一牧场选择4头身体健康状况良好,体重相近,安装瘤胃瘘管的荷斯坦奶牛作为试验动物。试验用牛在试验期间饲喂该牧场常用全混合日粮(TMR),每日07:00和19:00分2次等量饲喂,自由饮水,用于采集瘤胃液。
1.2 试验材料与试验设计
试验用盐酸硫胺素的纯度≥99%,购自天津福德士科技有限公司。
试验选用单因子5水平试验设计,A为对照组,不添加硫胺素,B、C、D、E组为试验组,分别添加60、120、180和240 mg/kg的盐酸硫胺素(各试验组硫胺素的有效添加量分别为53.50、107.00、160.50、214.00 mg/kg),每组设3个重复。底物组成与硫胺素添加量见表1。由于底物采用半纯合饲粮配制,由表1中可知,底物精粗比[(小麦淀粉+可溶性淀粉+酪蛋白)∶(木聚糖+果胶+羧甲基纤维素+滤纸纤维素)]为6∶4,粗蛋白质含量为17%。由于硫胺素的添加量很少,在培养前先将盐酸硫胺素溶解在水中,然后按设计的剂量换算后添加至培养液中。
参照 De Oliveira等[5]的方法配制精粗比 6∶4条件下的人工唾液盐,组成见表2。人工唾液盐在使用前1天配制,并通入二氧化碳(CO2)待用。
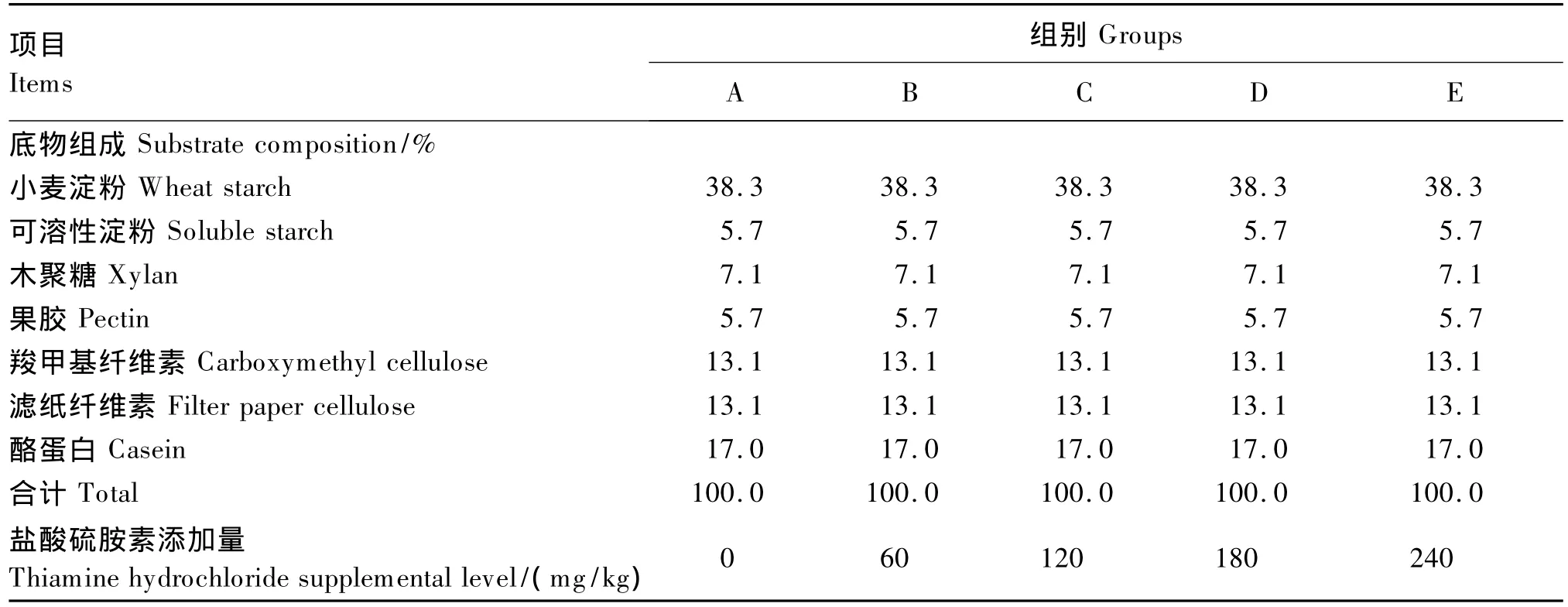
表1 底物组成与硫胺素的添加量Table 1 Substrate composition and thiamine supplemental level
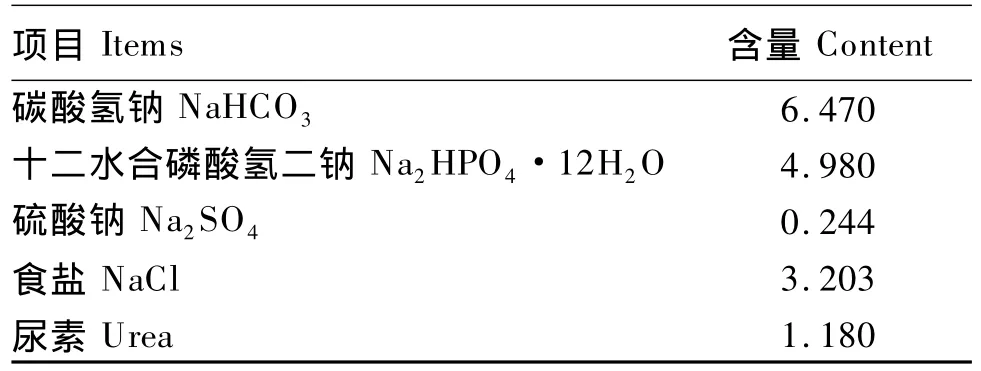
表2 人工唾液盐组成Table 2 Composition of artificial saliva g/L
1.3 体外培养试验
在奶牛晨饲前,利用自制真空负压装置,4头瘘管牛分别各采集瘤胃液150 mL,经纱布过滤后装入保温瓶,并通CO2,置于恒温水浴中保温。
于采样前3小时配制好人工唾液盐,按照试验设计称取底物原料,各加入之前配制好的人工唾液盐80 mL,再各加入采集后经过滤的瘤胃液40 mL,通过进气通道通入CO2气体至饱和,并放置于恒温水浴箱中。另外增设1个瘤胃液与人工唾液盐混合无底物的空白对照。
于培养后 0、1、3、6、10、24、48、72 h 取培养液样,每次取5 mL,于-20℃冷冻保存,用于挥发性脂肪酸和乳酸浓度的测定。
1.4 指标测定及方法
1.4.1 挥发性脂肪酸
培养液挥发性脂肪酸浓度使用日本岛津GC-9A气相色谱仪进行测定[6]。
1.4.2 乳酸
培养液乳酸浓度的测定采用对羟基联苯法[7]进行。
1.5 数据处理
用Excel 2003软件进行数据整理;用SPSS 17.0的one way-ANOVA进行单因素方差分析,采用Duncan氏法进行多重比较。试验结果以“平均值±标准误”表示。
2 结果
2.1 硫胺素对高精料底物瘤胃体外发酵乳酸浓度的影响
由表3可见,随着培养时间的延长,各试验组乳酸的浓度整体上呈先上升后下降,再上升而后下降,并趋于稳定的变化趋势。而随着硫胺素添加量的增加,各试验组乳酸浓度基本呈降低的趋势,但在最高添加量的E组略有升高。
从不同时间点观察发现,0 h时,乳酸浓度在组间没有显著的差异(P>0.05);1、3 h时,D组乳酸浓度显著低于B和C组(P<0.05),极显著低于A组和E组(P<0.01);6、10 h时,D组显著低于C和E组(P<0.05),极显著低于A和B组(P<0.01);24 h时,D组显著低于A和B组(P<0.05),与C和E组差异不显著(P>0.05);48、72 h时,各试验组的乳酸浓度均与对照组乳酸浓度差异不显著(P>0.05)。

表3 硫胺素对高精料底物瘤胃体外发酵乳酸浓度的影响Table 3 Effects of thiamine on lactate concentration of high concentrate substrate after in vitro rumen fermentation mmol/L
2.2 硫胺素对高精料底物瘤胃体外发酵挥发性脂肪酸浓度和比例的影响
由表4可见,总体上,随着培养时间的延长,各组乙酸、丙酸、丁酸的浓度皆呈逐渐上升的趋势;但在72 h时略有下降。
从不同时间点观察发现,6 h时,D、E组乙酸浓度显著或极显著低于A组(P<0.05或P<0.01),而B、C组与A组差异不显著(P>0.05);其他时间点各试验组和A组相比差异都不显著(P>0.05)。6 h时,C、E组丙酸浓度显著低于A、B、D组(P<0.05);48 h时,D、E组均显著高于A、B组(P<0.05)。丁酸浓度除6 h时B、C组显著或极显著低于其他各组(P<0.05或P<0.01)外,其他各时间点各组之间差异均不显著(P>0.05)。
由表5可见,培养液中总挥发性脂肪酸(TVFA)浓度随培养时间的延长逐渐上升,并在72 h时略有下降。其中以D组最高,为41.74 mmol/L。
从不同时间点观察发现,在培养开始0 h时,TVFA浓度组间的差异不显著(P>0.05);1 h时,E组显著高于其他各组(P<0.05);3 h时,B组显著高于C、D、E组(P<0.05);10 h时,B组显著高于A和C组(P<0.05);24、48、72 h时,虽然组间的差异不显著(P>0.05),但数值上皆以 D组最高。

表4 硫胺素对高精料底物瘤胃体外发酵挥发性脂肪酸浓度的影响Table 4 Effects of thiamine on volatile fatty acid concentrations of high concentrate substrate after in vitro rumen fermentation mmol/L
培养液中乙酸与丙酸比例随培养时间的延长呈现波动变化。其中D组在相对较低的水平波动,其平均值为1.55。
从不同时间点观察发现,在培养开始0 h时,乙酸与丙酸比例在组间的差异不显著(P>0.05);1 h时,A组显著高于 C、D、E组(P<0.05);6 h时,C组显著高于其他各组(P<0.05);24、48、72 h时,D组皆显著或极显著低于A组(P<0.05或 P<0.01)。
3 讨论
3.1 硫胺素对高精料底物瘤胃体外发酵乳酸浓度的影响
长期以来,人们一直认为反刍动物瘤胃的微生物能合成充足的硫胺素,并能满足其营养代谢的需要[8-10]。然而,在集约化的生产中,反刍动物在高精料的饲养条件或泌乳期及妊娠期等特殊生理状况下,也需要在饲粮中添加硫胺素等水溶性维生素。硫胺素以TPP的形式参与碳水化合物代谢过程中α-酮酸的氧化脱羧反应,一旦机体缺乏硫胺素,则碳水化合物代谢受阻,就会导致中间代谢产物乳酸积累及挥发性脂肪酸比例的失衡而诱发瘤胃酸中毒或SARA。有研究报道,奶牛的饲粮从粗饲料突然转变为高精料情况下,瘤胃中微生物群体改变,瘤胃球菌消失,而乳酸利用菌成为了瘤胃中的优势菌群,同时乳酸的浓度增加[11]。韩昊奇等[12]对奶山羊的研究也表明,非纤维性碳水化合物/中性洗涤纤维(NFC/NDF)升高至1.63时,瘤胃乳酸杆菌及坏死梭形杆菌的数量显著增加。

表5 硫胺素对高精料底物瘤胃体外发酵总挥发性脂肪酸浓度和乙酸与丙酸比例的影响Table 5 Effects of thiamin on total volatile fatty acid concentration and acetate/propionate of high concentrate substrate after in vitro rumen fermentation
本试验中,在高精料底物培养条件下添加硫胺素,结果培养液中乳酸的浓度呈降低的趋势,并以D组添加180 mg/kg的硫胺素效果最好。其原因可能是:添加硫胺素促进了瘤胃微生物对乳酸的吸收利用(在体内还有瘤胃上皮细胞的吸收),或者是促进了乳酸的转化而使其积累量减少;也可能是改变了微生物的群体结构而使乳酸的产生量减少。乳酸浓度的降低可缓解酸中毒的发生而提高生产性能,这与前人研究发现的高产奶牛饲喂的高精料饲粮中添加硫胺素有助于提高生产性能[3]是一致的。但至于其乳酸浓度降低,具体的机理,如微生物区系的变化、乳酸的代谢去路等一系列问题还有待于进一步的研究。
3.2 硫胺素对高精料底物瘤胃体外发酵挥发性脂肪酸浓度的影响
瘤胃中挥发性脂肪酸主要来源于饲粮中碳水化合物的发酵,其浓度和比例主要受饲粮组成的影响。饲粮中的碳水化合物在动物采食后在瘤胃中发酵产生挥发性脂肪酸,同时,随着瘤胃微生物的生长繁殖部分挥发性脂肪酸被利用,加之瘤胃上皮细胞吸收挥发性脂肪酸,以及挥发性脂肪酸随食糜向后消化道排出,挥发性脂肪酸浓度呈现动态平衡状态。本研究TVFA浓度在培养后逐渐增加,其原因可能是:体外试验与体内试验不同,产生的挥发性脂肪酸不能够被瘤胃上皮细胞吸收和随食糜排出。但体外培养的培养液具有一定的缓冲能力,TVFA在一定的范围内并不会影响微生物的正常发酵[13];同时,这也能在一定程度上反映微生物的发酵力。本试验表明,以D组添加180 mg/kg水平硫胺素的TVFA浓度最高,这提示该添加量可改善发酵环境和提高微生物的发酵力。
挥发性脂肪酸可以为反刍动物提供70%~80%的消化能[14-15],并且通过挥发性脂肪酸代谢还可为瘤胃消化代谢提供大部分能量[16]。其中乙酸和丙酸均能在反刍动物代谢过程中提供能量,且丙酸发酵产生的能量较多,乙酸与丙酸比例过高会影响能量的利用效率[17],而不利于高精料催肥。由本试验结果可看出,乙酸与丙酸比例在培养开始的0~1 h在2.05~2.87变动,这表明发酵偏向于乙酸型;而在培养3 h后则下降至1.61~1.75,这表明发酵偏向于丙酸型。以上可能是由于发酵之初,瘤胃微生物的发酵更接近于所采集奶牛瘤胃中的体内发酵,而在高精料的培养底物开始发酵后,丙酸则迅速增加而导致了乙酸与丙酸比例的下降。在培养3 h后,乙酸与丙酸比例虽然在组间(除10 h测定时间点外)有显著差异,但都在1.16~1.87变动,这表明高精料底物培养条件下以偏向于丙酸型发酵。总体上,还是以D组添加180 mg/kg的硫胺素乙酸与丙酸比例较低,结合其TVFA浓度最高,认为补充硫胺素可以维持高精料底物培养条件下的稳定发酵。本试验可为目前反刍动物生产实践中,规模化、集约化、高精料饲养方式下容易引发的瘤胃SARA的防治提供一种新的解决思路。
4 结论
①高精料条件下,添加硫胺素整体上降低了培养液乳酸的浓度,并以添加180 mg/kg硫胺素组效果较好,同时该组还提高了TVFA的浓度,降低了乙酸与丙酸比例。
②添加180 mg/kg的硫胺素能够较好地稳定高精料(6∶4)底物的瘤胃发酵。
[1]MUTSVANGWA T,WRIGHT,T C.Sub-acute ruminal acidosis(SARA)in dairy cows[M].Ontario:Ministry of Agriculture and Food,2003.
[2]COMBS G F,Jr.The vitamins:fundamental aspects in nutrition and health[J].American Journal of Clinical Nutrition,1991,53(3):755-763.
[3]SHAVER R D,BAL M A.Effect of dietary thiamin supplementation on milk production by dairy cows[J].Journal of Dairy Science,2000,83(10):2335-2340.
[4]张红伟.硫胺素(VB1)对瘤胃内营养物质消化代谢的影响[D].硕士学位论文.扬州:扬州大学,2010.
[5]DE OLIVEIRA L A,JEAN-BLAIN C,KOMISARCZUK-BONY S,et al.Microbial thiamin metabolism in the rumen simulating fermenter:the effect of acidogenic conditions,a high sulfur level and added thiamin[J].British Journal of Nutrition,1997,78(4):599-613.
[6]熊本海,卢德勋,高俊.绵羊瘤胃VFA吸收效率及模型参数的研究[J].动物营养学报,1999,11(S1):248-255.
[7]张龙翔,张庭芳,李令媛.生化实验方法和技术[M].2版.北京:高等教育出版社,1997:422-428.
[8]BECHDEL S I,HONEYWELL H E,DURCHER R A,et al.Synthesis of vitamin B in the rumen of the cow[J].Journal of Biological Chemistry,1928,80(1):231-238.
[9]MILLER B L,MEISKE J C,GOODRICH R D.Effect of grain source and concentrate level on B-vitamin production and absorption in steers[J].Journal of Animal Science,1986,62(2):473-483.
[10]ZINN R A,OWEN F N,STUART R L,et al.B-vitamin supplementation of diets for feedlot calves[J].Journal of Animal Science,1987,65(1):267-277.
[11]TAJIMA K,ARAI S,OGATA K,et al.Rumen bacterial community transition during adaptation to highgrain diet[J].Anaerobe,2000,6(5):273-284.
[12]韩昊奇,刘大程,高民,等.不同NFC/NDF比对奶山羊瘤胃微生物及瘤胃pH值变化的影响[J].动物营养学报,2011,25(4):597-603.
[13]PREVOT S,SENAUD J,BOHATIER J,et al.Variation in the composition of the ruminal bacterial microflora during the adaptation phase in an artificial fermentor(Rusitec)[J].Zoological Science,1994,11:871-878.
[14]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.
[15]VAN HOUTERT M.Challenging the retinal for altering VFA ratios in growing ruminates[J].Feed Mix,1996,4(1):8-12.
[16]BANNINK A,FRANCE J,LOPEZ S,et al.Modelling the implications of feeding strategy on rumen fermentation and functioning of the rumen wall[J].Animal Feed Science and Technology,2008,143(1/2/3/4):3-26.
[17]ØRSKOV E R,GRUBB D A,SMITH J S,et al.Efficiency of utilization of volatile fatty acids for maintenance and energy retention by sheep[J].British Journal of Nutrition,1979,41(3):541-552.
