饲粮异黄酮添加水平对肥育猪抗氧化、生长及屠体性能的影响
2014-09-20林映才马现永蒋宗勇余德谦
陈 伟 林映才 马现永 蒋宗勇 余德谦
(广东省农业科学院动物科学研究所,农业部华南动物营养与饲料重点实验室,畜禽育种国家重点实验室,广州 510640)
大豆异黄酮主要由大豆苷元、染料木素、黄豆黄素3种物质构成,由于其具有抗氧化、改善免疫等生物学特性,因而被广泛应用于人类医学/营养和动物生产中。异黄酮在化学结构上含有多酚羟基,羟基上的氢原子具有较强的还原活性而使得异黄酮发挥抗氧化作用。体外分析发现,异黄酮比抗氧化剂-抗坏血酸和槲皮素具有更强的抗氧化活性[1]。由此可见,异黄酮能通过清扫机体中活性氧(如羟自由基与超氧阴离子)而发挥抗氧化活性[2-3]。体外试验证实,通过预处理染料木素能保护精子DNA免受氧化损伤[4]。动物试验亦发现,小鼠纯合饲粮中添加0.2%大豆异黄酮,饲喂达5周后,能够增强小鼠抗氧化性能并能防止脂质过氧化[5]。本研究小组证实,在饲粮中添加低水平的异黄酮(40 mg/kg)对动物机体抗氧化能够起促进作用[6]。然而饲粮高水平添加异黄酮对动物抗氧化等生物学功能的影响尚不清楚。本研究旨在探讨饲粮异黄酮添加水平对肥育猪的抗氧化、生长及屠体性能的影响。
1 材料与方法
1.1 试验设计
选取健康、平均体重约为60 kg的72头杜×长×大生长猪(阉公猪和母猪各占1/2),按体重一致原则随机分为6组,每组6个重复,每个重复中1头阉公猪和1头母猪,1个重复在1栏中饲养。对照组饲喂玉米-豆粕型基础饲粮,为参照NRC(1998)[7]营养需要配制的粉状配合饲料。基础饲粮组成及营养水平见表1。试验组饲喂在基础饲粮中分别添加 20、40、80、160、320 mg/kg 异黄酮的试验饲粮。试验期64 d。异黄酮(主要成分为大豆苷元)由广东农科院动物科学研究所新南都饲料科技有限公司合成(纯度99%)。
1.2 动物饲养及样品采集
试验动物每天分别于09:00与16:00共饲喂2次,试验期间试验猪自由采食、饮水。试验结束时,于各组选取体重接近的阉公猪和母猪各3头,空腹12 h后,颈静脉采集抗凝血液(10 mL),3 000 r/min 4℃离心10 min后分装血浆,-20℃冻存待测。采集血液后,电晕猪放血致死,并屠宰,迅速采集肝脏样品后,对屠体劈半后进行屠体性能和肉质测定。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets(air-dry basis) %
1.3 指标测定
1.3.1 生长性能测定
试验开始前和试验结束时,试验猪空腹12 h称重,为初重和末重,根据试验天数计算平均日增重、日均采食量和料重比。
1.3.2 屠体性能及肉质测定
屠体重/率、平均背膘厚、瘦肉重/率、脂肪重/率、眼肌面积、pH及嫩度测定参考 NY/T 825—2004[8]。所有测定工作在广东省农业科学院动物科学研究所屠宰间测定室进行。
1.3.3 血浆生化指标
血浆中抗氧化酶过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(Gpx)、超氧化物岐化酶(SOD)活性以及氧化型谷胱甘肽(GSSG)、还原型谷胱甘肽(GSH)及丙二醛(MDA)浓度均采用试剂盒(南京建成生物研究所)测定。肝脏中抗氧化酶CAT、Gpx、SOD活性及MDA浓度测定采用生理盐水匀浆肝脏组织后4℃、4 000 r/min离心10 min,取上清液根据试剂盒说明测定酶活性,采用双金鸡宁酸(BCA)法测定上清液蛋白质浓度。
1.3.4 氧化平衡系数(PAB value)的测定
血浆与肝脏中氧化平衡系数测定参考Alamdari等[9]的方法。
制剂配制:1)标准液,3 mmol/L尿酸(溶解在10 mmol/L氢氧化钠)代表抗氧化剂,250 μmol/L过氧化氢(H2O2)代表氧化剂,2种物质混合比例分别为 v∶v=9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9;2)甲基联苯胺(TMB)碱性溶液,400 μL TMB/二甲基亚砜(DMSO)(60 mg TMB溶解在10 mL DMSO)加到20 mL乙酸钠缓冲液(0.05 mol/L,pH 4.5)中,并加入70 μL 新鲜氯胺T(100 mmol/L),混匀,室温避光2 h,随后加入25 U的过氧化物酶溶液到20 mL TMB溶液中(若长久使用,分装-20℃保存);3)TMB缓冲溶液,200 μL TMB/DMSO加入到10 mL乙酸钠缓冲溶液(0.05 mol/L,pH 5.8)。4)工作液(随用随配),1 mL TMB碱性溶液+10 mL TMB缓冲溶液,室温下避光孵育2 h(要求立即使用)。
测定操作方法:10 μL标准液加入200 μL工作液中,随即在37℃下避光孵育12 min,孵育后加入100 μL 2 mol/L盐酸,同时设空白对照(双蒸水)。并在450 nm下读数(参考波长 620或570 nm)。根据标准液浓度做标准曲线,计算检测液中的氧化平衡系数。氧化平衡系数表示检测液中H2O2的百分含量。
1.4 数据统计分析
试验数据采用SAS 8.1软件GLM程序进行单因素方差(ANOVA)分析。并在ANOVA分析基础上进行Duncan氏法多重比较,P<0.05表示差异显著。本试验数据采用REG程序对各指标的剂量效应做线性和二次曲线分析。
2 结果与分析
由表2可见,肥育猪血浆中SOD活性随饲粮中异黄酮添加水平增加表现出显著的线性升高(P<0.05),而各组间血浆中SOD活性无显著差异(P>0.05)。饲粮异黄酮添加水平为160 mg/kg时,显著提高了血浆中CAT活性(P<0.05),但其他异黄酮添加水平对血浆中CAT活性无显著影响(P>0.05)。血浆中GSSG浓度在添加水平为40及80 mg/kg时显著下降(P<0.05),而 GSH 浓度在添加水平为 40、80、160、320 mg/kg时较对照组显著上升(P<0.05)。各组间血浆中T-AOC、氧化平衡系数及Gpx活性无显著差异(P>0.05),但当添加水平为320 mg/kg时,血浆中氧化平衡系数表现出高于对照组的趋势(P=0.08)。
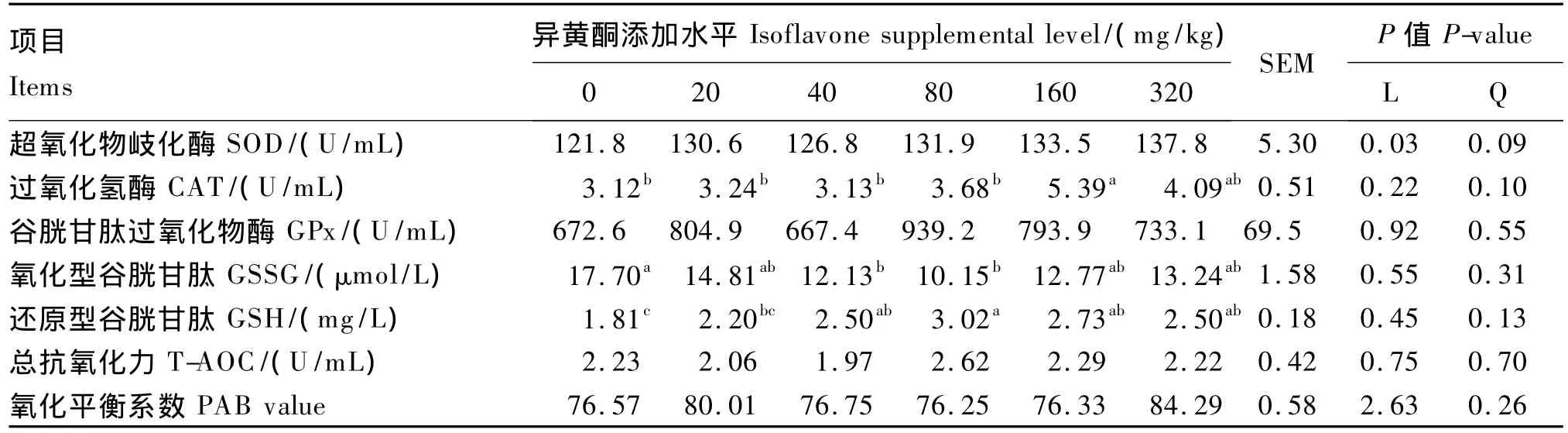
表2 饲粮异黄酮添加水平对肥育猪血浆中抗氧化酶活性影响Table 2 Effects of dietary supplemental level of isoflavones on antioxidant enzyme activities in plasma of finishing pigs
由表3可见,肝脏中Gpx活性随饲粮异黄酮添加水平增加呈显著的线性下降(P<0.05),在添加水平为80、160和320 mg/kg时,肝脏中Gpx活性显著低于对照组(P<0.05)。肝脏中CAT活性在添加80 mg/kg异黄酮时得到显著提高(P<0.05),而在160 mg/kg时则受到显著抑制(P<0.05)。肝脏中T-AOC、SOD以及氧化平衡系数于各组间无显著差异(P>0.05)。

表3 饲粮异黄酮添加水平对肥育猪肝脏中抗氧化酶活性影响Table 3 Effects of dietary supplemental level of isoflavones on antioxidant enzyme activities in liver of finishing pigs
由表4可见,当饲粮中异黄酮添加水平为80或160 mg/kg时,肥育猪血浆中MDA浓度显著低于对照组(P<0.05),而其他各添加水平间血浆MDA浓度无显著差异(P>0.05)。肝脏中MDA浓度各组间均无显著差异(P>0.05)。

表4 饲粮异黄酮添加水平对肥育猪肝脏脂质过氧化的影响Table 4 Effects of dietary supplemental level of isoflavones on lipid perioxidation liver of finishing pigs
饲粮异黄酮添加水平对肥育猪的平均日增重、日均采食量、料重比无显著影响(P>0.05,表5),对屠体重/率、眼肌面积、平均背膘厚、瘦肉重/率、脂肪重/率等屠体性能无显著影响(P>0.05,表6),对背最长肌滴水损失、肉色、嫩度、pH无显著影响(P>0.05,表7)。

表5 饲粮异黄酮添加水平对肥育猪生长性能影响Table 5 Effects of dietary supplemental level of isoflavones on growth performance of finishing pigs
3 讨论
3.1 异黄酮与抗氧化
大豆异黄酮主要由染料木素与大豆苷元组成,在大豆(1 429~4 875 mg/kg)与豆粕(1 570~1944 mg/kg)中含量较高[10-11]。本试验采用玉米-豆粕型饲粮作为基础饲粮,因而与其他试验有所不同的是,本试验基础饲粮中含有较高水平的异黄酮(约390 mg/kg)。在此基础上,添加80或160 mg/kg异黄酮提高了肥育猪血浆中抗氧化酶活性与GSH浓度,同时降低了MDA浓度。该结果提示,饲粮中80和160 mg/kg异黄酮提高了机体抗氧化能力,并降低了机体中脂质过氧化。与本试验研究结果相一致的报道是,对饲喂非大豆来源的基础饲粮的小鼠灌服异黄酮(每200 g体重灌服1 mg大豆黄酮)能提高血浆与血红细胞中抗氧化酶活性[12],从而表现为抗氧化作用。体外细胞试验还发现,由于异黄酮的结构与雌激素相似,因而异黄酮能激活细胞内参与基因转录的重要激酶[13-15],并能抑制由还原型辅酶Ⅱ(NADPH)氧化酶所介导的超氧阴离子的生成[16],从而抑制了促氧化酶途径。由此可见,异黄酮不仅依赖自身结构(具有还原活性的羟基)参与机体中自由基的清除,而且还可通过调节机体中抗/促氧化酶的活性起到抗氧化作用。
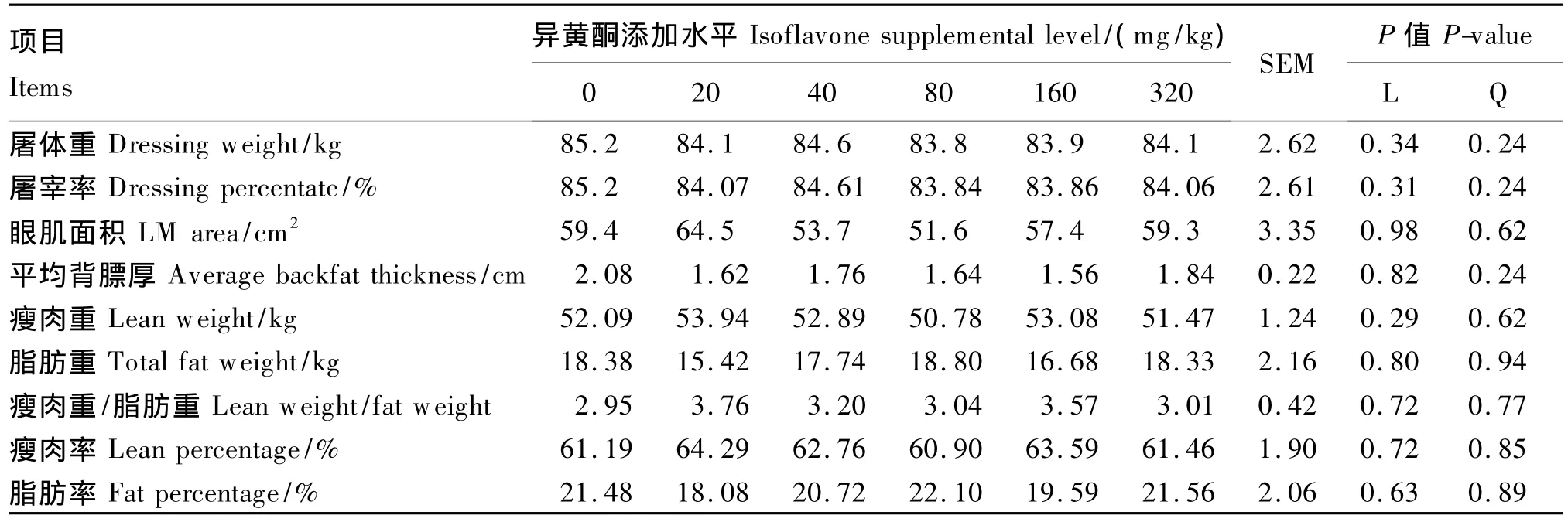
表6 饲粮异黄酮添加水平对肥育猪屠体性能影响Table 6 Effects of dietary supplemental level of isoflavones on carcass performance of finishing pigs
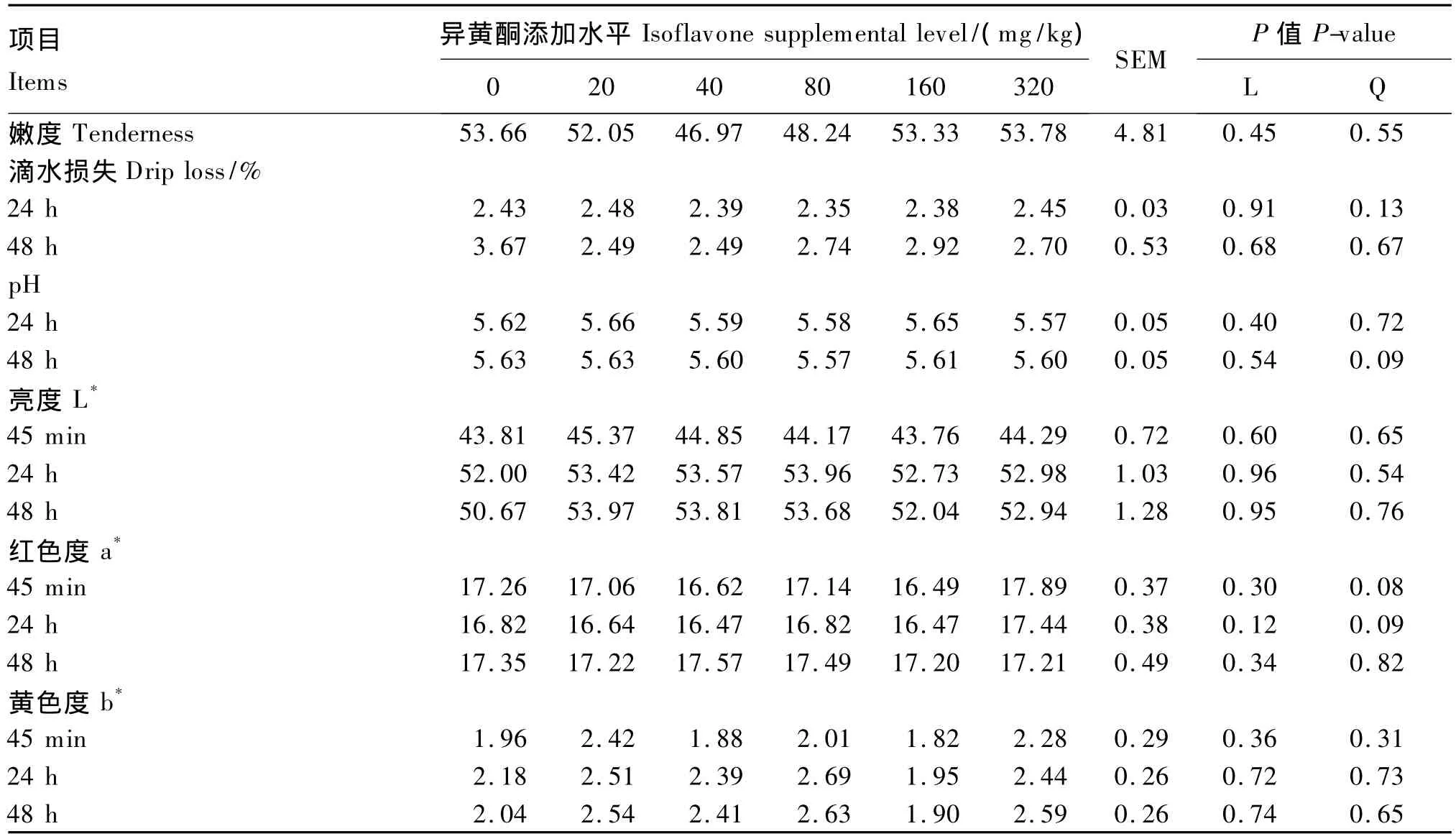
表7 饲粮异黄酮添加水平对肥育猪肉质的影响Table 7 Effects of dietary supplemental level of isoflavones on meat quality of finishing pigs
3.2 高水平异黄酮对抗氧化的潜在抑制效应
本研究还发现,与异黄酮提高抗氧化酶相反的结果是,添加160 mg/kg异黄酮显著降低肝脏中CAT活性;同时肝脏中Gpx活性与T-AOC随着异黄酮添加水平的增加而呈线性降低。虽然80 mg/kg异黄酮相比对照显著降低了MDA浓度,但当添加水平达到320 mg/kg时,血浆中MDA浓度显著高于添加水平为80 mg/kg时。这暗示着饲粮中添加过高水平异黄酮可能对肥育猪表现为抗氧化抑制效应。由于异黄酮在化学结构上与雌激素具有相似性,其对抗氧化酶的调节一定程度上依赖于异黄酮与雌激素受体的互作。研究报道,异黄酮在生理浓度条件下,可通过雌激素受体上调细胞中抗氧化酶锰超氧化物歧化酶(MnSOD)mRNA表达,而表现出抗氧化效应[17]。然而在较高水平(240 mg/kg)条件下,异黄酮对雌激素受体所介导的生物学效应则表现为抑制效应[18]。由此可见,高水平异黄酮可能通过作用于雌激素受体抑制抗氧化酶表达水平。除下调抗氧化酶活性外,高水平异黄酮还可能通过激活促氧化途径影响细胞氧化还原平衡。体外细胞试验表明,饲粮中含有酚环的多酚类物质可氧化人红细胞中血红蛋白,并造成溶血现象[19]。体外研究发现,细胞内染料木素能通过结合内源铜离子,激活促氧化信号通路[20]或诱导细胞中活性氧的生成,促进细胞凋亡[21]。
在其他抗氧化剂研究中亦发现,当较长时间使用高水平的抗氧化剂可引起细胞脂类过氧化,并减弱抗氧化酶的活性,这些抗氧化剂包括维生素 E[22]、维生素 C[23-24]、类胡萝卜素[25]、α - 硫辛酸[26]。综合各项研究报道,一些天然抗氧化剂(尤其是含有酚环类结构物质)不仅具有抗氧化活性,在一些条件下(如高水平)也可能产生促氧化特性[27]。
3.3 异黄酮对肥育猪生长及屠体性能影响
本试验发现,玉米-豆粕型饲粮异黄酮添加水平对肥育猪生长性能和屠体品质没有产生影响,该研究结果与 Kuhn等[28]研究报道相一致。因此可见,即使在表现为抗氧化活性的异黄酮水平(80或160 mg/kg)基础上,也未能对肥育猪的生长起到积极的促进作用。本研究还发现,玉米-豆粕型饲粮中添加40~320 mg/kg不等水平的异黄酮对背最长肌pH、肉色、滴水损失、嫩度等肉质指标均未产生显著影响。
4 结论
①饲粮中添加80或160 mg/kg的异黄酮可提高肥育猪机体抗氧化性能,并减少脂质过氧化。
②饲粮异黄酮添加水平高达320 mg/kg时,对肥育猪肝脏组织抗氧化能力表现出潜在的抑制效应。
③玉米-豆粕型饲粮中添加40~320 mg/kg异黄酮对肥育猪生长、屠体性状及肉质无显著影响。
[1]RŸFER C E,KULLING S E.Antioxidant activity of isoflavone and their major metabolites using different in vitro assays[J].Journal of Agricultural and Food Chemistry,2006,54(8):2926-2931.
[2]HANASAKI Y,OGAWA S,FUKUI S.The correlation between active oxygen scavenging and antioxidative effects of flavonoids[J].Free Radical Biology &Medicine,1994,16(6):845-850.
[3]ROBAK J,GRYGLEWSKI R J.Flavonoids as scavengers of superoxide anions[J].Biochemical Pharmacology,1988,37(5):837-841.
[4]SIERENS J,HARTLEY J A,CAMPBELL J,et al.In vitro isoflavone supplementation reduces hydrogen peroxide-induced DNA damage in sperm[J].Teratogenesis,Carcinogenesis,and Mutagenesis,2002,22(3):227-234.
[5]KAWAKAMI Y,TSURUGASAKI W,YOSHIDA Y,et al.Regulative actions of dietary soy isoflavone on biological antioxidative system and lipid metabolism in rats[J].Journal of Agricultural and Food Chemistry,2004,52(6):1764-1768.
[6]JIANG Z Y,JIANG S Q,LIN Y C,et al.Effects of soybean isoflavone on growth performance,meat quality,and antioxidation in male broilers[J].Poultry Science,2007,86(7):1356-1362.
[7]NRC.Nutrient requirements of swine[S].Washington,D.C.:National Academy Press,1998.
[8]中华人民共和国农业部.NY/T 825—2004瘦肉型猪胴体性状测定技术规范[S].北京:中国农业出版社,2004:1-2.
[9]ALAMDARI D H,PALETAS K,PEGIOU T,et al.A novel assay for the evaluation of the prooxidant-antioixdant balance,before and after antioxidant vitamin administration in type Ⅱ diabetes patients[J].Clinical Biochemistry,2007,40(3/4):248-254.
[10]CHINWANGSO P,ANAI T,MATSUMOTO R.The diversity of isoflavone contents and in vitro antioxidant activities in Japanese soybean(Glycine mx(L.)Merr.)cultivars[J].Bulletin of the Faculty of Agriculture,2010,95:17-28.
[11]FLACHOWSKY G,HÜNERBERG M,MEYER U,et al.Isoflavone concentration of soybean meal from various origins and transfer of isoflavones into milk of dairy cows[J].Journal of Verbraucherschutz and Lebensmittelsicherheit,2011,6(4):449-456.
[12]BARBOSA A C,LAJOLO F M,GENOVESE M I.Effects of free or protein-associated soy isoflavones on the antioxidant status in rats[J].Journal of the Science of Food and Agriculture,2011,91(4):721-731.
[13]MAHN K,BORRÁS C,KNOCK G A,et al.Dietary soy isoflavone induced increases in antioxidant and eNOS gene expression lead to improved endothelial function and reduced blood pressure[J].The FASEB Journal,2005,19(12):1755-1757.
[14]JOY S,SIOW R C,ROWLANDS D J,et al.The isoflavone equol mediates rapid vascular relaxation:Ca2+-independent activation of endothelial nitric-oxide synthase/Hsp90 involving ERK1/2 and Akt phosphorylation in human endothelial cells[J].Journal of Biological Chemistry,2006,281(37):27335-27345.
[15]SIOW R C,LI F Y,ROWLANDS D J,et al.Cardiovascular targets for estrogens and phytoestrogens:transcriptional regulation of nitric oxide synthase and antioxidant defense genes[J].Free Radical Biology &Medicine,2007,42(7):909-925.
[16]XU J W,IKEDA K,YAMORI Y.Genistein inhibits expressions of NADPH oxidase p22phox and angiotensinⅡtype 1 receptor in aortic endothelial cells from stroke-prone spontaneously hypertensive rats[J].Hypertension Research,2004,27(9):675-683.
[17]BORRÁS C,GAMBINI J,GÓMEZ-CABRERA M C.et al.Genistein,a soy isoflavone,up-regulates expression of antioxidant genes:involvement of estrogen receptor,ERK1/2,and NFκB[J].The FASEB Journal,2006,20(12):1476-1481.
[18]WOOD C E,REGISTER T C,FRANKE A A,et al.Dietary soyisoflavones inhibit estrogen effects in the postmenopausal breast[J].Cancer Research,2006,66(2):1241-1249.
[19]GALATI G,SABZEVARI O,WILSON J,et al.Prooxidant activity and cellular effects of the phenoxyl radicals of dietary flavonoids and other polyphenolics[J].Toxicology,2002,177(1):91-104.
[20]ULLAH M F,AHMAD A,ZUBAIR H,et al.Soy isoflavone genistein induces cell death in breast cancer cells through mobilization of endogenous copper ions and generation of reactive oxygen species[J].Molecular Nutrition and Food Research,2011,55(4):553-559.
[21]LEE Y K,PARK O J.Soybean isofalvone genistein regulates apoptosis through NF-κB dependent and independent pathways[J].Experimental and Toxicologic Pathology,2013,65(1/2):1-6.
[22]HAJIANI M,GOLESTANI A,SHARIFTABRIZI A,et al.Dose-depedent modulation of systemic lipid peroxidation and activity of ani-oxidant enzymes by vitamin E in the rat[J].Redox Report,2008,13(2):60-66.
[23]PODMORE I D,GRIFFITHS H R,HERBERT K E,et al.Vitamin C exhibits pro-oxidant properties[J].Nature,1998,392:559-559.
[24]马爱国,刘四朝.不同剂量维生素C对DNA氧化损伤影响的研究[J].营养学报,2001,23(1):12-14.
[25]宋雁,卢承前,陈君石.类胡萝卜素抗氧化和促氧化作用的影响因素[J].卫生研究,2003,32(4):417-419.
[26]BHATTI F,MANKHEY R W,ASICO L,et al.Mechanism of antioxidant and pro-oxidant effects of α-lipoic acid in the diabetic and nondiabetic kidney[J].Kidney International,2005,67(4):1371-1380.
[27]陈伟,林映才,马现永,等.一些抗氧化剂的促氧化作用机制[J].动物营养学报,2012,24(4):595-605.
[28]KUHN G,HENNING U,KALBE C,et al.Growth performance,carcass characteristics and bioavailability isoflavones in pigs fed soy bean based diets[J].Archives of Animal Nutrition,2004,58(4):265-276.
