6种长链脂肪酸对瘤胃微生物体外发酵挥发性脂肪酸浓度的影响
2014-09-20经语佳郑亚洲王梦芝
经语佳 高 健 郑亚洲 王梦芝
(扬州大学动物科学与技术学院,扬州 225009)
反刍动物瘤胃对养分的消化吸收以及微生物发酵可产生大量的挥发性脂肪酸(VFA),而VFA对反刍动物营养代谢和其瘤胃功能存在着重要的影响,且不同种类VFA对反刍动物生理作用不同,饲粮中添加脂肪酸可以影响瘤胃微生物区系及其发酵的过程,引起VFA浓度及比例的变化。VFA是有机物质在瘤胃中发酵的主要产物,可以为反刍动物提供70% ~80%的可消化能[1-2],并且通过VFA代谢为瘤胃消化吸收提供大部分能量[3]。同时,VFA的产生可以使瘤胃保持一个较为理想的酸性环境,利于瘤胃微生物的生长与繁殖,再通过瘤胃微生物对饲粮进行发酵,从而形成瘤胃环境的良性循环[4]。另外,VFA作为结肠厌氧菌对饲粮纤维、未消化淀粉等物质降解、酵解的终产物,易被结肠黏膜上皮细胞吸收,为结肠黏膜提供能源,具有刺激结肠上皮细胞增殖和黏膜生长、增加肠系膜血流和胃肠激素分泌等生理作用。由此可见,VFA在改善反刍动物生产性能中有重要意义。研究表明,油脂在瘤胃中降解产生的不饱和键能抑制原虫[5]、部分菌群[6]的生长及原虫对细菌的吞噬[7],进而可能通过改变瘤胃微生物的群体结构而影响瘤胃的发酵。Ramesh等[8]也报道不同脂肪酸对瘤胃发酵产生的乙酸和丙酸浓度的影响具有一定的差异。但目前对于脂肪酸影响瘤胃内环境及特定微生物区系等的研究鲜见报道。为此,本研究选取6种不同种类的长链脂肪酸,旨在研究其对瘤胃微生物体外发酵产生的VFA浓度的影响,并且为进一步研究脂肪酸对反刍动物瘤胃微生态机理的影响提供试验参考和部分理论依据。
1 材料与方法
1.1 试验动物与饲养管理
试验在2013年3月至2013年5月期间进行。在扬州大学试验农牧场选取3头1.5周岁、体重(29.4±2.7)kg、装有永久性瘤胃瘘管的山羊,单圈饲养,以玉米+豆粕+羊草为常规饲粮,每日按体重的2.5%干物质量供料,07:00和19:00分2次等量饲喂,自由饮水。
1.2 试验设计与培养底物
试验分为添加3%硬脂酸(A组)、油酸(B组)、亚油酸(C组)、α-亚麻酸(D组)、花生四烯酸(E组)、二十碳五烯酸(F组)的试验组和添加3%棕榈酸钙的对照组,每组各设3个重复,另外设1个无底物的空白对照。培养底物组成见表1。
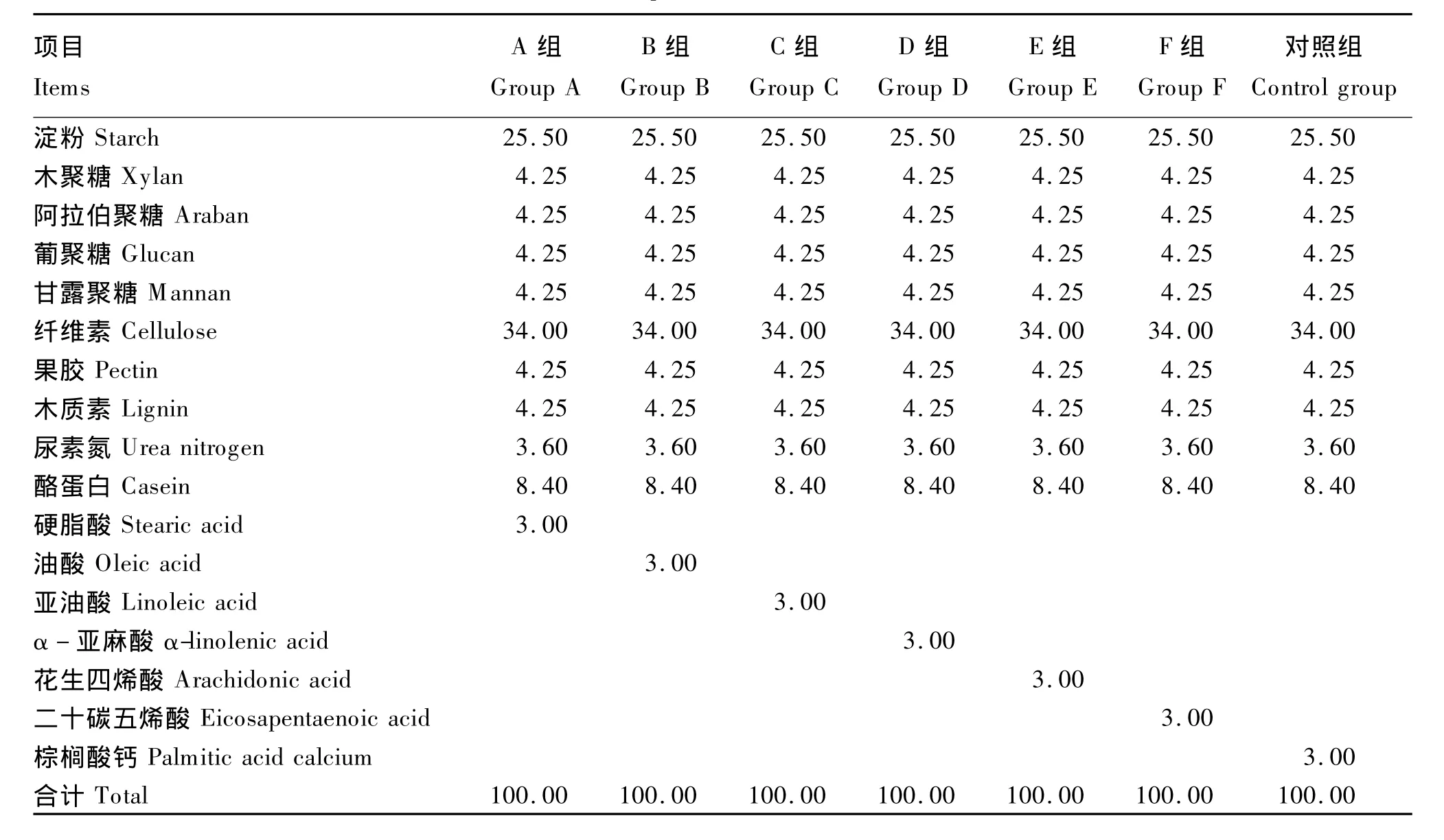
表1 培养底物组成Table 1 Composition of culture substrates %
1.3 体外培养与样品采集
1.3.1 瘤胃液的采集
通过瘤胃瘘管,利用自制真空负压装置,在晨饲前从3只瘘管羊的瘤胃中各采集瘤胃液500 mL,过4层纱布,滤液装于事先通有CO2并39℃预热的灭菌生理盐水瓶中,将3只羊瘤胃液混合均匀,39℃水浴保温迅速送回实验室。
1.3.2 体外培养
体外培养参照Menke等[9]的方法。配制培养液(人工唾液盐∶瘤胃液 =2∶1),通入 CO2,39 ℃水浴预热。按照试验设计编号三角瓶并灭菌30 min,并准确称取各组1.95 g底物置于培养瓶中,分别加入200 mL培养液。通入CO2,39℃恒温水浴振荡培养。
分别在培养后 0、3、6、9、12、18、24 h 取样,每次取2 mL,并-20℃冷冻保存,用于培养液VFA浓度的测定。
1.4 培养液VFA浓度测定
采用日本岛津GC-14B气相色谱仪参考文献[10]的方法进行测定。测定条件:毛细管柱CP-WAX(长30 m,内径0.53 mm,膜厚1μm);气化室温度200℃,氢火焰离子化检测器(FID)温度200℃;柱温采用程序升温法,初温100℃,末温150℃,升温速率3℃/min,灵敏度为101,衰减为25,以巴豆酸为内标物。培养液处理:培养液经15 000×g离心10 min后取上清液1 mL加0.2 mL 20%含60 mmol/L巴豆酸的偏磷酸,混匀后高速离心取上清液0.4μL进样分析。
1.5 统计分析
用SPSS v16.0软件中compare mean的oneway ANOVA程序进行单因素方差分析,用Duncan氏法进行多重比较。
2 结果
2.1 不同种类长链脂肪酸对总VFA浓度的影响
由表2可知,各组总VFA浓度总体上都呈现上升趋势,其时间点平均值由0 h的38.97 mmol/L上升至24 h的117.03 mmol/L,并以D组在培养时间内持续在较高水平波动,而对照组在相对较低的水平波动。总VFA浓度平均值D组最高,为 91.24 mmol/L;对照组最低,为78.47 mmol/L。
0、9、12、24 h 时,总 VFA 浓度组间差异不显著(P>0.05);3 h时,D组总VFA浓度显著高于A、B、C和对照组(P<0.05),但与 E和 F组间差异不显著(P>0.05);6 h时,D组总VFA浓度显著高于A组和对照组(P<0.05),但与B、C、E、F组间差异不显著(P>0.05);18 h时,D组总VFA浓度显著高于A、B、E、F组和对照组(P<0.05),但与C组间差异不显著(P>0.05)。
2.2 不同种类长链脂肪酸对乙酸在总VFA中的摩尔浓度百分比的影响
由表3可知,乙酸在总VFA中的摩尔浓度百分比总体上呈现下降的趋势,在培养后期有上升的趋势,数值在62.87% ~69.74%间变动。
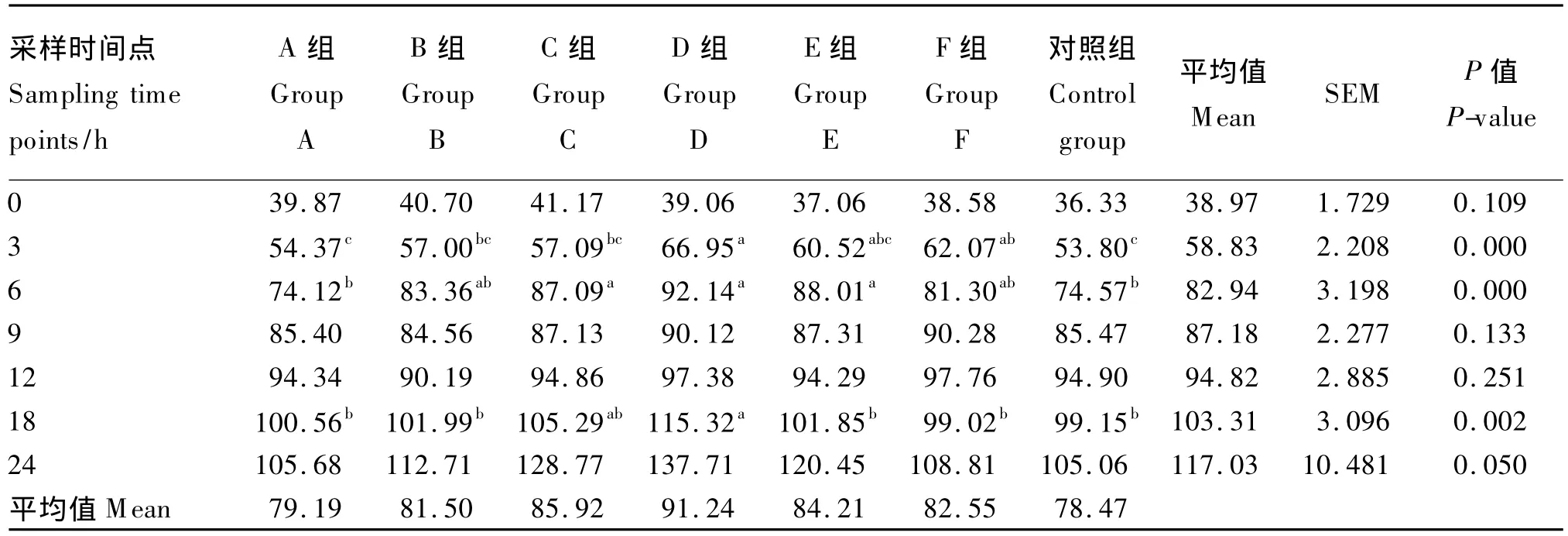
表2 不同种类长链脂肪酸对总VFA浓度的影响Table 2 Effects of different kinds of long-chain fatty acids on total VFA concentration mmol/L
0、3、6、12、24 h 时,乙酸在总 VFA 中的摩尔浓度百分比组间差异皆不显著(P>0.05);9 h时,D组乙酸在总VFA中的摩尔浓度百分比显著高于B和F组(P<0.05),但与A、C、E组和对照组间差异不显著(P>0.05);18 h时,D组乙酸在总VFA中的摩尔浓度百分比显著高于F组(P<0.05),但与A、B、C、E组和对照组间差异不显著(P>0.05)。
2.3 不同种类长链脂肪酸对丙酸在总VFA中的摩尔浓度百分比的影响
由表4可知,丙酸在总VFA中的摩尔浓度百分比总体上呈现上升、下降、再上升和再下降的波动变化趋势,数值在20.86% ~25.83%间变动。
在各采样时间点,丙酸在总VFA中的摩尔浓度百分比组间差异皆不显著(P>0.05)。
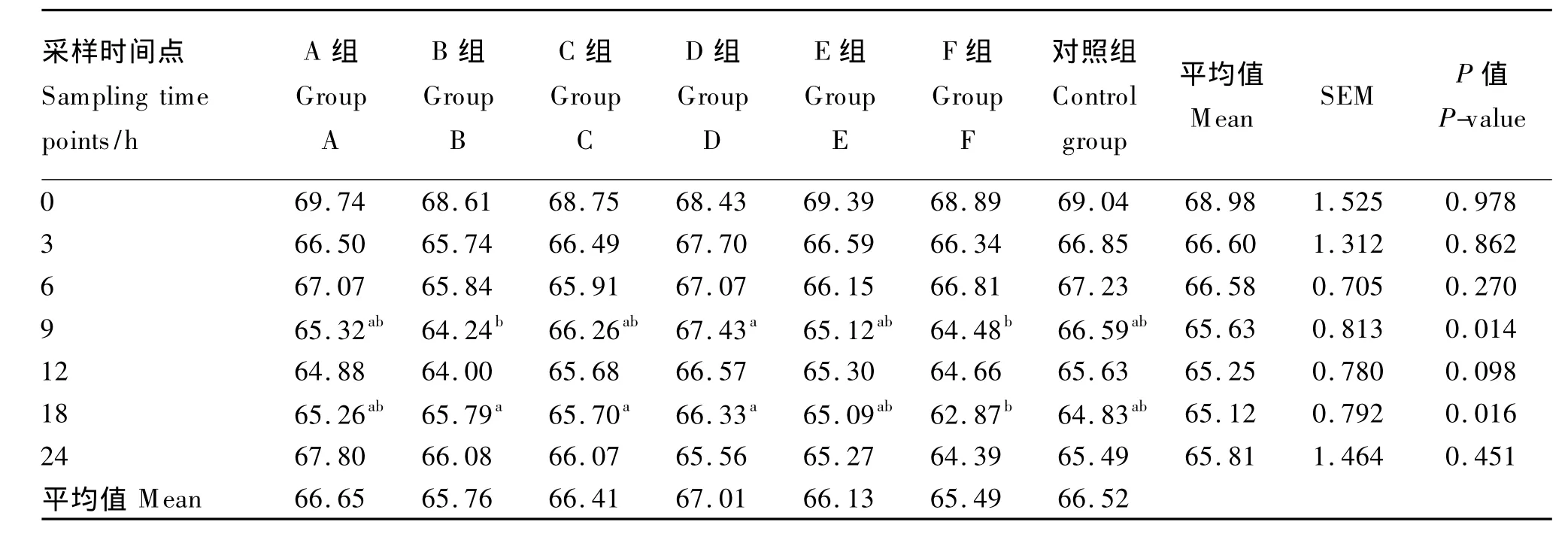
表3 不同种类长链脂肪酸对乙酸在总VFA中的摩尔浓度百分比的影响Table 3 Effects of different kinds of long-chain fatty acids on acetate molar concentration percentage in total VFA %
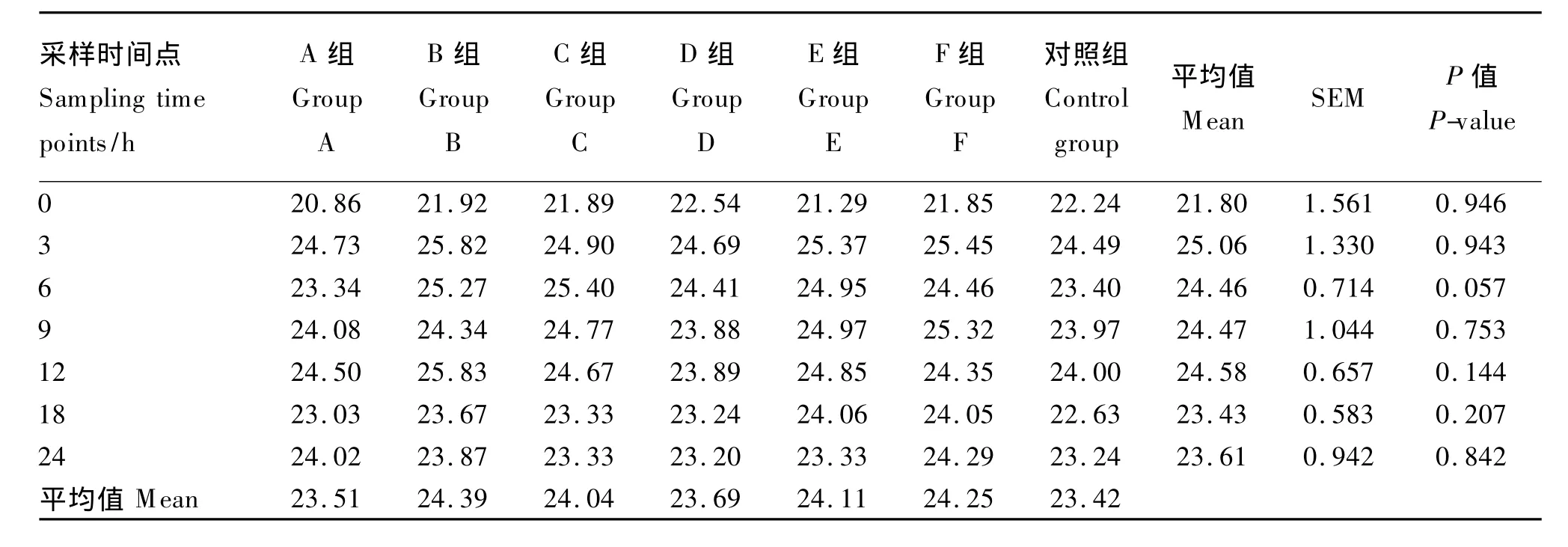
表4 不同种类长链脂肪酸对丙酸在总VFA中的摩尔浓度百分比的影响Table 4 Effects of different kinds of long-chain fatty acids on propionate molar concentration percentage in total VFA %
2.4 不同种类长链脂肪酸对乙酸/丙酸的影响
由表5可知,乙酸/丙酸总体上呈现下降、上升、再下降和再上升的波动变化趋势,数值在2.48~3.34间变动。试验各组乙酸/丙酸平均值以A、D组及对照组较高。0 h平均值较高,为3.19,培养3 h后下降为2.67,之后在2.66~2.79间变动。
6 h时,A组和对照组乙酸/丙酸显著高于B和C组(P<0.05),其他组间差异不显著(P>0.05);其他时间点,乙酸/丙酸组间差异皆不显著(P>0.05)。
2.5 不同种类长链脂肪酸对丁酸在总VFA中的摩尔浓度百分比的影响
由表6可知,丁酸在总VFA中的摩尔浓度百分比总体上呈现下降、上升再下降的趋势,数值在7.62%~13.08%间变动。
0、12、24 h时,丁酸在总VFA中的摩尔浓度百分比组间差异皆不显著(P>0.05);3和6 h时,D组丁酸在总VFA中的摩尔浓度百分比显著低于A组(P<0.05),但与其他组间差异皆不显著(P>0.05);9 h时,D组丁酸在总VFA中的摩尔浓度百分比显著低于B组(P<0.05),但与其他组间差异皆不显著(P>0.05);18 h时,D组丁酸在总VFA中的摩尔浓度百分比显著低于F组和对照组(P<0.05),但与其他组间差异皆不显著(P>0.05)。

表5 不同种类长链脂肪酸对乙酸/丙酸的影响Table 5 Effects of different kinds of long-chain fatty acids on acetate/propionate
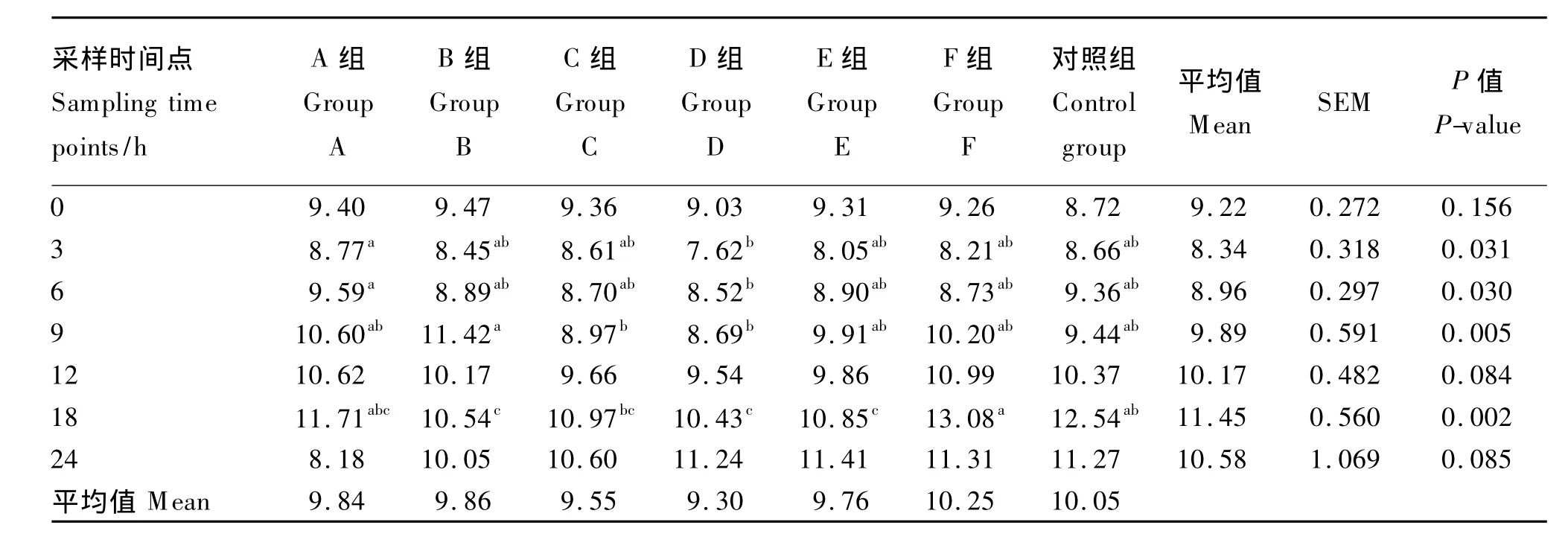
表6 不同种类长链脂肪酸对丁酸在总VFA中的摩尔浓度百分比的影响Table 6 Effects of different kinds of long-chain fatty acids on butyrate molar concentration percentage in total VFA%
3 讨论
3.1 不同种类长链脂肪酸对总VFA浓度的影响
本研究结果表明,添加不同种类的长链脂肪酸后,培养液中总VFA浓度均呈现上升趋势,且0~6 h之间总VFA浓度增长速度较快,6 h后增长速度减缓,这可能与瘤胃微生物的活性有关,符合微生物的生长繁殖规律,即微生物在指数生长期之后,生长速度趋于平稳,然后进入衰亡期[11-12]。本试验中,试验组总VFA浓度均高于对照组,其中以α-亚麻酸组持续在较高的水平(平均值为91.24 mmol/L)波动,且在部分时间点与其他组间有显著差异,说明3%水平的α-亚麻酸有较好地促进发酵的效应。这可能由于游离脂肪酸中的不饱和键能抑制瘤胃原虫的生长繁殖[13],并抑制原虫对瘤胃细菌的吞噬,从而提高了微生物的生物总量和其群体的结构,进而促进了瘤胃的发酵。而不同组间发酵效果的差异,可能和游离脂肪酸的不饱和程度有关。本试验添加3%的油酸、亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸,相当于在培养体系中分别添加了相应的脂肪酸 0.212、0.214、0.216、0.198、0.198 mmol。上述各种不饱和脂肪酸的不饱和度依次增大(分别含有 1、2、3、4、5 个不饱和键),但本试验结果表明处于中等量的α-亚麻酸组的总VFA浓度较其他组高,提示一定量的不饱和脂肪酸通过对微生物的调控促进了培养液的发酵;而不饱和程度更多的花生四烯酸和二十碳五烯酸可能是对微生物的负面作用大于通过抑制原虫提高细菌的正面作用,从而提示该添加水平致使微生物细胞的损害程度较大,而其适宜的添加水平有待进一步的研究。
3.2 不同种类长链脂肪酸对乙酸/丙酸的影响
乙酸和丙酸均能在反刍动物代谢过程中提供能量,且丙酸发酵产生的能量较多,乙酸/丙酸过高会影响能量的利用效率[14];过低则会影响奶牛牛奶的乳脂率[15]。由本试验结果可看出,0~3 h内,乙酸/丁酸均呈下降趋势,而丙酸在总VFA中的摩尔浓度百分比则呈上升趋势。这可能是由于原虫发酵的主要终产物是乙酸和丁酸,产生丙酸的浓度很低[16],而不饱和脂肪酸抑制瘤胃原虫,使原虫数量减少,导致了乙酸、丁酸产生量和乙酸/丙酸的下降。本试验中3~6 h和9~12 h间的乙酸/丙酸的回升和波动,则可能和不饱和脂肪酸对原虫抑制作用的持续时间和效果有关,也可能和瘤胃微生物的生长周期有关。Chalupa等[17]也曾报道,饲粮中添加10%不饱和脂肪酸能降低乙酸/丙酸。另外也有试验表明,饲粮中添加脂肪会降低乙酸浓度,增加丙酸浓度,使乙酸/丙酸降低[18-19];张春梅等[20]利用瘤胃模拟体外产气法研究添加亚麻酸对瘤胃发酵的影响试验中,亚麻油组的乙酸/丙酸显著低于对照组。以上研究与本试验结果皆有一定的一致性。但本试验中,各组乙酸/丙酸的变化趋势总体上不存在显著差异,综合总VFA浓度的结果表明,本试验3%的脂肪酸添加水平促进了微生物发酵,但没有显著改变乙酸/丙酸模式。
3.3 不同种类长链脂肪酸对丁酸在总VFA中的摩尔浓度百分比的影响
丁酸由反刍动物瘤胃中微生物发酵碳水化合物产生,瘤胃内生成的丁酸大部分经瘤胃和网胃壁吸收。丁酸在经瘤、网胃壁吸收的过程中,大部分转变为酮体,生成的酮体80%以上是β-羟丁酸,其余是乙酰乙酸和丙酮。β-羟丁酸可在骨骼肌和心肌中氧化,也可用于脂肪组织和乳腺的脂肪酸合成。丁酸还是上皮细胞的能量来源,可以促进胃肠道细胞的增殖和成熟[21],并对启动瘤胃发育起首要作用[22]。丁酸同时还抑制乙酸和丙酸在瘤胃上皮中的激活,使瘤胃上皮优先利用丁酸,减少了对乙酸的代谢量。由本试验结果可知,丁酸在总VFA中的摩尔浓度百分比波动变化,其中α-亚麻酸组明显低于其他组,且 3、6、9、18 h时与其他组差异显著。这说明3%的α-亚麻酸对瘤胃发酵产生丁酸有一定的抑制作用。这和上述的原虫的代谢终产物是乙酸和丁酸,而该组可能对原虫的抑制作用较强有关。综合总VFA浓度在该组最高而丁酸比例较低的结果表明,3%的α-亚麻酸可能通过抑制原虫繁殖,促进细菌繁殖,进而促进瘤胃微生物的发酵。我们将进一步研究培养液中瘤胃原虫、瘤胃细菌的生物量和其群体结构等,以阐明脂肪酸影响微生物发酵的机理。另外,由于本试验采用精粗比为60∶40的培养底物,这与目前反刍动物生产中多使用的偏粗型饲粮有一定的差异,因此还需进行动物试验来验证生产中是否能达到预期的效果。
4 结论
本试验条件下,培养液中添加3%不同种类的长链脂肪酸对总VFA浓度存在一定的调控作用。随培养时间的延长,各组乙酸/丙酸总体上呈现下降、上升、再下降和再上升的波动变化趋势;以α-亚麻酸促进瘤胃微生物发酵,提高总VFA浓度效果较好。
[1]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.
[2]VAN HOUTERT M.Challenging the retinal for altering VFA ratios in growing ruminates[J].Feed Mix,1996,4(1):514-525.
[3]BANNINK A,FRANCE J,LOPEZ S,et al.Modelling the implications of feeding strategy on rumen fermentation and functioning of the rumen wall[J].Animal Feed Science and Technology,2008,143(1/2/3/4):3-26.
[4]BENSADOUN A,PALADINES O L,REID J T.Effect of level of intake and physical form of the diet on plasma glucose concentration and volatile fatty acid absorption in ruminants[J].Journal of Dairy Science,1962,45(10):1203-1210.
[5]DIJKSTRA J,GERRITS W J J,BANNINK A,et al.Modelling lipid metabolism in the rumen[M]//MCNAMARA J P,FRANCE J,BEEVER D E.Modelling nutrient utilization in farm animals.Wallingford:CAB International,2000:25-36.
[6]LIU S J,姜雅慧.瘤胃添加多不饱和脂肪酸对瘤胃微生物菌群、十二指肠外流脂肪酸和乳脂脂肪酸成分的影响[J].中国畜牧兽医,2012,39(4):10.
[7]王梦芝,程欣,谢文文,等.体外法研究不同油脂对瘤胃原虫吞噬细菌微循环的影响[J].中国农业科学,2010,43(18):3831-3837.
[8]RAMESH B P.含有不同脂肪酸组分的持续培养系统中添加脂类对瘤胃细菌的影响[J].中国畜牧兽医,2011,38(11):131.
[9]MENKE K H,STEINGASSH.Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J].Animal Research and Development,1988,28:7-55.
[10]熊本海,卢德勋,高俊.绵羊瘤胃VFA吸收效率及模型参数的研究[J].动物营养学报,1999,11(增刊1):248-255.
[11]程茂基,卢德勋,王洪荣,等.不同来源肽对培养液中瘤胃细菌蛋白产量的影响[J].畜牧兽医学报,2004,35(1):1-5.
[12]李莉.应用微生物学[M].武汉:武汉理工大学出版社,2006.
[14]ØRSKOV E R,GRUBB D A,SMITH J S,et al.Efficiency of utilization of volatile fatty acids for maintenance and energy retention by sheep[J].British Journal of Nutrition,1979,41(3):541-551.
[15]LINDSAY D B.Growth and fattening[C]//ROOK J A F,THOMAS P C.Nutritional physiology of farm animals.London:Longman Group United Kingdom,1983:261-313.
[16]WILLIAMS A G,COLEMAN G S.The rumen protozoa[M].Netherlands:Springer-Verlag,1992:73-139.
[17]CHALUPA W,RICKABAUGH B,KRONFELD D,et al.Rumen fermentation in vitro as influenced by long chain fatty acids[J].Journal of Dairy Science,1984,67(7):1439-l444.
[18]FUJIHARA T,MAEDA S,MATSUI T,et al.The effect of treated(spray-dried)beef-tallow supplementation on feed digestion,ruminal fermentation and fat nutrition in sheep[J].Animal Science and Technology,1996,67(1):14-23.
[19]TACKETT V L,BERTRAND J A,JENKINS T C,et al.Interaction of dietary fat and acid detergent fiber diets of lactating dairy cows[J].Journal of Dairy Science,1996,79(2):270-275.
[20]张春梅,施传信,易贤武,等.添加亚麻酸及植物油对体外瘤胃发酵和甲烷生成的影响[J].华中农业大学学报,2010,29(2):193-198.
[21]李可洲,李宁,黎介寿,等.短链脂肪酸对大鼠移植小肠作用的研究[J].肠外与肠内营养,2000,7(3):159-161.
[22]GREENWOOD R H,MORRILL J L,TITGEMEYER E C,et al.A new method of measuring diet abrasion and its effect on the development of the forestomach[J].Journal of Dairy Science,1997,80(10):2534-2541.
