不同质量分数N,O-CMC/β-TCP复合材料在模拟体液降解中的pH值变化及其对MG63细胞生长的影响
2014-09-19刘玉艳于东升包幸福吉林大学口腔医院牙体牙髓病科吉林长春00吉林大学口腔医院正畸科吉林长春00吉林大学材料科学与工程学院无机非金属材料系吉林长春005
刘玉艳,于东升,包幸福,高 尚,莎 莉,胡 敏(.吉林大学口腔医院牙体牙髓病科,吉林 长春 00;.吉林大学口腔医院正畸科,吉林 长春 00;.吉林大学材料科学与工程学院无机非金属材料系,吉林 长春 005)
β-磷酸三钙(β-tricalcium phosphate,β-TCP)与生物骨的无机盐成分相似,不但具有诱导成骨细胞成骨分化作用[1-2],而且具有良好的生物相容性和生物可降解性,降解产生的钙、磷离子进入活体循环系统参与并促进新骨形成,最终为新生骨代替,因此β-TCP是骨修复及组织工程支架材料中无机相的研究热点[3-4];但β-TCP具有脆性大及不易成型的缺点,而有机物壳聚糖及其衍生物具有良好的韧性和生物学活性,能弥补β-TCP的不足。因此,将β-TCP与壳聚糖及其衍生物N,O-羧甲基壳聚糖(N,O-CMC)复合的制备方法及其理化性能成为骨修复及组织工程支架材料研究的重点[5-7]。目前有关N,O-CMC/β-TCP不同质量分数复合后的降解性能及细胞相容性尚未见报道[8-9]。因此,本实验通过比较不同质量分数 N,O-CMC/β-TCP复合材料在模拟体液(simulated body fluid,SBF)中pH值变化及其对成骨样细胞MG63形态、生长和增殖的影响,评价其细胞相容性,为探寻理想的骨修复及组织工程支架材料提供参考。
1 材料与方法
1.1 细胞和复合材料 成骨样细胞MG63为人骨肉瘤来源细胞,由吉林大学基础医学院提供。3组自 制 的 质 量 分 数 分 别 为 2/1、1/1 和 1/2 N,O-CMC/β-TCP的复合材料[10-11],以下简称为N,O-CMC/β-TCP(2/1)组、N,O-CMC/β-TCP(1/1)组和 N,O-CMC/β-TCP(1/2)组,3组材料气孔率分别为46.89%、45.64%和63.88%。材料内分布着大小不一(50~400μm)、形态各异的不规则孔隙,其中 N,O-CMC/β-TCP(1/1)组的孔径最大。对照组为纳米磷酸钙胶原基骨修复材料,购于北京益而康公司,经60Co射线辐照灭菌,备用。实验用材料均制备成5mm×5mm×5mm块状。
1.2 主要试剂和仪器 SBF参照Kokubo等[12]的方法进行配制,现用现配并经过滤除菌,4℃冰箱保存备用。DMEM培养基(Gibico公司,美国),胎牛血清(FBS,美国PAA公司),0.25%胰蛋白酶和青/链霉素(美国Gibco公司),β-磷酸甘油钠、地塞米松和维生素C(美国Sigma公司),MTS试剂盒(美国Promega公司)。雷磁PHS-3C型数显pH计测量仪(上海精科仪器有限公司),荧光倒置显微镜和光学显微照相系统(日本Nikon公司),酶标仪(美国Bio-Tek公司),扫描电子显微镜(国产)。
1.3 实验分组 实验共分为4组:N,O-CMC/β-TCP(2/1)组、N,O-CMC/β-TCP(1/1) 组、N,O-CMC/β-TCP(1/2)组和对照组。将各组实验用材料在75%乙醇溶液中浸泡2h,双蒸水反复冲洗,在密闭环境中用高效紫外灯照射1h,灭菌后备用。
1.4 N,O-CMC/β-TCP材料浸泡不同时间SBF溶液pH值测定 先将制备的不同质量分数的N,O-CMC/β-TCP材料置于干净的聚乙烯塑料瓶
中,按照块体质量和SBF体积比为1g/60mL的比例,添加新配制的SBF溶液,再将聚乙烯瓶加盖密封,置于37℃恒温水浴锅中。分别在浸泡第7、14、21和28天时,用pH计测量并记录不同质量分数N,O-CMC/β-TCP材料中SBF的pH值。各测试点分别取3个平行样,取平均值。
1.5 扫描电镜观察MG63细胞在不同材料上的形态 4组材料灭菌后用培养基浸泡1h,备用。将第3代培养的MG63细胞以1×105mL-1密度分别接种在4组材料上,置于48孔板中培养。分别在培养后的第2、4和6天将4组材料用3%戊二醛于4℃下固定24h;梯度酒精30%、50%、70%、80%、90%和95%脱水,每个梯度脱水2次,每次15min。临界点干燥镀金膜,扫描电镜下观察细胞形态学表现。
1.6 各组材料上 MG63细胞相对增殖率测定 在96孔板中分别加入4组材料,每孔保证2 000个细胞,24h后更换细胞培养液,分别在培养第2、4和6天取样。每块板至实验结束前加20μL MTS,继续在37℃、5%CO2条件下孵育4h,酶标仪于450nm波长检测各孔吸光度(A)值,以对照组人工骨第2天作为对照组,无细胞孔为空白组,测定各组细胞不同时间点的相对增殖率,按下述公式计算:相对增殖率=(实验组A值-空白组A值)/(对照组A值-空白组A值)。
1.7 统计学分析 采用SPSS 12.0统计学软件进行统计处理。MG63细胞相对增殖率以±s表示,多组间样本均数比较采用单因素方差分析。
2 结 果
2.1 不同质量分数材料在SBF中浸泡后pH值
最初第1~5天,N,O-CMC/β-TCP(1/2)组和N,O-CMC/β-TCP(2/1)组SBF的pH 值由7.40急降为6.70,之后逐渐回升至7.25,并基本处于稳定 状 态;N,O-CMC/β-TCP(1/1)组 SBF 的pH值由7.40降为7.02,之后逐渐回升至7.15,并自第7天开始一直保持在此范围。见图1。
2.2 不同培养时间MG63细胞在各组材料上黏附的形态学观察 培养48h后,N,O-CMC/β-TCP(2/1)组中细胞呈长梭形,形态欠饱满,铺展面小;N,O-CMC/β-TCP(1/2) 和 N,O-CMC/β-TCP(1/1)组中的细胞呈圆形或长梭形,细胞形态更饱满,可见伪足且铺展面广。随着培养时间延长(第4和6天),材料表面的细胞形态更饱满、铺展程度更高,有大量丝状伪足紧密黏附于材料表面,细胞数量增多且细胞间有细丝状伪足相互交联;对照组未见典型的细胞形态。随着时间延长,4组材料表面均可见大量细胞分泌物。见图2。
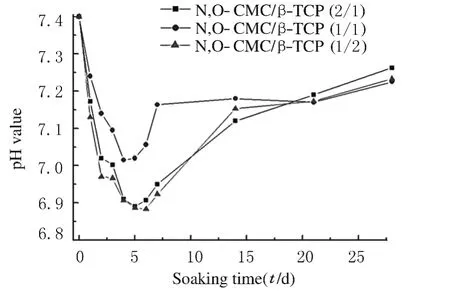
图1 SBF浸泡液pH值变化曲线Fig.1 Change curves of pH values in SBF
2.3 各组材料上 MG63细胞相对增殖率 在培养第1~2天,4组材料中的细胞增殖均较平缓;第4天后,除N,O-CMC/β-TCP(1/2)组中的细胞增殖较慢外,其余各组细胞增殖均较快,MG63细胞的相对增殖率由高到低依次为对照组、N,OCMC/β-TCP(1/1)组、N,O-CMC/β-TCP(2/1)组和 N,O-CMC/β-TCP(1/2)组。与对 照组比较,N,O-CMC/β-TCP(1/1)组 和 N,O-CMC/β-TCP(2/1)组细胞相对增殖率差异无统计学意义(P>0.05),第 4 和 6 天 时 N,O-CMC/β-TCP(1/2)组细胞相对增殖率降低(P<0.05)。见表1。
3 讨 论
3.1 SBF中pH值的变化 本研究中各组材料浸泡初期SBF的pH值急剧下降的原因可能是β-TCP和N,O-CMC的降解与类骨磷灰石的生长使SBF中存在着大量的Ca2+、PO43+和CO32-离子,其中Ca2+离子沉积在试样表面,使SBF中剩余了大量的PO43+和CO32-离子,因此SBF的pH值急剧下降;随着时间的延长,SBF的pH值逐渐回升,至第2周时基本稳定,这可能是材料的降解速率与磷灰石的沉积速率由不平衡的波动达到平衡的动态变化过程,即磷灰石及N,O-CMC的降解与类骨磷灰石的生长在第2周时基本处于稳定状态,SBF的pH值变化不大。本实验中不同质量分数复合材料降解过程中pH值变化均较小且近中性状态:N,O-CMC/β-TCP(1/2)组pH值为6.80~7.25,N,O-CMC/β-TCP(2/1) 组 pH 值 为 6.70~7.25, N, O-CMC/β-TCP(1/1)组 pH 值 为7.00~7.15,这样的复合材料在植入生物体后对其周围细胞的影响较小,可使机体周围组织的pH值稳定在中性偏碱的状态,从而减少无菌性炎症的发生,提高材料的生物相容性。

图2 各组材料上MG63细胞形态学Fig.2 Morphology of MG63cells on materials in various groups
表1 各组 MG63细胞的相对增殖率Tab.1 Relative proliferation rates of MG63cells in various groups (n=10,±s)

表1 各组 MG63细胞的相对增殖率Tab.1 Relative proliferation rates of MG63cells in various groups (n=10,±s)
* P<0.05compared with control group.
Group Relative proliferation rate(t/d)2 4 6 Control 1.00±0.02 2.00±0.05 3.05±0.05 N,O-CMC/β-TCP(2/1) 0.73±0.01 1.24±0.04 2.61±0.05 N,O-CMC/β-TCP(1/2) 0.73±0.01 0.90±0.03* 1.34±0.02*N,O-CMC/β-TCP(1/1)0.73±0.01 1.83±0.02 2.80±0.04
3.2 不同质量分数 N,O-CMC/β-TCP复合材料对MG63细胞生长的影响 随着对生物材料研究的深入,生物功能性原则越来越被重视。由于成骨细胞是骨损伤部位和材料植入部位的主要功能细胞之一,研究材料对成骨细胞生长的影响,能更直接地反映材料对成骨细胞的影响,进而能更直接、更准确地反映材料对骨缺损修复及骨再生的有效性和安全性[13]。因此,本实验通过体外成骨样细胞MG63在材料表面的形态及其生长、增殖变化来评价复合材料的细胞相容性。
从图2中可以看出,培养48h后细胞呈圆形或长梭形铺展,并伸出伪足与材料表面紧密黏附接触;随着培养时间的延长,3组自制材料表面的细胞形态更饱满、铺展程度更高,同时有大量丝状伪足黏附于材料表面且细胞间有细丝状伪足交联。4组材料上均可见大量细胞分泌物,说明4组材料均有较好的细胞相容性。对照组材料表面未见典型细胞形态的原因可能是因为该材料孔隙大、孔隙率高,细胞完全进入到空隙中,因而扫描电镜未能检测出来。应用MTT检测时,对照组材料表面及孔隙中的大部分MG63细胞均能被胰酶消化出来,因而MG63细胞的相对增殖程度最高。实验组材料中N,O-CMC具有细胞外多糖的特性,对细胞的黏附和增殖具 有 促进作 用,尽管N,O-CMC/β-TCP(1/2)组的孔隙率高达64%,但因N,O-CMC含量少,所以细胞相对增殖率比孔隙率较低的另外2组低;而 N,O-CMC/β-TCP(2/1)组中的细胞相对增殖率较 N,O-CMC/β-TCP(1/1)组明显降低的原因可能是后者孔径大,材料内的较大孔隙可为细胞的生长及增殖提供有利条件[13-15]。由此可见,MG63细胞在不同质量分数材料上均能较好的生 长,但 N,O-CMC/β-TCP(1/1) 组 最 利 于MG63细胞的生长。
综上所述,不同质量分数 N,O-CMC/β-TCP材料在SBF中的pH值变化较小,基本处于中性,N,O-CMC/β-TCP(2/1)组和 N,O-CMC/β-TCP(1/1)组材料对MG63细胞增殖均有较好的促进作用,尤其是 N,O-CMC/β-TCP(1/1)组材料。由此可以推测,质量分数为 1/1 的 N,O-CMC/β-TCP材料在骨组织缺损修复中具有良好的应用前景;但用于骨组织工程支架材料还需在气孔率、气孔分布及孔间交通等方面进行改进。
[1]Li SF,Chen W,Yang X,et al.Osteogenic differentiation of osteoblasts induced by calcium silicate and calcium silicate/β-tricalcium phosphate composite bioceramics [J].Biomed Mater Res B:Appl Biomater,2012,100(5):1237-1237.
[2]Chen W,Yang X,Lin KL,et al.The enhancement of bone regeneration by a combination of osteoconductivity and osteostimulation using β-CaSiO3/b-Ca3(PO4)2composite bioceramics [J].Acta Biomater,2012,8(1):350-360.
[3]Kuo SM,Chang SJ,Niu GCC,et al.Guided tissue regeneration with use of beta-TCP/Chitosan composite membrane [J].Appl Polymer Sci,2009,112(5):3127-3134.
[4]Chen BQ,Zhang ZQ,Zhang JX,et al.Fabrication and mechanical properties of beta-TCP pieces by gel-casting method [J].Mater Sci Eng C-Biomimetic Supramol Syst,2008,28(7):1052-1056.
[5]Babaei Z,Jahanshahi M,Rabiee SM,et al.Preparation of nanocomposite via calcium phosphate formation in chitosan matrix usinginsituprecipitation approach[J].Middle-East J Sci Res,2013,13(7):963-996.
[6]郝瑞然,姚爱华,王德平,等.β-磷酸三钙/壳聚糖复合支架的制备及其对成骨细胞生长的影响 [J].功能材料,2010,S1(41):141-151.
[7]刘德宽,尚 伟,崔 军,等.N,O-羧甲基壳聚糖与磷酸三钙复合体的理化性能研究 [J].上海口腔医学,2007,16(3):268-271.
[8]Pati F,Kalita H,Adhikari B,et al.Osteoblastic cellular responses on ionically crosslinked chitosan-tripolyphosphate fibrous 3-D mesh scaffolds[J].J Biomed Mater Res Part A,2013,101(9):1-12.
[9]Sung MK,Soon AY,Seong HC,et al.Gelatin-layered and multi-sized porous β-tricalcium phosphate for tissue engineering scaffold [J].Nanoscale Res Lett,2012,7(1):78.
[10]Li S,Liu YY,Zhang Q,et al. Microwave-assisted coprecipitation synthesis of high purityβ-tricalcium phosphate crystalline powders[J].Mater Chem Phys,2011,129(3):1138-1141.
[11]刘玉艳,莎 莉,张 青,等.N,O-羧甲基壳聚糖/纳米β-磷酸三钙复合材料制备及其性能测试 [J].吉林大学学报:理学版,2011,49(2):315-319.
[12]Kokubo T,Kushitani H,Saka S,et al.Solutions able to reproduce in vivo surface structure changes in bioactive glassceramics A-W3[J].Biomed Mater Res,1990,24(6):721-734.
[13]Hu GF,Xiao LW,Fu H,et al.Degradable and bioactive scaffold of calcium phosphate and calcium sulphate from selfsetting cement for bone regeneration [J].Porous Mater,2010,17(5):605-613.
[14]Zhang F,Chang J,Lu J,et al.Bioinspired structure of bioceramics for bone regeneration in load-bearing sites [J].Acta Biomater,2007,3(6):896-904.
[15]Nihouannen L,Saffarzadeh D,Aguado E,et al.Osteogenic properties of calcium phosphate ceramics and fibrin glue based composites[J].Mater Sci Mater Med,2007,18(2):225-235.
