利用Gateway克隆技术构建人Hiwi腺病毒载体
2014-03-21董晓燕姜艳芳刘蒙蒙刘子玲
马 宁,董晓燕,姜艳芳,刘蒙蒙,刘子玲
(1.吉林大学第一医院血液肿瘤科,吉林 长春 130021;2.吉林大学第一医院风湿免疫科,吉林 长春 130021;3.河南省人民医院血液病研究所,河南 郑州 450000;4.吉林大学第一医院二部中心研究室,吉林 长春 130031)
白血病干细胞(leukemia stem cells,LSC)是最原始的白血病细胞群,与造血干细胞(hematopoietic stem cells,HSC)一样具有自我更新和增殖分化的能力,故此LSC是造成白血病发生、发展、复发和耐药的根本原因[1]。Piwi基因是低等生物干细胞分裂的重要调控因子,参与核内mRNA转录后的修饰过程与干细胞自我更新的调控[2]。人的Hiwi基因是Piwi基因的同源物,其氨基酸序列与Piwi有52%的同源性[3]。Hiwi基因仅在骨髓CD34+细胞中表达,而在间充质干细胞和骨髓基质细胞中则无表达。在对人造血系统的研究[4]中发现:Hiwi基因对造血系统起着负向调节作用,在维持干细胞的静止期或下调干/祖细胞的细胞周期中发挥作用,其表达与永生化的白血病细胞丧失增殖能力有关,过表达则导致白血病细胞的凋亡。本研究采用重叠延伸PCR方法扩增Hiwi编码区基因全长,并利用Gateway克隆技术构建
Hiwi重组腺病毒载体,以期为研究Hiwi诱导白血病干细胞分化和凋亡的作用和机制奠定实验基础。
1 材料与方法
1.1 细胞和主要试剂 293细胞、pDonr221、TE buffer、HDMEM+10%FBS、1×PBS及0.25%trypin-0.04%EDTA均为广州赛业公司产品。Gateway○RBP ClonaseTMⅡEnzyme Mix和Gateway○RLR ClonaseTMⅡPlus Enzyme Mix购自美国Invitrogen公司,QIAquick Gel Extraction Kit购自德国QIAGen公司,质粒提取试剂盒购自天根生化科技(北京)有限公司,dNTP Mix和GeneRulerTM1000bp DNA Ladder购自Fermentas公司,PrimeSTARTMHS DNA Polymerase购自日本Takara公司,PacⅠ酶为NEB公司产品,绿色荧光蛋白(GFP)单边载体购自广州赛业生物科技有限公司。
1.2 重叠延伸PCR扩增attB1-Hiwi-3×flag-IRES-hrGFP-attB2 以GenBank中Piwi-like1基因(BC028581.2)为模板,设计并合成以下引物。P1:5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTGCCACCATGACTGGGAGAGCCCGA-3′,P1r:5′-CATCCACTCTGTATGTCTTAATGTTATACTTGGTAAGAACAACTAAA-3′;P2:5′-AACATTAAGACATACAGAGTGGAT-3′,P2r:5′-GTATTGCTTCCTGTAGTATTCTAAGAAGCTGACCCCAGAGCCGTCGGCTTTCT-3′;P3:5′-CTGGGGTCAGCTTCTTAGAA-3′,P3r:5′-CAGCCAGTTATCTAGTGGCTTAACACTAATTAATGGTGCACC-3′;P4:5′-AGCCACTAGATAACTGGCTG-3′,P4r:5′-CTTCAATCATTATTGCTTTTCTCATTTGCATGCCCATGGCT-3′;P5:5′-ATGAGAAAAGCAATAATGATTGAAG-3′,P5r:5′-GGGCAATCTGTACACAGGTATTTTTTAATAGCATCGTATTTG-3′;P6:5′-TACCTGTGTACAGATTGCCC-3′,P6r:5′-GAGGTAGTAAAGGCGGTTTG-3′;P6r+3×flag:5′-CAAACCGCCTTTACTACCTCGACTACAAGGATGACGATGAC-3′,attB2hrGFP:5′-GGGGACCACTTTGTACAAGAAAGCTGGGTTTACACCCACTCGTGCAGG-3′。
分别扩增如下片段,并引入相应的点突变:以P1+P1r、P2+P2r、P3+P3r、P4+P4r、P5+P5r和P6+P6r扩增片段1~6;以含有IRES-hrGFP序列的质粒为模板,扩增如下片段:P6r-3×Flag+attB2-hrGFP,Flag-IRES-hrGFP。然后将片段1~6和Flag-IRES-hrGFP进行分段融合。PCR扩增体系50μL,其中含5×Primer STARTM Buffer(Mg2+Plus)10μL、dNTP Mixture(10μmol·L-1)4μL、引物(10μmol·L-1)2μL、模板DNA(10μg·L-1)1μL、Primer STARTMHS DNA Polymerase 0.5μL和ddH2O 33.5μL。扩增条件:98℃预变性3min;98℃变性10s、60℃退火10s、72℃延伸5min,共30个循环。取5μL PCR扩增产物以琼脂糖凝胶电泳分析鉴定。
1.3 利用Gateway克隆技术构建pDown-Hiwi-3×flag-IRES-hrGFP 根据纯化目的基因的浓度进行5μL的反应体系:PCR纯化产物100ng、pDonr221100ng、BP clonase 1μL,加TE buffer至5μL,轻轻混匀,室温(25℃)BP反应3h。加入蛋白酶K终止反应10min,然后转化BP反应产物到Stb13,菌落PCR筛选阳性克隆(引物pUp/Do-flank-f:CGGCCAGTCTTAAGCTCGGG;pUp/Do-flank-r:AATACGACTCACTATAGGGGA),提取阳性克隆质粒送广州赛业生物有限公司进行测序。
1.4 利用Gateway克隆技术构建pAV.Ex1d-Hiwi-3×flag-IRES-hrGFP 小量提取质粒pDown-Hiwi-3×flag-IRES-hrGFP,与pAV.Des1d室温(25℃)LR反应3h,反应体系:pDown-Hiwi-3×flag-IRES-hrGFP 5fmol、pAV.Des1d5fmol、LR clonase 1μL,加TE buffer至5μL。加入蛋白酶K终止反应10min,转化BP反应产物到Stb13,菌落PCR筛选阳性克隆(引物pAVDes1d-flank-f:GAACCCACTGCTTACTGGCTT;pAV-Des1d-flank-r:TCGAGACCGAGGAGAGGGT),提取阳性克隆质粒送广州赛业生物有限公司进行测序。
1.5 腺病毒Ad-Hiwi-3×flag-IRES-hrGFP包装 PacⅠ酶切线性化腺病毒质粒pAd-Hiwi-3×flag-IRES-hrGFP,并进行回收;接种HEK293A细胞到6孔板内(2×105cells/well),含10%FBS的DMEM高糖培养基,37℃、5%CO2培养至80%~90%融合度。转染前换成1mL新鲜的含10%FBS的DMEM高糖培养基。取一支500μL EP管,加入Opti-MEM 250μL和DNA 1μg,轻轻颠倒混匀。另取一支500μL EP管,加入Opti-MEM 250μL和Lipofectine 3μL,轻轻颠倒混匀,孵育5min。将上述2管溶液混合,轻轻颠倒混匀,孵育20min。将混合液滴加到6孔板内,轻微晃动混匀,37℃、5%CO2培养过夜。24h后更换成DMEM高糖培养基(含10%FBS),7d后开始出现细胞病变效应(CPE)。收集粗毒。当大部分细胞病变时,收集细胞和上清。37℃、-80℃反复冻融3次以裂解细胞、释放病毒。4℃、2000g离心10min。将含有病毒的上清小量分装,-80℃冻存。定义该初次包装好的病毒代数为P0。
1.6 腺病毒Ad-Hiwi-3×flag-IRES-hrGFP大量扩增和浓缩 接种HEK293A细胞到6瓶T75培养瓶,待生长至90%融合度时,换成新鲜培养液,每瓶加入100μL P0代病毒液,轻微晃动混匀,37℃、5%CO2培养2~3d后大部分细胞出现病变。收集细胞和培养上清,2000g离心10min。弃上清,细胞沉淀用无菌PBS重悬。37℃、-80℃反复冻融3次以裂解细胞、释放病毒。4℃、2000g离心15min,将含有病毒的上清小量分装,-80℃冻存,定义该批病毒代数为P1。
1.7 腺病毒滴度检测 采用组织细胞半数感染量(TCID50)法对腺病毒滴度进行检测:收集处于对数生长期、生长状态良好的HEK293A细胞,用培养基稀释至1×105mL-1,96孔板每孔接种100μL上述细胞悬液(1×104个/孔)。10%FBS的DMEM高糖培养基,37℃、5%CO2恒温饱和湿度培养箱内培养过夜。有限稀释法稀释病毒,从1×10-1~1×10-12,从最高稀释度开始,按每个稀释度0.1mL的量分别加入到接种有HEK293A细胞的96孔板的1~10号孔(1×10-12~1×10-5),最后2孔作为空白对照(加入DMEM培养基0.1mL)。37℃、5%CO2恒温饱和湿度培养箱内培养10d。10d后在倒置显微镜下观察各孔CPE现象。对于100μL样品,病毒滴度为:T=10s+0.8PFU·mL-1,其中S=阳性比率之和(从第1个稀释度算起)。
2 结 果
2.1 重叠PCR扩增attB1-Hiwi-3×flag-IRES-hrGFP-attB2产物回收 利用设计的特异性引物扩增点突变后的Hiwi编码区基因全长,取5μL PCR扩增产物进行琼脂糖凝胶电泳,可见明显的条带,片段大小与预期结果一致。见图1。
2.2 Gateway克隆技术构建pDown-Hiwi-3×flag-IRES-hrGFP BP反应构建pDown-Hiwi-3×flag-IRES-hrGFP,菌落PCR筛选阳性克隆。见图2。clone 2、4、5、6扩增出约4000bp的目的条带,片段大小与理论值相符,选取clone 4做后续实验。送检测序,结果显示:基因片段的编码区序列和GenBank中报道的序列完全一致。
2.3 Gateway克隆技术构建pAV.Ex1d-Hiwi-3×flag-IRES-hrGFP LR反应构建pDown-Hiwi-3×flag-IRES-hrGFP,菌落PCR筛选阳性克隆(图3)。扩增出约4000bp的目的条带,片段大小与理论值相符。选取clone 4、6和7作后续实验,送检测序,结果显示:基因片段的编码区序列和GenBank中报道的序列完全一致。
2.4 腺病毒质粒pAV.Ex1d-Hiwi-3×flag-IRES-hrGFP酶切鉴定 对菌落PCR扩增产物进行PacⅠ酶切鉴定:腺病毒质粒为38471bp,PacⅠ分别酶切出约2000和36000bp的2条片段。见图4。
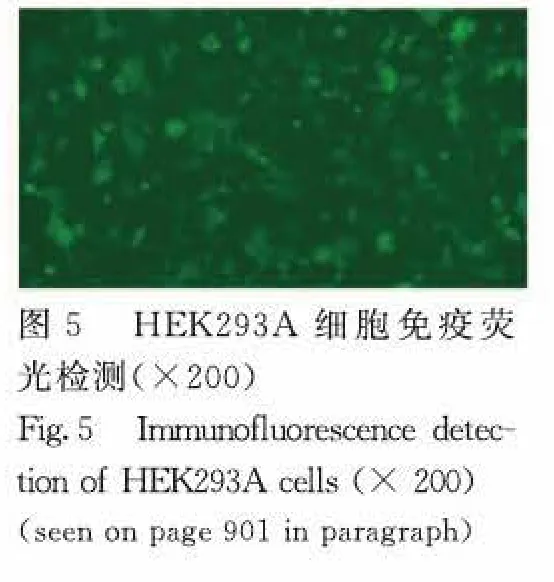
2.5 重组病毒子的获得 鉴定正确的重组pAV.Ex1d-Hiwi-3×flag-IRES-hrGFP质粒,经PacⅠ酶切后转染HEK293A细胞,2~3d后在显微镜下可观察到荧光(图5,见插页四)。7d后收集细胞,反复冻融的重组病毒子经多轮感染,低温离心后将含有病毒的上清小量分装,-80℃冻存备用。
2.6 腺病毒滴度检测 采TCID50法对腺病毒滴度进行检测,本实验中腺病毒滴度约为3.98×1010PFU·mL-1。
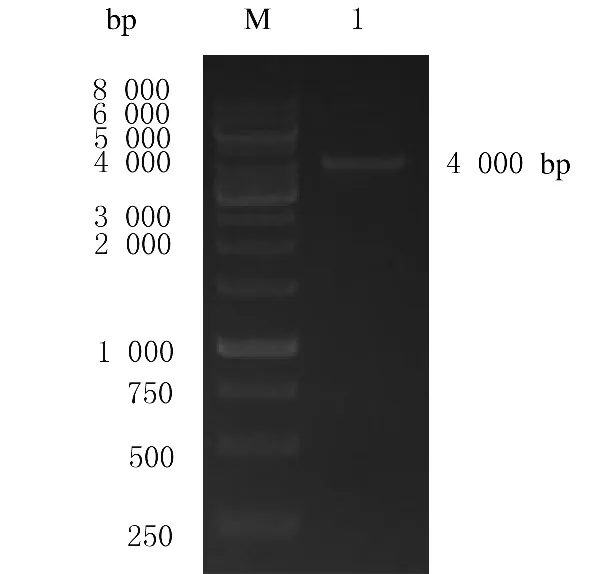
图1 重叠延伸PCR扩增产物鉴定电泳图Fig.1 Electrophoregram of overlap extention PCR product
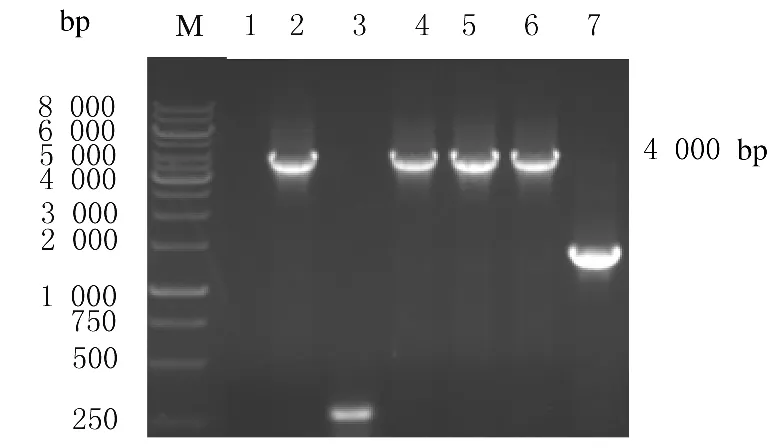
图2 菌落PCR筛选BP反应阳性克隆Fig.2 Positive clones of BP reaction screened with bacterial colony PCR
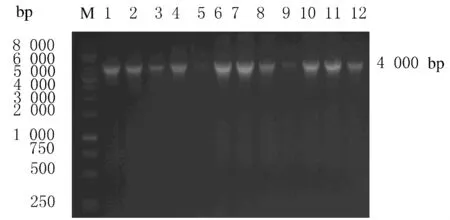
图3 菌落PCR筛选LR反应阳性克隆Fig.3 Positive clones of LR reaction screened with bacterial colony PCR

图4 腺病毒质粒pAV.Ex1d-Hiwi-3×flag-IRES-hrGFP酶切分析Fig.4 Restriction enzyme digestion of pAV.Ex1d-Hiwi-3×flag-IRES-hrGFP
3 讨 论
恶性肿瘤是危害人类健康最严重的疾病,近年来,随着对肿瘤研究的深入,提出了肿瘤干细胞(tumor stem cell,TSC)学说[3],目前已在血液系统肿瘤、胃肠道肿瘤和乳腺肿瘤等多种肿瘤中证实TSC的存在。TSC具有干细胞样自我更新、无限增殖及分化潜能,是肿瘤发生、发展、侵袭、转移和耐药的决定性因素[5-6]。
LSC即是白血病的肿瘤干细胞,其与HSC一样具有自我更新和增殖分化的能力,尽管与HSC特异受体相互作用的许多外界信号已经被识别,但对支配HSC及LSC自我更新的信号机制研究甚少,因此关于LSC的分子调控机制成为研究的热点之一。
Lin等[2]于1997年首先在果蝇的胚胎种系干细胞中发现了Piwi基因,并且发现其已经在胶质瘤干细胞(GSC)的自我更新过程中显示出了很重要的作用。Piwi是干细胞分裂的重要调控因子,参与核内mRNA转录后的修饰过程与干细胞自我更新的调控,在各种生物中具有广泛的保守性[1,7]。人Hiwi基因定位在12q24.33,cDNA全长3600bp,包含1个56bp的5′非编码区,723bp的3′非编码区和1个3362bp的开放阅读框架(ORF),编码862个氨基酸[2],均为Argonaute家族中的成员。目前研究[8]发现:Argonaut家族蛋白是小RNA复合体的基本组成成员之一,在生物物种中高度保守。当小RNA与具有同源序列的靶mRNA或靶DNA结合后,Argonaut家族蛋白则诱导组蛋白或区域DNA甲基化,以删除部分DNA序列、降解mRNA、抑制翻译活动从而发挥基因沉默作用。Hiwi最先在睾丸生殖细胞中被检测到,在睾丸细胞中的表达仅限于在精子形成前的精母细胞和圆形精子细胞,而在丧失生殖系特征的非精母细胞中不表达。Hiwi在生殖系统恶性肿瘤细胞中的表达增强,提示其在生殖细胞的特性维持与增殖中发挥一定作用[9]。除了生殖细胞外,Hiwi在胚胎组织和成人胃、肝脏、肾脏等组织中均有表达。研究[10-12]发现:Hiwi在正常胃黏膜、萎缩性胃炎、肠化生和胃癌组织中表达率分别为10%、36%、36%和76%,与胃组织病变的发展恶化过程密切相关。体外实验[13]证实:Hiwi在5种胃癌细胞株中呈高表达,当用RNAi抑制其表达时,胃癌细胞的增殖速度明显减慢,细胞周期阻滞在G2/M期,证实了Hiwi在肿瘤发生发展过程中起到重要作用。Sharma等[3]发现:人Hiwi在骨髓CD34+细胞中表达较丰富,随着CD34+细胞的分化,其表达逐渐较少。Hiwi的表达与永生化的白血病细胞KG1丧失增殖能力相关,过表达可导致KG1的凋亡。因此,Hiwi基因可能在维持干细胞的静止期或下调干(祖)细胞的细胞周期中发挥重要作用,即对造血系统肿瘤的发病过程中起着负向调节作用[13]。
重叠延伸PCR是利用PCR技术在体外进行有效的基因重组和定点突变,而且不需要内切酶和连接酶处理,尤其是对于定点突变,其突变效率高,操作简单,因此运用非常广泛[14]。而腺病毒载体是目前转基因实验研究中使用最多的病毒载体,并且由于其优点而备受关注:感染效率高,既可以感染分裂期,又可以感染非分裂期细胞;外源基因表达水平高;病毒滴度高,制备纯化相对容易;插入外源基因容量大;病毒基因组较少发生重排[15-17]。本实验中选用重叠延伸PCR完成6个部位的点突变,扩增了人Hiwi编码区基因全长,并且有效连接标签蛋白及GFP报告基因,然后应用pAV.Des1d腺病毒载体系统,将目的基因应用Gateway技术定向克隆至入门载体,利用入门载体与病毒骨架在体外进行同源重组,将目的基因转入病毒骨架,转化筛选,整个过程只需两步,过程操作相对简单、快捷、准确。本实验结果表明:利用Gateway克隆技术构建Hiwi重组腺病毒载体,不仅大大简化了基因克隆的步骤,而且显著提高了克隆效率。
本研究成功构建了重组腺病毒载体,获得了高效价重组腺病毒子pAV.Ex1d-Hiwi,可进一步用于基因治疗靶细胞的转染,构建白血病干细胞基因治疗的细胞载体,为今后白血病基因治疗的研究奠定了实验基础。
[1]Buss EC,Ho AD.Leukemia stem cells[J].Int J Cancer,2011,129(10):2328-2336.
[2]Lin H,Spradling AC.A novel group of pumilio mutations affects the asymmetric division of germline stem cells in the Drosophila ovary[J].Development,1997,124(12):2463-2476.
[3]Sharma AK,Nelson MC,Brandt JE,et al.Human CD34(+)stem cells express the hiwi gene,a human homologue of the Drosophila gene Piwi[J].Blood,2001,97(2):426-434.
[4]Cox DN,Chao A,Baker J,et al.A novel class of evolutionarily conserved genes defined bv piwi are essential for stem cell self-renwal[J].Genes Dev,1998,12(23):3715-3727.
[5]Reya T,Morrison SJ,Clarke MF,et al.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414(6859):105-111.
[6]Couzin J.Medicine.Tracing the steps of metastasis,cancer’s menacing ballet[J].Science,2003,299(5609):1002-1006.
[7]Suzuki R,Honda S,Kirino Y.PIWI expression and function in cancer[J].Front Genet,2012,3:204.
[8]Qiao D,Zeennmn AM,Deng W,et al.Molecular characterization of Hiwi,a human member of the piwi gene family whcse overexpression is correlated to seminomas[J].Oncogene,2002,21(25):3988-3999.
[9]Zhao YM,Zhou JM,Wang LR,et al.HIWI is associated with prognosis in patients with hepatocellular carcinoma after curative resection[J].Cancer,2012,118(10):2708-2717.
[10]Zeng Y,Qu LK,Meng L,et al.HIWI expression profile in cancer cells and its prognostic value for patients with colorectal cancer[J].Chin Med J,2011,124(14):2144-2149.
[11]Liang D,Fang Z,Dong M,et al.Effect of RNA interference-related HiWi gene expression on the proliferation and apoptosis of lung cancer stem cells[J].Oncol Lett,2012,4(1):146-150.
[12]Jiang J,Zhang H,Tang Q,et al.Expression of HIWI in human hepatocellular carcinoma[J].Cell Biochem Biophys,2011,61(1):53-58.
[13]Liu X,Sun Y,Guo J,et al.Expression of hiwi gene in human gastric cancer was associated with proliferation of cancer cells[J].Int J Cancer,2006,118(8):1922-1929.
[14]Zhang X,Godbey WT.Viral vectors for gene delivery in tissue engineering[J].Adv Drug Deliv Rev,2006,58(4):515-534.
[15]Goncalves MA,de Vries AA.Adenovirus:from foe to friend[J].Rev Med Virol,2006,16(3):167-186.
[16]Ghosh SS,Gopinath P,Ramesh A.Adenoviral vectors:a promising tool for gene therapy[J].Appl Biochem Biotechnol,2006,133(1):9-29.
[17]Vorburger SA,Hunk KK.Adenoviral gene therapy[J].Oncology,2002,7(1):46-59.
