血清HMGB1与炎症细胞因子在AECOPD患者中的变化及其临床意义*
2014-09-18王大江
王大江
慢性阻塞性肺疾病(COPD)多临床病理因素作用下形成,其中慢性炎性反应是COPD的重要发病基础。大量研究证实,个体易感性人群在感染、职业粉尘、空气污染、化学物质、吸烟等刺激下导致呼吸道、肺血管和肺实质发生慢性炎性反应,嗜酸性粒细胞、中性粒细胞、巨噬细胞、淋巴细胞、单核细胞等炎性细胞激活,分泌炎症介质[1]。短暂局限性炎症介质对机体产生保护功能,但长期弥漫性炎症介质释放严重损伤机体,容易导致机体肺组织受损,促进炎性反应发生[2]。近期研究还表明,高迁移率族蛋白1具有促进炎症细胞因子释放,在炎性反应程度的评估中具有重要的价值[3]。但关于血清HMGB1与炎症细胞因子在AECOPD患者中的变化及其对肺功能的影响研究甚少,现报道如下。
1 资料与方法
1.1 一般资料 选取2012年1月-2014年6月期间本院呼吸内科慢性阻塞性肺疾病急性加重期(AECOPD)患者45例作为AECOPD组和慢性阻塞性肺疾病稳定期患者44例作为SCOPD组,纳入标准:COPD诊断标准、COPD稳定期和COPD急性加重期定义均参考慢性阻塞性肺疾病诊断与治疗规范[4]。排除标准:心功能不全、肝肾衰竭、凝血功能异常、全身感染性疾病(除肺部感染)、严重高血压、糖尿病、恶性肿瘤和精神性疾病患者。同期选取本院健康体检中心40例健康体检者作为对照组。AECOPD组:男34例,女11例,年龄38~72岁,平均(60.98±8.54)岁,轻度15例,中度25例,重度5例,合并呼吸衰竭23例,未合并呼吸衰竭22例,合并多发性肺大泡20例,无肺大泡25例;SCOPD组:男30例,女14例,年龄35~70岁,平均(60.44±8.02)岁;对照组:其中,男29例,女11例,年龄36~71岁,平均(60.51±8.04)岁。两组患者在性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 检测方法 (1)试剂:酶联免疫吸附测定试剂盒均由Mab Tech公司提供;(2)标本采集与检测:全部研究对象均于清晨空腹采集静脉血液标本5 mL,4 ℃,3000 r/min离心15 min,血清分离后置于-70 ℃冰箱中保存,检测前复温至常温,全部标本均采用酶联免疫吸附试验方法检测,严格按照ELISA法说明书操作。
1.3 观察指标 组间比较血清HMGB1、IL-17、IL-23、TNF-α、IFN-γ、MIP-1α 和 肺 功 能 指 标(FEV1Pred、FEV1/FVC),采用Pearson相关性分析血清HMGB1、炎症细胞因子与肺功能指标之间的关系。
1.4 统计学处理 本研究数据采用SPSS 18.0统计软件进行分析,多组间的计量资料采用单因素方差分析,进一步组组间比较采用q检验,计量资料采用(x-±s)表示,采用Pearson相关性分析指标间的关系,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组患者HMGB1、炎症细胞因子的比较 AECOPD组患者血清HMGB1、IL-17、IL-23、TNF-α、IFN-γ、MIP-1α均明显高于SCOPD组和对照组,SCOPD组上述指标均明显高于对照组,组间比较差异具有统计学意义(P<0.05),见表1。
表1 各组患者HMGB1、炎症细胞因子的比较(±s)
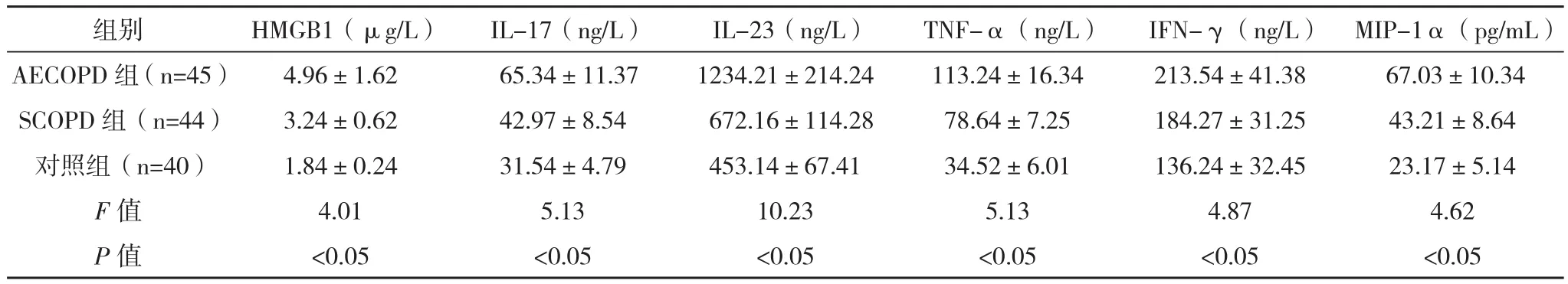
表1 各组患者HMGB1、炎症细胞因子的比较(±s)
组别 HMGB1(μg/L) IL-17(ng/L) IL-23(ng/L) TNF-α(ng/L) IFN-γ(ng/L) MIP-1α(pg/mL)AECOPD 组(n=45) 4.96±1.62 65.34±11.37 1234.21±214.24 113.24±16.34 213.54±41.38 67.03±10.34 SCOPD 组(n=44) 3.24±0.62 42.97±8.54 672.16±114.28 78.64±7.25 184.27±31.25 43.21±8.64对照组(n=40) 1.84±0.24 31.54±4.79 453.14±67.41 34.52±6.01 136.24±32.45 23.17±5.14 F值 4.01 5.13 10.23 5.13 4.87 4.62 P值 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05
2.2 各组患者肺功能指标之间的差异 AECOPD组患者FEV1Pred,FEV1/FVC值明显低于SCOPD组和对照组,SCOPD组上述指标明显低于对照组,组间比较差异具有统计学意义(P<0.05),见表2。
表2 各组患者肺功能指标之间的差异(±s) %
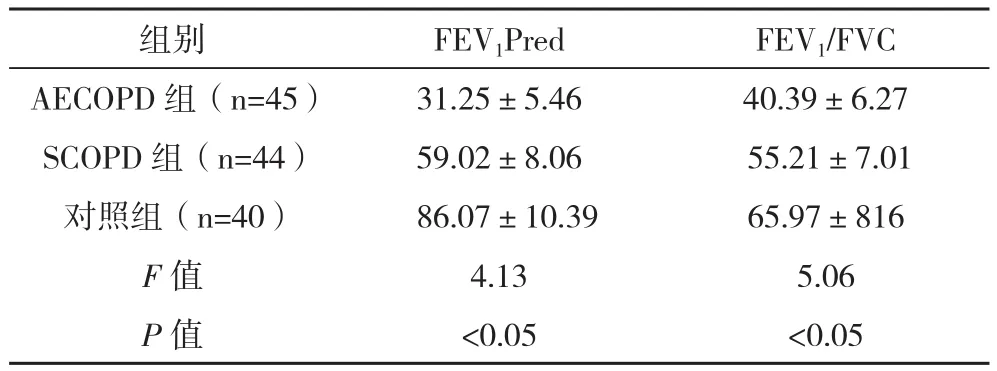
表2 各组患者肺功能指标之间的差异(±s) %
组别 FEV1Pred FEV1/FVC AECOPD 组(n=45) 31.25±5.46 40.39±6.27 SCOPD组(n=44) 59.02±8.06 55.21±7.01对照组(n=40) 86.07±10.39 65.97±816 F值 4.13 5.06 P值 <0.05 <0.05
2.3 肺功能指标与血清HMGB1、炎症细胞因子IL-17、IL-23、TNF-α、IFN-γ、MIP-1α之间的关系经Pearson相关性分析发现,血清HMGB1和炎症细胞因子水平与肺功能具有显著的负相关,差异有统计学意义(P<0.05),见表3。
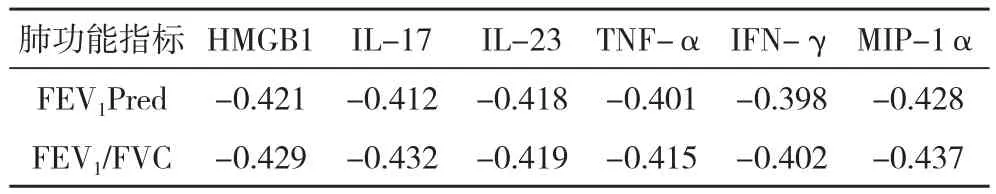
表3 肺功能指标与血清HMGB1、血清炎症细胞因子间的相关性分析
3 讨论
慢性阻塞性肺疾病发病机制尚未完全清楚,但其可能与炎症、感染、免疫平衡失调、氧化/抗氧化平衡失调,蛋白酶/抗蛋白酶平衡失调等多种因素相关。高迁移率族蛋白1是非组蛋白之一,具有多种核外生物学功能,且其具有促进炎症细胞因子分泌功能,在介导肺部炎症发生和发展中具有重要的意义。相关研究显示慢性阻塞性肺疾病患者肺泡灌洗液HMGB1表达明显增高[5]。动物实验均证实COPD大鼠支气管上皮细胞HMGB1表达明显上调,且其呼吸道、肺血管呈慢性炎症的病理改变[6]。刘仁杰研究证实,IL-17、IL-23是呼吸道炎症的生物学标记物之一,其中AECOPD患者血清IL-17、IL-23明显高于健康对照组,且AECOPD患者外周血中性粒细胞比例明显增高[7]。因此,血清IL-17、IL-23与外周血中性粒细胞比例具有明显的线性相关。TNF-α具有趋化中性粒细胞、单核细胞,合成、释放和活化炎症细胞因子的功能,促进炎症反应的发生[8]。干扰素-γ(IFN-γ)是特异性炎症细胞因子和辅助性T细胞分泌的细胞调节性多肽,IFN-γ通过刺激血管内皮细胞、单核细胞、巨噬细胞和中性粒细胞分泌炎症细胞因子、蛋白和介质,共同参与炎症反应过程。研究发现,AECOPD大鼠血清、肺组织IFN-γ含量明显增高[9]。MIP-1α具有诱导机体产生并促进中性粒细胞浸润发生,其与血管内皮活动程度紧密相关,MIP-1α含量与COPD病情程度具有紧密的相关性[10]。因此,血清HMGB1与炎症细胞因子如:IL-17、IL-23、TNF-α、IFN-γ、MIP-1α对COPD发生和发展具有重要的意义,但关于上述指标与AECOPD患者肺功能异常的关系研究甚少。
本研究结果显示,AECOPD和SCOPD患者血清HMGB1、IL-17、IL-23、TNF-α、IFN-γ、MIP-1α均明显高于SCOPD患者和健康体检者,其中AECOPD上述指标的增高程度较为明显,研究揭示了COPD患者普遍存在血清HMGB1和炎症细胞因子水平增高现象,其中随着病情严重程度的改变,上述指标即发生一定程度的改变,病情较为严重的AECOPD患者增高程度更为显著,与相关研究表明结果相一致[11-12]。AECOPD血清HMGB1和炎症细胞因子显著改变主要与呼吸道炎症程度有关,此外,感染是导致AECOPD发病的主要原因之一,感染刺激下促进了炎症细胞因子和高迁移率族蛋白1水平的增高。AECOPD患者FEV1Pred,FEV1/FVC等肺功能指标明显降低,而健康体检者肺功能指标处于正常范围,且明显高于COPD患者,经Pearson相关性分析发现,血清HMGB1和炎症细胞因子水平与肺功能具有显著的负相关。炎症细胞因子和HMGB1共同作用下导致呼吸道、肺部血管的病理改变,其中上述指标水平异常程度越明显,肺组织受损程度越显著,肺功能异常程度越明显。
综上所述,血清HMGB1与炎症细胞因子在AECOPD患者中的显著性增高,其共同作用可能是导致AECOPD肺功能异常的主要原因之一。
[1]罗红艳,兰小梅,曹丽,等.慢性阻塞性肺疾病患者早期肾损害的生物标志物评价[J].宁夏医科大学学报,2013,35(6):626-630.
[2]梁秋菊,王锦鸿.血清炎性指标和肺功能与慢性阻塞性肺病患者病情分级的相关性[J].中国老年学杂志,2014,44(12):541-545.
[3]程哲,康燕,吴秋歌,等.HMGB1在支气管哮喘和慢性阻塞性肺疾病患者中的表达及其意义[J].中华医学杂志,2011,91(42):2981-2984.
[4]符丹丹,欧阳瑶,薛令合.不同治疗方案对慢性阻塞性肺疾病急性加重期铜绿假单胞菌感染的疗效分析[J].中华医院感染学杂志,2014,24(12):2972-2973.
[5]杨晓敏,杨华.慢性阻塞性肺疾病患者肺组织和血清高迁移率族蛋白 B1 的表达[J].实用医学杂志,2013,29(18):3009-3011.
[6]王昌明,蒋明,王会娟,等.HMGB1表达水平与慢性阻塞性肺病大鼠模型气道,肺血管重构的关系及其临床意义[J].重庆医科大学学报,2012,37(2):114-117.
[7]刘仁杰,万毅新,王晓平,等.慢性阻塞性肺疾病患者血清IL-17、IL-23水平及临床意义[J].重庆医科大学学报,2011,36(8):976-979.
[8] Dan Jin,Jun Sun,Jing Huang,et al.TNF-α reduces gos2 expression and stimulates lipolysis through PPAR-γ inhibition in 3T3-L1 adipocytes[J].Cytokine,2014,69(2):196-205.
[9] Namrata Singh,Debasish Bhattacharyya.Collagenases in an ether extract of bacterial metabolites used as an immunostimulator induces TNF-α and IFN-γ[J].International Immunopharmacology,2014,23(1):211-221.
[10] Tang S K,Knobloch R A,Maucksch C,et al.Redirection of doublecortin-positive cell migration by over-expression of the chemokines MCP-1, MIP-1α and GRO-α in the adult rat brain[J].Neuroscience,2014,260(28):240-248.
[11]王成阳,刘向国,彭青和,等.慢性阻塞性肺疾病的炎症反应与Foxp3、T-bet、GATA3 表达失衡有关[J].细胞与分子免疫学杂志,2014,26(7):704-707.
[12]乔云兰,梅晓冬.高迁移率族蛋白B1在香烟诱导的慢性阻塞性肺疾病模型大鼠肺部的表达[J].安徽医科大学学报,2012,47(1):9-12.
