急性冠脉综合征患者氯吡格雷抵抗的相关影响因素分析
2014-09-15郭瑞琦吴迪周艳秋朱琳王婷婷秦雪源屈正
郭瑞琦 吴迪 周艳秋 朱琳 王婷婷 秦雪源 屈正
药物与临床
急性冠脉综合征患者氯吡格雷抵抗的相关影响因素分析
郭瑞琦 吴迪 周艳秋 朱琳 王婷婷 秦雪源 屈正
目的分析氯吡格雷抵抗的相关影响因素,观察氯吡格雷抵抗和心血管事件之间的相关性。方法选取欲行冠状动脉造影检查的119例急性冠脉综合征(ACS)患者,于术前24 h内未使用及使用氯吡格雷治疗7 d后采集肘静脉血,进行血小板聚集率(PA)检测。根据测算的PA值分为氯吡格雷抵抗(CR)组和非氯吡格雷抵抗(NCR)组,分析CR的影响因素。随访3个月,观察心血管事件和CR之间的相关性。结果119例ACS患者中,氯吡格雷抵抗(CR)组32例(26.9%),非氯吡格雷抵抗(NCR)组87例(73.1%),氯吡格雷抵抗发生率为26.9%。合并糖尿病的ACS患者组CR的发生率较高,为59.4%,非糖尿病ACS患者CR的发生率较低,为32.2%(P<0.01),置入2枚以上支架组CR的发生率较NCR组高(43.8%比8.0%,P<0.05)。CR组服药前基础的血小板聚集率为38.22±8.22,与NCR组血小板聚集率53.95±9.42比较差异有统计学意义(P<0.05)。3个月后随访主要心血管事件可以看出,CR组心血管事件的发生率较NCR组高(12.5%比1.1%),两者比较差异有统计学意义(P<0.05)。结论ACS患者氯吡格雷抵抗的发生率较高,同时影响临床抗血小板治疗的效果。糖尿病人群更易发生氯吡格雷抵抗。另外,置入支架数的增多使患氯吡格雷抵抗的危险性增加。氯吡格雷抵抗影响患者的预后,与心血管事件的发生有很大的相关性。
急性冠脉综合征; 血小板聚集率; 氯吡格雷抵抗; 影响因素
血小板在动脉粥样硬化的发病机制中扮演重要角色。血小板的活化、聚集,粥样硬化病变及凝血系统等的参与是构成急性冠脉综合征(ACS)的主要病理生理机制。目前抗血小板治疗已经成为ACS治疗的核心内容,主要的抗血小板制剂包括阿司匹林、氯吡格雷、Ⅱb/Ⅲa受体拮抗剂。氯吡格雷为ADP受体拮抗剂的代表药物,对ACS的治疗意义重大,尤其对冠脉介入术(PCI)后患者。但是,即使服用氯吡格雷,仍会发生再发缺血事件,因此,提出了氯吡格雷抵抗(CR)的概念。CR被认为是导致支架内血栓及再发缺血事件的罪魁祸首,并且增加了围手术期的发病率和死亡率[1]。所以,对CR发生情况及相关影响因素的研究,有重要的临床意义[2,3]。本研究旨在探讨与氯吡格雷抵抗发生的相关因素,尤其是与糖尿病、支架置入数、不稳定型心绞痛疾病类型之间的关系,为临床抗血小板个体化治疗提供依据。
1 对象与方法
1.1 研究对象 依据2011 ACC/AHA相关指南,选取2012年3月至2013年3月在北京煤炭总医院心脏中心及民航总医院心内科被确诊为ACS的患者。排除标准:对氯吡格雷过敏或不耐受者;有急、慢性血液系统疾病及自身免疫性疾病者;有出血倾向,凝血酶原时间(PT)超过对照1.5倍以上;血小板(Plt)数量异常,血小板<100×109/L 或>300×109/L;同时使用抗凝药物及非研究抗血小板聚集药物者;存在严重肝肾功能损害者。
1.2 试剂与仪器 主要试剂:20 μmol/L二磷酸腺苷(ADP)(美国Biopool公司)。主要仪器:血小板聚集测试仪SC-2000(北京塞科希德科技发展有限公司),LDZ5-2低速自动平衡离心机(北京医用离心机厂),BC3000PLUS全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)。
1.3 资料收集 记录患者基本资料如姓名、性别、年龄、吸烟史、饮酒史,既往病史如高脂血症、糖尿病、高血压、胃溃疡及出血史等,初步诊断情况及使用药物情况。
1.4 方法
1.4.1 分组 记录24 h内抽血测得的血常规、血生化、肝肾功能等血液学指标,24 h内和术后7 d所测血小板聚集率(PA)。根据△PA结果将入选研究对象分为两组,A组为氯吡格雷抵抗(CR)组,B组为非氯吡格雷抵抗(NCR)组。根据A、B两组研究对象的基本资料及血液学指标,分析CR的影响因素。随访PCI术后3个月内复发的临床缺血事件情况。
1.4.2 比浊法测量血小板聚集率(PA) 制备富血小板血浆。使用全自动血液细胞分析仪计数血小板,将富血小板血浆调整至250×109/L,检测血小板聚集率。
1.5 氯吡格雷抵抗定义 24 h内按照前述标本采集方法测得的血小板聚集率(PA)为基础血小板聚集率(bPA),减去术后7 d测得的血小板聚集率,则为△PA,根据氯吡格雷抵抗(CR)的定义,△PA≤10%为CR。
1.6 统计学方法 使用SPSS 13.0进行统计分析。计量资料用±s描述,两组间比较采用t检验,多组间比较采用方差分析,非正态分布资料采用非参数检验,计数资料比较应用卡方检验。相关分析采用二分变量和Spearman相关分析,多因素分析采用多元线性回归分析和logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 氯吡格雷抵抗的发生率 入选的119例ACS患者中,基础血小板聚集率与服药后7 d所测血小板聚集率差值≤10%者32例(26.9%),为氯吡格雷抵抗组;血小板聚集率差值>10%者87例(73.1%),为非氯吡格雷抵抗组,氯吡格雷抵抗发生率为26.9%。
2.2 氯吡格雷抵抗的影响因素
2.2.1 患者一般资料 根据研究入选标准,入选患者共 119例,平均年龄(64.29±11.72)岁,其中男性60例,平均年龄(62.47±12.20)岁,女性 59例,平均年龄(66.15±11.01)岁。氯吡格雷抵抗组(CR组)平均年龄(62.25±13.00)岁,其中男性 17例(53.1%),女性15例(46.9%);非氯吡格雷抵抗组(NCR组)平均年龄(65.05±11.20)岁,其中男性 43例(49.4%),女性44例(50.6%),两组相比差异无统计学意义。CR组患者糖尿病的发生率较高,为59.4%,非CR组患者糖尿病发生率为32.2%(P<0.01)。两组年龄、性别、吸烟史、高血压、卒中史、胃病史等情况基本一致(P>0.05)。具体统计数据见表1。
2.2.2 治疗前后临床情况比较 实验室检查指标提示:血红蛋白(Hb)、白细胞(WBC)、中性粒细胞计数、血小板(Plt)、TC、TG、LDL-C、HDL-C、BUN、Cr、AST、CRP、PT、APTT 等氯吡格雷抵抗组与非氯吡格雷抵抗组之间差异无统计学意义(P>0.05)。见表2。
2.2.3 疾病类型、周围动脉硬化情况及氯吡格雷抵抗的发生率 疾病类型、周围动脉硬化情况两组比较差异无统计学意义;置入2枚以上支架组氯吡格雷抵抗的发生率较非氯吡格雷抵抗组高(43.8%比8.0%),差异有统计学意义(P<0.05)。见表 3。
2.2.4 合并用药情况 临床合并用药包括ACEI、ARB、CCB、B-blocker、Statin、硝酸脂类药物、PPI及利尿剂,两组比较差异无统计学意义。见表4。
2.3 治疗前、后血小板聚集率的变化 119例ACS患者,服用CPG后血小板聚集率明显降低(治疗前为 53.95±9.42,治疗后为 16.25±7.46,P<0.01)。治疗前后血小板聚集率的变化见表5。服药前,CR组基础血小板聚集率为53.95±9.42,与NCR组血小板聚集率38.22±8.22比较差异有统计学意义(P<0.05)。服药后,CR组的血小板聚集率高于NCR组,两者差异有统计学意义。
表1 两组患者的一般资料比较[(±s),例数及百分率(%)]

表1 两组患者的一般资料比较[(±s),例数及百分率(%)]
组别 例数 年龄(岁) 男性 女性 吸烟史 高血压史 糖尿病史 卒中史 胃病史CR 组 32 62.25±13.00 17(53.0) 15(47.0) 13(40.0) 20(62.0) 19(59.0) 3(9.3) 1(3.1)NCR 组 87 65.05±11.20 43(49.0) 44(51.0) 39(45.0) 54(62.0) 28(32.0) 11(13.0) 5(5.7)合计 119 64.29±11.72 60(50.5) 59(49.5) 52(44.0) 74(62.0) 47(39.0) 14(11.8) 6(5.0)P值 0.451 0.837 0.825 0.682 0.966 0.007 0.624 0.562
表2 两组实验室指标比较(±s)
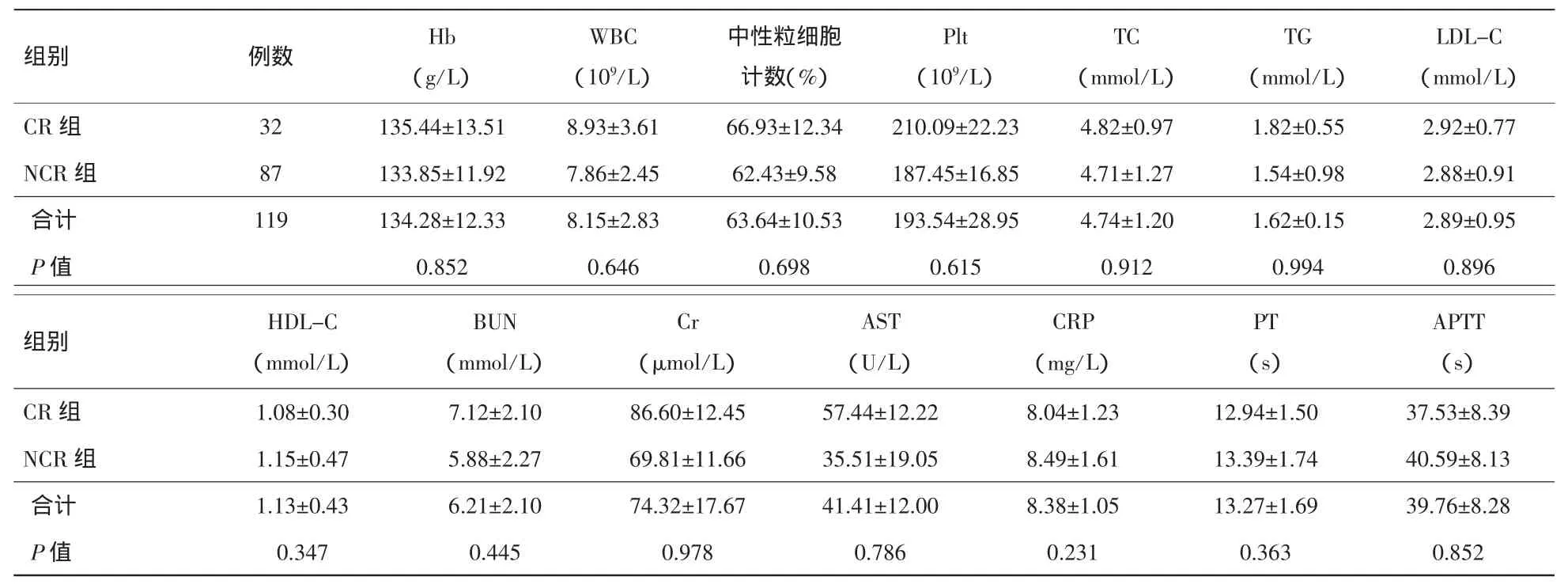
表2 两组实验室指标比较(±s)
LDL-C(mmol/L)CR 组 32 135.44±13.51 8.93±3.61 66.93±12.34 210.09±22.23 4.82±0.97 1.82±0.55 2.92±0.77 NCR 组 87 133.85±11.92 7.86±2.45 62.43±9.58 187.45±16.85 4.71±1.27 1.54±0.98 2.88±0.91合计 119 134.28±12.33 8.15±2.83 63.64±10.53 193.54±28.95 4.74±1.20 1.62±0.15 2.89±0.95 P值 0.852 0.646 0.698 0.615 0.912 0.994 0.896组别 例数Hb(g/L)WBC(109/L)中性粒细胞计数(%)Plt(109/L)TC(mmol/L)TG(mmol/L)APTT(s)CR 组 1.08±0.30 7.12±2.10 86.60±12.45 57.44±12.22 8.04±1.23 12.94±1.50 37.53±8.39 NCR 组 1.15±0.47 5.88±2.27 69.81±11.66 35.51±19.05 8.49±1.61 13.39±1.74 40.59±8.13合计 1.13±0.43 6.21±2.10 74.32±17.67 41.41±12.00 8.38±1.05 13.27±1.69 39.76±8.28 P值 0.347 0.445 0.978 0.786 0.231 0.363 0.852组别HDL-C(mmol/L)BUN(mmol/L)Cr(μmol/L)AST(U/L)CRP(mg/L)PT(s)

表3 两组疾病类型比较(例)

表4 两组临床用药情况[例数及百分率(%)]
表5 治疗前、后血小板聚集率的变化(±s)

表5 治疗前、后血小板聚集率的变化(±s)
组别 例数 基础血小板聚集率 治疗后血小板聚集率CR 组 32 38.22±8.22 34.88±8.28 NCR 组 87 53.95±9.42 16.30±7.57 P值 <0.05 <0.05
2.4 Logisitic回归分析 将可能与氯吡格雷抵抗相关的性别、吸烟、血脂、糖尿病及用药情况,如PPI类、Statin等,以及临床诊断、周围动脉情况、置入支架情况作为独立变量,采用多重变量逐步Logisitic回归对前述因素进行分析。结果显示,服药前基础血小板聚集率对氯吡格雷抵抗有显著影响(P=0.001),是否合并糖尿病对氯吡格雷抵抗也有重要影响(P=0.005)。见表6。
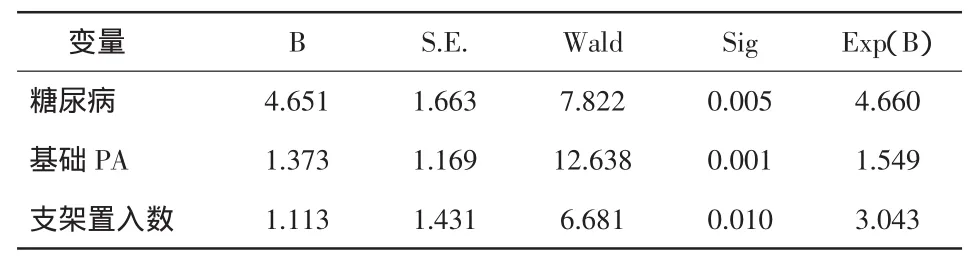
表6 氯吡格雷抵抗Logisitic回归分析结果
2.5 随访情况 3个月后随访主要心血管事件(包括再发心绞痛、心肌梗死、死亡等),CR组心血管事件的发生率较NCR组高(12.5%比1.1%),两者比较差异有统计学意义(P<0.05)。见表7。

表7 3个月后随访心血管事件情况(例)
3 讨论
本研究为前瞻性病例对照研究,研究了与氯吡格雷抵抗相关的多因素之间的关系。“氯吡格雷抵抗”目前无统一定义,其生化依据为不能抑制二磷酸腺苷(ADP)诱导的血小板激活,临床表现为不能预防再发血栓事件[4]。虽然描述的形式多种多样,但是它主要指患者对于氯吡格雷治疗的低反应,从而增强了缺血事件的风险,其生化依据为不能抑制二磷酸腺苷(ADP)诱导的血小板激活,临床表现为不能预防再发血栓事件。关于氯吡格雷抵抗率的报道不一(4%~30%)。Frere等[5]报道,22%的患者表现为氯吡格雷无反应,32%的患者表现为低反应,47%的患者表现为正常反应。CR可作为临床预后不良的先兆,尤其是进行心脏介入治疗的患者[6]。临床上CR发生的原因可分为内源性和外源性。内源性包括基因多态性、基础代谢水平及血小板激活状态等,其中遗传因素可通过影响P450系统酶活性或血小板受体构型而发挥作用。多元分析表明,CYP2C19无效编码基因是导致氯吡格雷治疗预后不良的重要因素之一,且患者携带的无功能基因数目与治疗后高血小板活性呈正相关[7]。因此,导致CR的原因是多方面的,个体差异是导致氯吡格雷抵抗的重要原因。目前已经能够常规地应用不同的P450基因进行评估新药在临床试验中的疗效,并且以P450基因型为基础走出个体化的第一步,有待进一步探索、研究[8]。
糖尿病的高血糖、胰岛素抵抗和血脂异常等代谢异常往往可以导致血小板黏附、活化和聚集活性增强;此外内皮细胞功能异常、纤溶异常和凝血因子活性增高导致高凝状态,上述因素均可降低抗血小板药物的反应性[9]。氯吡格雷通过选择性地抑制ADP与受体的结合,以及ADP介导的血小板糖蛋Ⅱb/Ⅲa复合物的活化而抑制血小板的聚集。有研究显示,糖尿病患者氯吡格雷对血小板活性抑制作用低于非糖尿病患者[10]。本试验结果也证实,糖尿病患者氯吡格雷抵抗的发生明显高于非糖尿病患者(59.4%比32.2%,P<0.05)。其机制主要与以下因素有关:药物吸收减少,药物前体转化为活性成分减少,药物清除加速和血小板清除加快。P2Y12受体基因的多态性导致P2Y12表达增多,循环中ADP数量增加,并上调其他血小板活化途径,最终影响氯吡格雷的反应性[11,12]。此外,ADP暴露增加、脂质代谢异常导致血小板膜结构改变,蛋白质糖基化增加,降低药物的作用靶点也是氯吡格雷抵抗的可能机制。通过基因检测发现,CYP2C19基因弱代谢型出现氯吡格雷抵抗的概率高达82.4%[13]。糖尿病患者CYP2C19基因的多态性与氯吡格雷抵抗的发生具有高度的相关性[13]。临床中应提高对糖尿病患者抗血小板药物抵抗问题的警惕性,置入DES后的高危患者应行血小板功能监测,根据结果调整抗血小板药物剂量,必要时可考虑联用其他抗栓药物,做到个体化用药,降低血栓事件的风险[14]。
Soffer等[15]研究发现,心绞痛危险程度与血小板聚集抑制程度密切相关,在不稳定型心绞痛分类中,Braunwald 2级和3级的氯吡格雷抵抗发生率要显著高于Braunwald 1级患者。因此,似乎不稳定型心绞痛中,根据Braunwald分级,级数越高,氯吡格雷抵抗的发生率也就越高。但也有研究并未发现其中的差异。因为ACS早期或者冠脉介入术后,血小板处于激活状态,因此发生氯吡格雷抵抗的概率也较其他类型冠脉疾病高。
本试验结果提示,置入2枚以上支架亚组的患者,氯吡格雷抵抗发生率较非氯吡格雷抵抗者高。Matetzsky等研究显示,40%的CR患者发生了缺血性心血管事件,而其他患者仅为6.7%;Muller等报道2例(105例患者中)支架内亚急性血栓形成均为氯吡格雷抵抗患者[16]。因此,鉴于氯吡格雷抵抗的高发生率及高危害性,对于氯吡格雷抵抗与不良临床事件之间的相关性急需更多大样本研究予以明确,对于指导临床实践有更重要的指导意义。
本研究通过测定血小板聚集率,明确了氯吡格雷抵抗与临床缺血事件、患者的一般生化指标、合并用药、疾病类型以及合并症之间的关系。从国内外研究可见CR发生率较高,尤其是支架术后患者亚急性血栓形成导致的后果可能是致命性的,因此对支架术后阿司匹林联合氯吡格雷的标准治疗具有一定的挑战性,由此提出个体化用药的概念。但本研究样本量较小,需要进一步扩大样本量验证,并为临床用药提供循证支持。
[1]Mason PJ,Jacobs AK,Freedman JE.Aspirin resistance and atherothrombotic disease.J Am Coll Cardiol,2005,46:986-993.
[2]Gurbel PA,Bliden KP,Hiatt BL,et al.Clopidogrel for oronary stenting:response variability,drug resistance,nd the effect of pretreatmentplateletreactivity.Circulation,2003,107:2908-2913.
[3]Angiolillo DJ,Fernandez-Ortiz A,Bernardo E,et al.Identification of low responders to a 300 mg clopidogrel loading dose in patients undergoing coronary stenting.Thromb Res,2005,115:101-108.
[4]朱琳,王明晓.氯吡格雷抵抗的研究进展.中国心血管病研究,2010,8:388-390.
[5]Frere C,Cuisset T,Morange PE.Eeffect of cytochrome P450 Polymorphisms on platelet reactivity after treatment with clopidogrel in acute coronary syndorome.Am J Cardiol,2008,101:1088-1093.
[6]Matetzky S,Shenkman B,Guetta V,et al.Clopidogrel resistance is associated with increased risk of recurrent atherothrombotic events in patients with acute myocardial infarction.Circulation,2004,109:3171-3175.
[7]赵清,张抒扬.氯吡格雷抵抗的早期诊断及临床对策.中华临床医师杂志(电子版),2012,6:423-425.
[8]马依彤,谢翔.基因多态性与抗血小板治疗.中华心血管病杂志,2011,39:674-676.
[9]刘先仕,李爱霞,张鹏.2型糖尿病对阿司匹林和氯吡格雷双联抗血小板药物治疗效应的分析.心肺血管杂志,2012,31:584-587.
[10]Hall HM,Banerjee S,McGuire DK.Variability of clopidogrel response in patients with type 2 diabetes mellitus.Diab Vasc Dis Res,2011,8:245-250.
[11]Mathewkutty S,McGuire DK.Platelet perturbations in diabetes:Implicationsforcardiovasculardisease risk and treatment.Expert Rev Cardiovasc Ther,2009,7:541-549.
[12] FerreiroJL, Gomez-HospitalJA, AngiolilloDJ.Platelet abnormalities in diabetes mellitus.Diab Vasc Dis Res,2010,7:251-259.
[13]邸春霞,华宁,林乐健,等.老年糖尿病患者CYP2C19基因多态性与氯吡格雷抵抗的相关性.中国心血管病研究,2012,10:884-887.
[14] Smock KJ, Saunders PJ, Rodgem GM, et al.Laboratory evaluation of clopidogrel responsiveness by platelet function and genetic methods.Am J Hematol,2011,86:1032-1034.
[15]Soffer D,Moussa I,Harjai KJ,et al.Impact of angina class on inhibition of platelet aggregation following clopidogrel loading in patients undergoing coronary intervention:do we need more aggregation dosing regimens in unstable angina?Catheter Cardiovasc Interv,2003,59:21.
[16]郭志福,郑兴,秦永文.药物洗脱支架时代一个重要问题.中华心血管病杂志,2006,34:378-379.
The influential factors of clopidogrel resistance in patients with acute coronary syndrome
GUO Rui-qi*,WU Di,ZHOU Yan-qiu,et al.*Graduate School of Hebei United University,Tangshan 063000,China
WU Di,E-mail:wudimd07@sohu.com
ObjectiveTo analyze the probable influential factors of clopidogrel resistance in patients with ACS and investigate the relationship between clopidogrel resistance and the recurrence clinical ischemic.Methods119 patients with acute coronary syndrome were selected.All of the subjects were measured the PA(platelet aggregation)before they had taken clopidogrel and 7 days later,then they were divided into two groups:clopidogrel resistance(CR)group and non-clopidogrel resistance group.Recording all messages about the patients include age,gender,laboratory examinations and so on.All data were analyzed by SPSS software,version 16.0.A probability value of P<0.05 was considered statistically significant.ResultsAdmissions (CR events)were 26.9%,NCR events were 73.1%.⑴The rate of clopidogrel resistance in diabetic group was significantly higher than in nodiabetic group(59.4%vs 32.2%,P<0.05).⑵The level of basic platelet aggregation in clopidogrel resistance group(38.22±8.22)was lower than non-clopidogrel resistance group(53.95±9.42)(P<0.05).⑶Logistic stepwise regression analysis showed that the baseline level of platelet aggregation was independent predictors for developing clopidogrel resistance(P=0.001). ⑷There were significant differences between two groups in the MACE at 3-month follow-up(12.5%vs 1.1%,P=0.006).Conclusion⑴The rate of DM in clopidogrel resistance group is higher than non-clopidogrel resistance group.⑵There are significant differences between the two groups at the level of basicplatelet aggregation which is independent predictors for developing clopidogrel resistance.⑶Clopidogrel resistance group has high rate in the MACE at 3-month follow-up.
Acute coronary syndrome; Platelet aggregation; Clopidogrel resistance; Influential factors
063000 唐山市,河北联合大学研究生院(郭瑞琦);北京市煤炭总医院心脏中心(吴迪、朱琳、王婷婷、秦雪源、屈正),中心实验室(周艳秋)
吴迪,E-mail:wudimd07@sohu.com
10.3969/j.issn.1672-5301.2014.01.024
R543.2
A
1672-5301(2014)01-0078-05
2013-11-12)
