酵母菌对活性艳红X-3B的吸附研究
2014-09-14王银玲张丽芳
王银玲,张丽芳
(沈阳理工大学 环境与化学工程学院,辽宁 沈阳 110159)
酵母菌对活性艳红X-3B的吸附研究
王银玲,张丽芳
(沈阳理工大学 环境与化学工程学院,辽宁 沈阳 110159)
以酵母菌菌体作为生物吸附剂对水中阴离子偶氮染料活性艳红X-3B进行生物吸附研究。讨论了酵母菌培养时间、投加量、溶液初始pH值和吸附时间等因素对菌体吸附活性艳红X-3B的影响,探讨了菌体吸附染料的动力学规律,利用FTIR技术分析了酵母菌吸附活性艳红X-3B的吸附作用。结果表明,培养时间为 3d 时,酵母菌对染料吸附能力最强。当溶液pH值为2时,菌体对活性艳红X-3B吸附效果较好,酵母菌吸附活性艳红X-3B过程符合准二级动力方程。通过对酵母菌红外光谱分析,发现对活性艳红X-3B吸附过程中菌体的氨基等基团起主要作用。
生物吸附;酵母菌;活性艳红X-3B;吸附动力学;红外光谱
据不完全统计,我国每年的印染废水排放量约为300~400万吨,约占全国工业废水排放量的6%,印染厂每加工一百米纺织品,产生的废水量为3~5m3,每排放1吨印染废水,能造成20吨水体污染,由此造成的水体环境破环和经济损失是不可估计的[1-2]。在目前所有染料中,偶氮染料约有3000种,也是工业生产中实际使用量最大的一类[3-4]。氮染料具有牢固的着色度,其具有抗光、抗热、抗氧化等能力,也因此引起了一系列的环境问题,最直接的污染是色度污染,影响水中植物光合作用和呼吸作用,致使底层动、植物得不到生长所必须的条件,对水生生态系统的生物链造成破坏,从而影响整个水生生态系统的多样性[5-6]。目前,常用的处理染料废水的方法有活性炭、沸石吸附法、磁分离法、电化学法、生物降解法等[7],这些方法相对于生物吸附法存在运行费用高、易造成二次污染等问题,而生物吸附法具有不受外界有毒物质和营养供应干扰等特点[8]。
目前,应用酵母菌作为生物吸附剂多集中在对重金属吸附研究方面,而对酵母菌吸附染料的报道较少。本文利用酵母菌为生物吸附剂,考察在不同条件下,如菌体培养时间、投加量、pH值、吸附时间等,对酵母菌吸附水中活性艳红X-3B的影响,在此基础上进一步进行动力学研究,初步探讨菌体对活性艳红X-3B的吸附机理。
1 实验
1.1 染料废水
实验所用染料废水为活性艳红X-3B(偶氮类;λmax= 538 nm)模拟染料废水。
1.2 生物吸附剂的制备
实验用的生物吸附剂为酵母菌(Saccharomyce scerevisiae)。于无菌状态下,用接种环轻轻刮取固体培养基表面上的酵母菌菌落,将其移入一定量的黄豆芽液体培养基中,充分振荡,用8层无菌纱布封口,30℃,140r/min,恒温空气浴振荡器中振荡培养。培养一定时间后取出菌体,121℃高压蒸汽灭菌15~20 min,使用时,离心分离菌体,洗涤,洗涤离心菌体重复多次,4℃保藏备用。另取定量的酵母菌菌体在60℃下烘干,测定菌体干湿比。
1.3 吸附实验
配制100mg/L活性艳红X-3B溶液、装液量为50mL,投加一定量酵母菌,在设定温度下进行恒温振荡吸附,达到吸附平衡后,取上清液,测定溶液的吸光度,计算残余活性艳红X-3B的浓度。
2 结果与讨论
2.1 酵母菌的形态特征
对酵母菌活菌体、灭活后菌体进行显微镜(放大400倍)观察及进行数码拍照,结果如图1所示。
由图1a、1b可知,在生物显微镜放大400倍下,活酵母菌与灭活酵母菌在形态上差别微弱,均为椭圆形。但是灭活菌体相较于原菌体形态更小,这可能是由于在灭活的过程中,菌体细胞壁局部产生空洞破裂,造成菌体水分丢失,使细胞内各种基团如:羧基、羟基、氨基等,充分暴露在菌体表面,有利于吸附染料。

图1 酵母菌生物显微镜观察形貌
2.2 培养时间的影响
为考察培养时间对菌体生长量和吸附染料的影响,实验研究不同培养时间酵母菌菌体的生长情况和对吸附量的影响,实验结果分别见图2和图3。
微生物刚刚接种到培养基时,其代谢系统需要适应新的环境,同时要合成酶、辅酶和其他代谢中间代谢产物等。由图2可知,实验用的酵母菌所需停滞期非常短,其在一天之内就可以进入对数期,酵母菌质量迅速增加,在第3d生长量达到最大为3.94g/L(干重)。继续增加培养时间,随着营养物质的不断消耗,菌体所产生有害代谢产物的增加,菌体开始进入稳定期,菌体生长速度下降,死亡率大于繁殖率,活菌数量下降,从第4d开始,菌体生长量不断下降,到第8d为3.04g/L,下降了22.84%,这是由于培养基中的营养物质逐渐消耗殆尽,菌体由于缺乏营养而利用自身贮存的物质进行内源呼吸而自我溶解。实验还考察了培养时间对菌体吸附活性艳红X-3B的影响,结果见图3。

图2 培养时间对生长量的影响

图3 培养时间对吸附量的影响
由图3可知,在实验培养天数内,吸附量随着培养天数增加单调下降。培养时间为1d时,酵母菌对活性艳红X-3B吸附效果较好,吸附量为276.79mg/g,这说明在对数期内菌体最活跃,吸附能力最强,随着酵母菌的培养时间增加,酵母菌对活性艳红X-3B吸附量逐渐下降,当培养时间超过4d后的酵母菌对染料吸附量有所下降,5d后吸附量趋于稳定。虽然采用培养时间为1d的酵母菌对活性艳红X-3B的吸附能力略高于培养3d的酵母菌,当培养时间为3d时,酵母菌的生长量明显高于前2天。综合考虑,确定酵母菌的培养时间为3d。
2.3 菌体投加量对吸附的影响
为考察酵母菌投加量对吸附的影响,向染料溶液中分别投加0.075g/L、0.15g/L、0.225g/L、0.3g/L、0.375g/L、0.45g/L、0.525g/L、0.60g/L的酵母菌(干重),溶液pH值为2,吸附温度为30℃、恒温振荡器转速140r/min条件下,振荡吸附,实验结果如图4所示。

图4 酵母菌投加量对活性艳红X-3B吸附的影响
由图4知,随着酵母菌投加量的增加,酵母菌对活性艳红X-3B的去除率逐渐增大,当投加量超过0.375g/L时,去除率达到100%;同时,由图4可以看出,酵母菌对活性艳红X-3B吸附量是随着投加量增加而降低的,菌体投加量与其吸附量成反比。在染料浓度一定的前提下。随着投加量的增加,去除率升高,而吸附量逐渐减少。这是因为在投加量较低时,菌体上的结合位点得到全部利用达到饱和,因而吸附量较大,而当增加酵母菌投加量时,由于投加量较大,菌体上的结合位点尚未吸附饱和时,水中染料已被全部吸附,因而造成菌体对染料吸附量的大量减少。
2.4 初始pH值的影响
为考察溶液的pH值对吸附的影响,分别调节染料溶液的pH值为1、2、3、4、5、6、7、8、9、10,酵母菌投加量为0.3g/L(干重),吸附温度为30℃,转速为140r/min,恒温振荡吸附,实验结果如图5和表1所示。
由图5可知,当溶液初始pH值为1.0~2.0时,酵母菌对活性艳红X-3B去除率均较大,当pH值为2时,酵母菌对活性艳红X-3B去除率为80.72%。当溶液pH值超过2.0时,酵母菌对染料的去除率急剧下降,当pH值为6时,酵母菌对活性艳红X-3B去除率较低为30.49%,与pH值为2时去除率相比下降了50.23%。当pH值从8.0升高到10.0时,去除率极低,且变化不大。
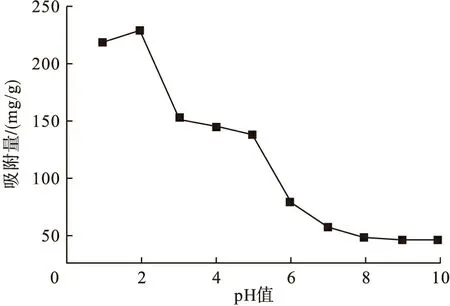
图5 pH值对吸附量的影响
实验用染料活性艳红X-3B均为阴离子染料,在溶液中带负电荷。而酵母菌表面具有很多官能团,如氨基、羧基、羟基、巯基和酰胺基等。酵母菌在强酸条件下吸附效果显著,是由于酵母菌菌体上的氨基等官能团在强酸条件下被质子化,使菌体带正电,因而容易与带负电荷的染料相互静电吸引而结合。而当pH值较高时,菌体上的羧基等官能团发生电离,使菌体带有大量负电荷,与带负电荷的染料相互排斥,因而此时菌体对染料的吸附量较低。由表1可知,当溶液初始pH值(即吸附前)较低时,吸附平衡后pH值都有所上升,这表明菌体在吸附过程中吸收溶液中的H+,菌体被质子化,带正电荷,因而有利于对阴离子染料的吸附。而当溶液初始pH值较高时,吸附平衡后pH值都有所下降,不利于吸附。这与图5实验结果相一致。

表1 活性艳红X-3B吸附前后溶液pH值变化
2.5 吸附时间的影响
为考察吸附时间对吸附的影响,改变吸附时间,在吸附体系温度分别为20℃、30℃、40℃,溶液pH值为2,酵母菌投加量为0.3g/L(干重),转速140r/min,振荡吸附,实验结果如图6所示。

图6 吸附时间对活性艳红X-3B吸附的影响
由图6可知,酵母菌对活性艳红X-3B吸附速度较快,当吸附时间为3min时,在20℃、30℃、40℃下,酵母菌对染料的去除率均超过80%以上,即达到总去除率的95%以上,此后酵母菌对染料的去除率缓慢增加,吸附时间在1h左右达到吸附平衡。
目前最常用的吸附动力学模型主要有两种,分别为Lagergren一级动力学模型和准二级动力学模型。Lagergren一级动力学模型的线性化形式为

(1)
准二级动力学模型的线性化形式为

(2)
式中:k1、k2为常数;qe为吸附平衡时吸附;qt为t时刻的吸附量。对实验数据进行拟合,拟合结果如表 2所示。
由表2可知,酵母菌对活性艳红X-3B吸附过程用准二级动力学拟合曲线相关性要远大于Lagergren一级动力学拟合曲线,R2值达到1.0000,估算的qcal理论值与实验值较为接近,随着温度的升高估算的qcal理论值随之增大,这与前面的吸附时间对染料吸附影响的实验相一致;而一级动力学方程R2值仅为0.67左右,相关性较差,说明准二级动力学模型更能很好地描述酵母菌对活性艳红X-3B的吸附过程。

表2 不同温度下动力学方程参数
2.6 红外光谱测定
实验分别对吸附染料前后的酵母菌的红外光谱进行分析。实验结果如图7、图8所示。

图7 灭活酵母菌光谱图

图8 酵母菌吸附活性艳红X-3B后红外光谱图

由图8可知,吸附活性艳红X-3B的酵母菌红外光谱谱峰没有明显的改变,只是漂移而没有出现新的伸缩振动峰,这表明菌体吸附染料后,自身的结构没有发生改变。
3 结论
(1)生物吸附剂酵母菌在液体培养基中振荡培养3d时,菌体对活性艳红X-3B的吸附性能较好。
(2)当溶液初始pH值为2时,菌体对染料的去除率较高。酵母菌对染料的去除率随着酵母菌投加量增加而升高,吸附量则随着投加量增加而下降。在实验温度20℃~40℃时,随着温度的升高,菌体对活性艳红X-3B的吸附量逐渐提高。对酵母菌吸附染料的吸附动力学研究表明,酵母菌吸附活性艳红X-3B过程符合准二级动力方程。
(3)通过对酵母菌吸附染料前后红外光谱分析,发现酵母菌菌体上的氨基等官能团对偶氮染料活性艳红X-3B吸附起主要作用。
[1]方继前.偶氮料微生物降解脱色研究[D].长沙:中南林业科技大学,2012:1-10.
[2]尹亮.混合菌群共培养对偶氮染料的协同脱色及降解的研究[D].广州:华南理工大学,2009:1-6.
[3]金若菲.偶氮染料脱色工程菌的特性及强化作用研究[D].大连:大连理工大学,2007:1-15.
[4]李春辉.水溶性阴离子偶氮染料的降解及其染色废水的循环利用[D].天津:天津工业大学,2004:2-7.
[5]王震文.一种降解偶氮染料细菌菌株的筛选、鉴定及其脱色条件与机理研究[D].扬州:扬州大学,2012:1-15.
[6]李国芳.偶氮染料降解菌的群落结构分析及其环境降解初步研究[D].哈尔滨:东北林业大学,2012:1-5.
[7]HuaYin,BaoyanHe,HuiPeng,et al.Removal of Cr(VI) and Ni(II)from aqueous solution by fused yeast:Study of cations release and biosorption mechanism[J].Journal of Hazardous Materials,2008,158:568-576.
[8]Mehdi Shirzad-Siboni,Alireza Khataee,Sang W.Joo.Kinetics and equilibrium studies of removal of an azo dye from aqueous solution by adsorption onto scallop[J].Journal of Industrial and Engineering Chemistry,2013,1373:6-10.
BiosorptionofReactiveBrilliantRedX-3BfromAqueousSolutionbyYeast
WANG Yinling,ZHANG Lifang
(Shenyang Ligong University,Shenyang 110159,China)
The biosorption of Brilliant Red X-3B from aqueous solution,using the yeast,was investigated in batch system.The azo dye biosorption on yeast was investigated with different parameters,such as cultivation time,biomass concentration,pH value,adsorptive time and biosorption kinetic.The interaction between functional groups of yeast and Brilliant Red X-3B was studied by FTIR.Results showed that cultivation time was 3 days and the biosorption process obeyed the quasi-second-order kinetic model.Analyzing the FTIR of yeast adsorped dye,it is discovered that NH2group plays a large role in the process of absorption.
biosorption;yeast;Reactive Brilliant Red X-3B;biosorption kinetic;FTIR
2013-11-17
王银玲(1984—),女,硕士研究生;通讯作者:张丽芳(1975—),女,副教授,博士,研究方向;污水处理和环境污染微生物治理.
1003-1251(2014)05-0042-06
X172
A
马金发)
