Tat-TTA1-PEG 共修饰明胶-硅氧烷纳米粒跨血脑屏障及对胶质瘤的靶向性研究
2014-09-14张龙胡洋林晓宁魏峰丰伟田新华
张龙,胡洋,林晓宁,魏峰,丰伟,田新华Δ
(1.厦门大学医学院,福建厦门361004;2.厦门大学附属中山医院,福建厦门361004)
Tat-TTA1-PEG 共修饰明胶-硅氧烷纳米粒跨血脑屏障及对胶质瘤的靶向性研究
张龙1,胡洋1,林晓宁2,魏峰2,丰伟2,田新华2Δ
(1.厦门大学医学院,福建厦门361004;2.厦门大学附属中山医院,福建厦门361004)
目的观察经Tat多肽,适配体TTA1,聚乙二醇(PEG)联合修饰的新型纳米载体明胶硅氧烷纳米粒子(gelatin-siloxane nanoparticles,GSNPs)跨血脑屏障及靶向到达胶质瘤的能力。方法通过两步溶胶-凝胶法合成GSNPs,然后在其表面依次修饰上PEG、TTA1、Tat,并以荧光染料Cy5.5-NHS标记。建立胶质瘤裸鼠原位模型20~25只,分为空白对照组,GSNPs组,PEG-GSNPs组,TTA1-PEG-GSNPs组,Tat-TTA1-PEG-GSNPs组。尾静脉注射各种修饰的纳米粒子,观察其在大鼠体内分布情况;将裸鼠处死后取脑、肝、脾,观察纳米粒子在各器官的分布。结果活体成像及统计分析结果显示TTA1-Tat-PEG-GSNPs在脑部的荧光强于Tat-PEG-GS NPs、PEG-GSNPs、GSNPs组,且在肿瘤部位的荧光强于脑内其他部位,而在肝脏脾脏的荧光弱于其他3组。结论TTA1-Tat-PEG-GS NPs能够逃逸内皮网状吞噬系统(reticuloe endothelin system,RES)的吞噬,还能跨过血脑屏障,而且对胶质瘤具有靶向性,是一种潜在的胶质瘤治疗基因及药物的靶向载体。
胶质瘤;纳米粒子;血脑屏障;靶向给药系统
胶质瘤为原发于脑部的恶性肿瘤,占了脑部肿瘤的80%,目前仍是最致命的癌症形式[1]。胶质瘤常呈浸润性生长,且多处于脑部重要结构,手术无法做到真正的彻底切除,极易复发,传统治疗采用手术切除大瘤体,术后采用放化疗等手段杀灭残存瘤细胞,但治疗效果及预后均欠佳。现今基因治疗正成为胶质瘤治疗的研究热点,但血脑屏障的存在限制了大部分基因载体及98%可用于胶质瘤治疗的药物进入脑到达胶质瘤部位[2],只有摩尔质量低于150 g/mol的亲水化合物和摩尔质量低于400 g/mol的疏水化合物能由被动扩散进入大脑[3],加上网状内皮系统(RES)和溶酶体对药物的吞噬降解及P-gp蛋白对药物的外排作用,使得治疗基因和药物很难到达肿瘤部位,严重影响治疗效果。且多数基因载体和化疗药物具有很大的不良反应,缺乏肿瘤靶向性,这使得人们急需一种载体来运载基因或药物到达肿瘤部位。
当前人们使用的载体主要分为病毒载体与非病毒载体,病毒载体主要用于基因治疗方面,具有很高的基因转染率,但其在存在的免疫原性,外源目的基因整合率不高、DNA装载量有限、宿主靶向特异性低和花费高[4],而且无法转运化疗药物进行胶质瘤的靶向性治疗,及其潜在的致癌性限制了其应用,特别是“杰辛格反应”事件后,其应用受到很大限制。目前人们所用的非病毒载体主要包括纳米载体和干细胞载体。干细胞载体对肿瘤具有较好的靶向迁移性及肿瘤反应性[5],但外源干细胞载体的潜在致瘤性、干细胞来源、外源基因的稳定表达等难题制约了干细胞载体在临床治疗中的应用。而纳米载体因其在血浆中不被降解,能够逃避内皮-网状系统的捕捉,且能够直接通过血脑屏障靶向肿瘤部位,而不用人工开放,并且能够穿过肿瘤基质屏障和肿瘤血管屏障且脑胶质瘤对纳米粒有EPR效应(选择性高通透性和滞留性)使其被动靶向胶质瘤部位[6],加之纳米载体较高的基因装载量,较低的细胞毒性,及其对药物和基因的保护作用,使其成为运载药物或基因到达胶质瘤肿瘤部位的理想载体。
本实验将通过两步溶胶-凝胶法合成GSNPs首先修饰上荧光染料Cy5.5-NHS,然后逐步修饰上延长载体体内循环时间的亲水性聚乙二醇(PEG)[7],可特异性与胶质瘤细胞高表达的肌腱蛋白C(TN-C)结合的适配体TTA1[8],具有增强纳米载体跨血脑屏障跨细胞膜能力的小分子多肽Tat[9],可避免网状-内皮系统(RES)吞噬作用。然后将得到的纳米粒子通过尾静脉分别注入载瘤裸鼠体内,通过活体成像仪定点观察纳米载体的体内分布,跨血脑屏障的能力以及对胶质瘤的靶向性。
1 材料与方法
1.1 材料
1.1.1 实验试剂 明胶购自美国BBI公司,3-(2,3-环氧丙氧)丙基三甲氧基硅烷(GPSM)与3-(三甲氧基硅烷)丙胺(APTMS)购自美国ACROSORGANICS公司。1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺(EDC),N-羟基琥珀酰亚胺(NHS),聚乙二醇(PEG)购自上海化学试剂有限公司。TTA1适配体,Tat多肽购自上海生工生物工程有限公司。Cy5.5-NHS购自上海西宝生物科技有限公司。DMEM高糖培养基和小牛血清购自美国Hyelone公司。大鼠C6胶质瘤细胞购于上海美轩生物科技有限公司。裸鼠购买于厦门大学动物实验中心,动物许可证号:SCXK(沪)2012-0002,所做动物实验均遵循《实验动物保护条例》有关内容。
1.1.2 主要实验仪器 Varian7T磁共振成像仪(美国Varian Ltd),小动物活体成像系统(美国剑桥科研仪器公司),粒径分析仪及ZETA电位分析仪(英国Malvern Instruments Ltd),透射电子显微镜(日本JEM公司)。
1.2 方法
1.2.1 材料的制备与表征 TTA1-Tat-PEG-GS的合成分为5个阶段:①通过两步溶胶凝胶法合成GSNPS,具体合成方法参考Yin等及Wang等方法[10]。②荧光染料Cy5.5-NHS修饰的GS的合成:提前1天冻干5mL GS,计算GS浓度,根据GS的量取适量Cy5.5-NHS溶于二甲基亚砜(DMSO)中使得Cy5.5-NHS的量与所取的GS表面氨基量1∶5,将得到的反应液与GSNPs(pH 7.5~8.0)溶液混合避光共振8 h后离心洗涤2遍(14000 r/min,20min,25℃)得到Cy5.5-NHS修饰的GSNPs。③连接PEG(PEG合成时已经修饰氨基和羧基修饰):将PEG与EDC、NHS分散于pH 7.5~8.0缓冲液中使得EDC∶NHS∶PEG为3∶3∶1,震荡反应4 h以活化PEG表面的羧基,将得到的反应液加入制备的荧光染料修饰的GSNPs溶液(pH 7.5~8.0)中使得-COOH(PEG):NH2(GS)为1∶4,避光共振4 h后离心(14000 r/min,20 min,25℃)洗涤2次,而后重新分散于pH 7.5~8.0缓冲液中得到PEG修饰的GSNPs。④TTA1-PEG-GSNPs的合成:在得到的PEG-GSNPs溶液中加入3-(2-吡啶二巯基)丙酸n-巯基琥珀酸亚胺酯(SPDP)使得SPDP∶PEG-GSNPs上PEG外端的氨基为0.5∶1。避光震荡反应0.5 h后离心(14000 r/min,20 min,25℃)洗涤2次而后重新分散于pH 7.5~8.0缓冲液中,加入DNA适配体TTA1(5′-CCTGCACTTGGCTTGGATTTCAGAAGGGAGACCC-3′)使得TTA1∶GSNPs为2.0 nmol∶1mg。震荡反应4 h后离心洗涤2遍(14000 r/min,20 min,25℃)即得到TTA1-PEG-GSNPs。⑤Tat-TTA1-PEG-GSNPs的合成:将得到的TTA1-PEG-GSNPs溶液离心后重悬与pH 7.5~8.0缓冲液中,在其中加入Tat使得Tat∶GS表面剩余氨基∶EDC∶NHS为0.3∶1∶3∶3,震荡反应5 h,离心洗涤(14000 r/min,20 min,25℃)2遍即得到Tat-TTA1-PEG-GSNPs。
将制备的的材料高速离心后重新分散于缓冲液中,用MALVERN Zetasizer Nano-ZS仪器测定其粒径和Zeta电位。透射电镜(TEM)观察其形态,分散度和粒径。
1.2.2 胶质瘤裸鼠模型的构建 取4~6周BALB/c裸鼠25只,雌雄不限,购买于厦门大学动物实验中心。动物饲养1周后在屏障环境内将麻醉后的裸鼠固定于立体定向仪上,常规消毒铺巾后在头顶正中沿正中线做一1 cm切口,然后在冠状缝下0.5 cm矢状缝右侧2 cm用牙科钻做一骨窗[11]。在立体定向仪的引导下将处于对数生长期的C6胶质瘤细胞(悬浮于无血清的DMEM培养基中,细胞数为106)5μL,用微量注射器20min接种于大脑尾状核。术后每天观察其行为改变并测量体质量,每周行MRI检测胶质瘤成型情况。
1.2.3 材料的体内分布及其跨血脑屏障靶向胶质瘤能力的评测 取已构建好的裸鼠原位胶质瘤模型25只,均分为空白对照组,GSNPs组,PEG-GSNPs组,TTA1-PEG-GSNPs组,TAat-TTA1-PEG-GSNPs组。分别经尾静脉注射Cy5.5-NHS标记的GSNPs,PEG-GSNPs,TTA1-PEG-GSNPs,Tat-TAA1-PEG-GSNPs,注射量为200μL。注射后分别于0.5、1、2、4 h通过活体成像仪定点观察纳米材料在载瘤动物体内的动态分布,4 h后于CO2处死箱内处死实验裸鼠,取脑、肝、脾,观察器官内纳米粒子分布并测量其荧光强度。
1.3 统计学方法 采用SPSS 1.9.0统计软件处理数据,正态计量资料以“±s”来表示,采用比较各样本均数的t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各种纳米材料的表征 TEM下PEG-GS NPs,TTA1-PEG-GSNPs,TAT-TTA1-PEG-GSNPs的照片见图1,可见PEG-GS NPs、TTA1-PEG-GS NPs、TAT-TTA1-PEG-GS NPs呈球形,粒径在80~100 nm之间。Zeta电位仪测量结果显示,GS表面修饰PEG和TTA1后表面电位由30 mV左右降至接近电中性,这是由于GS表面的氨基被消耗。血脑屏障在整体上表现为负电位[12],与TTA1-PEG-GSNPs相比经PEG、TTA1、Tat修饰的GSNPs表面电位有所增加,这有利于纳米载体运载质粒并提高通过其血脑屏障的能力。

图1 TEM下各种纳米粒子表征图片Fig.1 Pictures of each NPs under TEM

表1 4种纳米粒子的粒径和Zeta电位(n=22)Tab.1 The size and Zeta potential of four NPs(n=22)
2.2 MRI增强扫描观察结果 胶质瘤移植手术中裸鼠初期因麻醉后低温死亡2只,注意保温后均成活。裸鼠术后1 d内逐步恢复活动和饮食,2 d后恢复正常,术后1周内无明显行为改变,1周后逐步出现精神萎靡,嗜睡,体重下降反应迟钝等症状,2周后出现眼球突出,偏瘫等症状,体质量下降明显,3周后明显恶病质,所有手术裸鼠均于4周内陆续死亡。由胶质瘤原位模型构建后连续3周MRIT2加权象的图片(见图2),可见模型构建1周后微量注射器穿刺部位(定位于尾状核)有环形高密度影,穿刺部位为囊性暗区。2周后可见1周前的囊性暗区已为高密度影所替代,高密度影范围有所扩大。3周后可见高密度影明显扩大。结果显示模型成瘤效果显著,成瘤率高达90%。
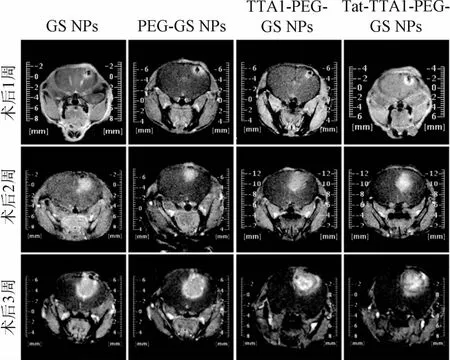
图2 各组胶质瘤种植后MRI增强扫描的结果Fig.2 MRI images of nudemice intracerebral glioblastomamodel
2.3 活体成像动态观察的结果 由尾静脉注射经荧光染料标记的纳米材料后定点活体成像仪观察到的结果(见图3),可见Cy5.5-NHS标记的GS经尾静脉注射后很快在肾脏富集并代谢,4 h时脑部荧光信号消失。经PEG修饰后其肾脏富集现象大大减弱,体内循环周期延长,4 h时脑部荧光信号仍然存在。经TTA1 PEG联合修饰后其体内代谢减慢,2 h可见脑部肿瘤注射点出现高于脑部其他部位的荧光信号,4 h时此高荧光信号仍然存在。经Tat、TTA1、PEG联合修饰后纳米载体体内循环时间延长,2、4 h脑部肿瘤注射部位同样出现高于脑部其他部位的荧光信号,且与TTA1-PEG-GSNPs组相比信号更强范围更大。

图3 纳米载体经尾静脉注入胶质瘤模型动物后活体成像观察结果Fig.3 Dynamic imaging of nudemice after the injection of nanoparticles
2.4 纳米载体在主要器官内的分布及跨血脑屏障靶向胶质瘤能力的评价 图4为纳米材料尾静脉注入胶质瘤模型动物4 h后取肝脏和脾脏活体成像观察的结果,由图可见Cy5.5-NHS荧光染料标记的GS NPs尾静脉注入模型动物后在肝脏和脾脏中均表现为较高信号。与GSNPs相比,经PEG修饰后的纳米载体在肝脏和脾脏中的荧光信号大大减弱。这表明经PEG修饰后的GSNPs能够在一定程度上逃避内皮-网状系统的吞噬。

图4 纳米载体尾静脉注入模型动物4 h后取肝、脾、脑活体成像结果A:对照组;B:GSNPs;C:PEG-GSNPs;D:TTA1-PEG-GSNPs;E:Tat-TTA1-PEG-GSNPsFig.4 Imaging results of removed liver,spleen and brain afternanoparticles injection of 4 hA:control group;B:GSNPs group;C:PEG-GSNPs group;D:TTA1-PEG-GSNPs group;E:Tat-TTA1-PEG-GSNPs group
未经修饰的纳米粒子在到达脑部之前很快会被RES吞噬降解[13]。由纳米材料尾静脉注入胶质瘤模型动物4 h后取脑活体成像的结果可以看到未经修饰的GSNPs只有少量能够聚集在脑部。经PEG修饰后脑部荧光增强且范围有所扩大。经TTA1-PEG联合修饰后脑部荧光强度和范围进一步增强,且在肿瘤部位的荧光强度强于脑部其他部位。证明与GSNPs相比经TTA1-PEG-GSNPs有较大优势进入脑且对胶质瘤具有靶向性。Tat、TTA1、PEG修饰后,脑部肿瘤部位出现最高强度的荧光信号,几乎整个脑部都被荧光所覆盖。证明与TTA1-PEG-GSNPs相比,Tat-TTA1-PEG-GSNPs到达脑组织和脑部肿瘤的能力都有所增强。已有文献报道经Tat-PEG联合修饰的纳米载体可以透过血脑屏障到达脑部[14]。
2.5 体内器官分布半定量分析结果 未经修饰的GSNPs在肝脏和脾脏中的荧光光子量分别达到了4731276.7和873792.3,经PEG修饰后纳米载体在肝脏和脾脏中的荧光光子量则分别下降到了3263552.3和300515.7,而脑部的荧光光子量则由35440.5提升到了91137.4。经PEG、TTA1联合修饰后肝脏和脾脏中的荧光光子量进一步下降而在脑部的含量则有所提升。经Tat、TTA1、PEG修饰后的纳米载体其在肝脏和脾脏中的荧光光子量下降到最低点而脑部光子量则达到最高,差异有统计学意义(P<0.01)。证明Tat-TTA1-PEG-GSNPs在肝脏和脾脏中的含量低于其他组,而在脑组织中的含量高于其他组。
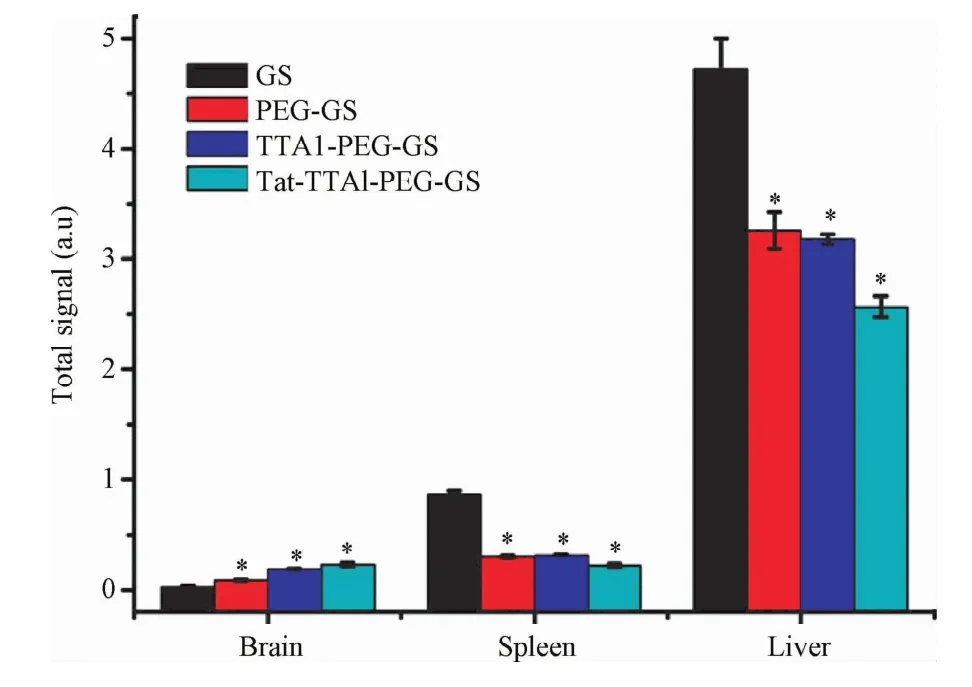
图5 将纳米载体尾静脉注入模型动物4 h后的体内器官分布图Fig.5 Distribution in vivo of different NPs after injecting intomice for 4 h via the tail vein
3 讨论
胶质瘤为原发于脑部的恶性肿瘤,传统的治疗方法疗效有限,而基因治疗提供了另一种途径。但是由于血脑屏障的存在,多数的基因载体和超过98%的可以用来治疗胶质瘤的药物都不能到达脑组织。GSNPs具有粒径小,毒性低及生物相容性高的特点,是理想的基因与药物载体。活体成像的结果显示与GS NPs相比,GSNPs经PEG修饰后在载瘤裸鼠体内的代谢速度减慢,半定量分析结果显示,纳米粒子在肝脏和脾脏中的含量大幅下降,而脑部含量有所增加,说明PEG-GSNPs能够在一定程度上逃逸内皮网状吞噬系统的吞噬,延长血浆半衰期,继而能使更多的纳米载体到达脑部血管透过血脑屏障。与PEG-GSNPs相比,TTA1-PEG-GSNPs不仅在肝脏、脾脏中的含量有所下降,脑部含量有所提升,而且在脑部胶质瘤部位有所集中,这说明TTA1-PEG-GSNPs不仅能够逃逸内皮网状吞噬系统的吞噬,透过血脑屏障,而且对胶质瘤具有靶向性。本实验室之前的研究证明与PEG-GSNPs相比,PEG、Tat共修饰的GSNPs尾静脉注入胶质瘤皮下动物模型后对胶质瘤的靶向性更高[15]。实验结果表明:与其3组相比,GSNPs经PEG-TTA1-Tat联合修饰后在肝脏和肾脏中的含量最低,而在脑部的含量最高,而且Tat-TTA1-PEG-GSNPs在脑部胶质瘤部位有非常明显的集中。以上结论表明:经Tat多肽、TTA1适配体、PEG联合修饰后的GSNPs不仅能够逃逸网状内皮系统的吞噬,而且能够跨过血脑屏障靶向到达胶质瘤。这些优势使得GSNPs能够携带治疗基因或药物,并保护其靶向到达胶质瘤细胞对胶质瘤进行有效的治疗。
脑胶质瘤是中枢神经系统最常见的、原发性恶性肿瘤,即使给予传统的手术联合放化疗的综合治疗,低级别胶质瘤患者的平均存活时间仅为3~5年,而高级别胶质瘤为1~2年。其治疗一直是神经外科领域的难点热点。血脑屏障的存在使很多药物难以进入脑部,大大限制了治疗效果。GSNPs不仅能够通过血脑屏障,经过靶向修饰后能够定向到达胶质瘤部位释放化疗药物与基因,它还具有低免疫原性、高容量性、对目的基因和药物具有保护作用,防止其被提前代谢。并且GSNPs在携带药物、基因进行治疗时不需要开放血-脑脊液屏障,且本身能够通过EPR效应滞留于胶质瘤部位,这些都给胶质瘤的治疗带来了极大优势。
[1]Kievit FM,Veiseh O,Fang C,et al.Chlorotoxin labeled magnetic nanovectors for targeted gene delivery to glioma[J].Acs Nano,2010,4(8):4587-4594.
[2]Pardridge WM.Blood-brain barrier delivery[J].Drug Discovery Today,2007,12(1):54-61.
[3]Mailander,Volker,Landfester,et al.Interaction of nanoparticles with cells[J].Biomacromolecules,2009,10(9):2379-2400.
[4]Jordan,Andreas,Scholz,et al.The effect of thermotherapy using magnetic nanoparticles on ratmalignant glioma[J].Journal of neurooncology,2006,78(1):7-14.
[5]Shah K,Bureau E,Kim DE,et al.Glioma therapy and real-time imaging of neural precursor cellmigration and tumor regression[J]. Annals of neurology,2005,57(1):34-41.
[6]Kawano,Kumi,Watanabe,et al.Enhanced antitumor effect of camptothecin loaded in long-circulating polymeric micelles[J]. Journal controlled release,2006,112(3):329-332.
[7]Locatelli E,Franchini MC.Biodegradable PLGA-b-PEG polymeric nanoparticles:synthesis,properties,and nanomedical applications as drug delivery system[J].Journal of Nanoparticle Research,2012,14(12):1-17.
[8]Hirata E,Arakawa Y,Shirahata M,et al.Endogenous tenascin-C enhances glioblastoma invasion with reactive change of surrounding brain tissue[J].Cancer science,2009,100(8):1451-1459.
[9]Gabathuler R.Approaches to transport therapeutic drugs across the blood-brain barrier to treat brain diseases[J].Neurobiology of Disease,2010,37(1):48-57.
[10]Wang ZY,Zhao Y,Ren L,et al.Novel gelatin-siloxane nanoparticles decorated by Tat peptide as vectors for gene therapy[J]. Nanotechnology,2008,19(44):445103.
[11]Yamada S,Khankaldyyan V,Bu X.Effect of the angiogenesis inhibitor Cilengitide(EMD 121974)on glioblastoma growth in nude mice[J]. Neurosurgery,2006,59(6):1304-1312.
[12]Dominguez,Alazne,Suarez-Merino.Nanoparticles and Blood-Brain Barrier:The Key to Central Nervous System Diseases[J].Journal of nanoscience and nanotechnology,2014,14(1):766-779.
[13]Brannon-Peppas L,Blanchette JO.Nanoparticle and targeted systems for cancer therapy[J].Advanced drug delivery reviews,2012,64:206-212.
[14]Liu L,Guo K,Lu J,et al.Biologically active core/shell nanoparticles self-assembled from cholesterol-terminated PEG-TAT for drug delivery across the blood-brain barrier[J].Biomaterials,2008,29(10):1509-1517.
[15]Tian XH,Wei F,Wang TX,et al.Blood-brain barrier transport of Tat peptide and polyethylene glycol decorated gelatin-siloxane nanoparticle[J]. Materials Letters,2012,68:94-96.
Research of Tat-TTA1-PEG modified gelatin-siloxane nanoparticles across blood-brain barrier and its targeting to glioma
ZHANG Long1,HU Yang1,LIN Xiao-ning2,WEIFeng2,FENGWei2,TIAN Xin-hua2Δ
(1.Medical College of Xiamen University,Xiamen 361004,China;2.Zhongshan Affiliated Hospital of Xiamen University,Xiamen 361004,China)
ObjectiveTo observe the property of Tat-TTA1-PEGmodified gelatin-siloxane nanoparticles across the blood-brain barrier and glioma targeting.MethodsGSNPs were prepared by two-step sol-gelmethod,and then labbled by Cy5.5-NHS.After that,PEG,aptamer TTA1 and Tat peptide were conjugate onto GSNPs respectively.Establish orthotopic implantation model of glioma(20~25),and they were divided into 5 groups:blank control group,GSNPs group,PEG-GSNPs group,TTA1-PEG-GSNPs group and Tat-TTA1-PEG-Gs group.GSNPs,PEG-GSNPs,TTA1-PEGGSNPs and Tat-TTA1-PEG-GS NPs were injected respectively into animalmodel,and their distribution via vivo imaging system were detected.To compare their distribution in major organ,the brain,liver and spleen were removed and visualized by vivo imaging system.ResultsCompared with other groups,Tat-TTA1-PEG-GSNPs injected mice had much fluorescent photons in brain,but less in liver and spleen.Conclusion Tat-TTA1-PEG-GS NPs could not only escape the capture of RES but also penetrate the blood-brain barrier and target to glioma.
glioma;nanoparticles;blood-brain barrier;target drug delivery system
R739.4
A
1005-1678(2014)08-0043-05
国家自然科学基金(30970733)
张龙,男,硕士,研究方向:胶质瘤的基因治疗,E-mail:zhangyanlongy@163.com;田新华,通信作者,男,博士,主任医师,研究方向:胶质瘤的基因治疗,E-mail:txhmd@163.com。
