无溶剂条件下嘧啶-6-酮衍生物的简便合成
2014-09-13王苏惠查云赟荣良策
王苏惠, 查云赟, 荣良策
(江苏师范大学 化学化工学院,江苏 徐州 221116)
无溶剂反应是指反应过程中不使用溶剂,可大大减少溶剂对环境的危害,逐渐成为绿色有机合成的重要途径之一[1-2].在无溶剂反应体系中,反应物分子之间可以直接接触,造成局部高浓度,从而使反应的选择性和转化率提高,加快了反应的周期.这类反应操作简单,实施起来较为方便,通常经过固相研磨、加热或微波辅助以及振荡等合成方法来实现,因此已被广泛应用于各类化合物的合成中,成为开发制备绿色材料和产品的重要手段.嘧啶酮衍生物是一类重要的含氮杂环化合物,具有良好的生物活性和广阔的应用前景,如用做抗病毒、抗高血压、抗肿瘤、抗菌和抗HIV等药物[3-5].此外,还具有调节钙离子通道、降血压的作用,在除草剂、染料、杀虫剂方面也有着悠久的应用历史[6-7].因此,合成嘧啶酮衍生物成为人们研究的热点之一.很多文献报道了嘧啶酮衍生物的合成[8-10],但多数反应在有机溶剂中进行,如Hamper等[8]报道了在DMF,CH2Cl2,TFA中合成1,2,4-三取代嘧啶-6-酮-5-羧酸衍生物,使用了复杂的催化剂硝酸铈铵(CAN),Wu等[10]报道合成此类化合物需要5步.所以选择更简单、容易操作的途径合成此类化合物是十分必要的.本文报道在无溶剂条件下,以芳醛(1),氰乙酸乙酯(2)和氰基胍(3)为底物,一步法合成嘧啶-6-酮衍生物(4).在反应过程中使用实验室常见的低值试剂,因此具有环境友好、成本低廉、操作简单等优点.反应方程式如下:
1234
1 实验部分
1.1 仪器和试剂
仪器:玛瑙研钵;熔点在TX5型显微熔点仪上测定(温度未经校正);红外光谱使用FT/IR-8101型红外光谱仪测定(KBr压片);核磁共振氢谱在Bruker-400 MHZ型核磁共振仪上测定,DMSO-d6为溶剂,TMS为内标;高分辨率质谱数据在Bruker-micrOTOF-Q-II高分辨质谱仪上测定.
试剂:所用试剂均为分析纯或化学纯,使用前未经纯化.
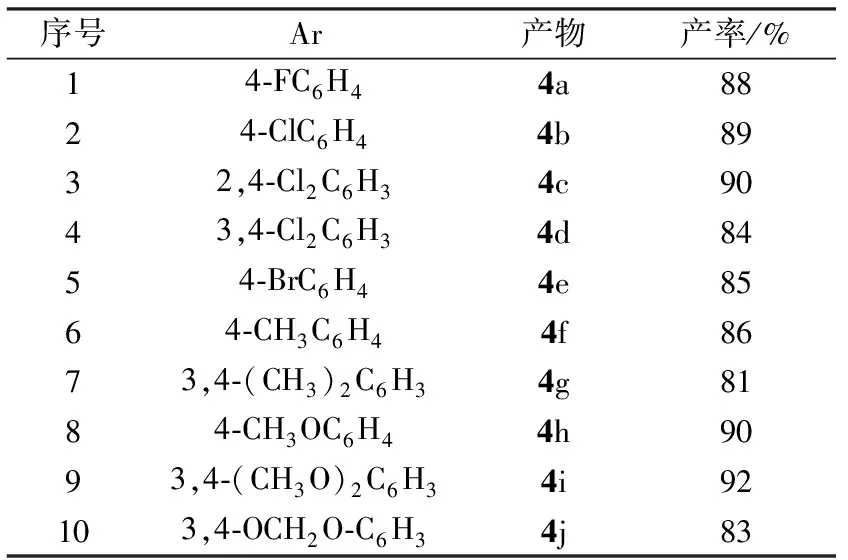
表1 产物的合成结果
1.2 标题化合物的合成
1,2,3各1 mmol,NaOH 0.05 g置于玛瑙研钵中混合均匀,转至50 ml圆底烧瓶中,在70 ℃条件下加热30 min,得到淡黄色固体,用水充分洗至中性,抽滤,固体产物用95%乙醇重结晶,得目标化合物4.反应结果见表1.产物的结构表征如下:
4a mp:262~264 ℃.IRν: 3229,3135,3030,2936,2220,1707,1605,1501,1384,1341,1258,1247,1165,854,835,805,775,760,647,584 cm-1.1HNMRδ:7.40(2H,m,ArH),7.85(2H,m,ArH),11.57(1H,s,NH).HRMSm/z:C12H6FN5O[M+H]+,计算值,256.0635;实测值,256.0636.
4b mp:244~246 ℃.IRν:2934,2802,2204,1518,1494,1344,1275,1250,1221,1135,1112,1092,1012,842,774,729,718,686,667,628,561 cm-1.1HNMRδ:7.65(2H,d,J=8.4 Hz,ArH),7.73(2H,d,J=8.8 Hz,ArH),11.65(1H,s,NH).HRMSm/z:C12H6ClN5O[M+H]+,计算值,272.0339;实测值,272.0339.
4c mp:>280 ℃; IRν:3087,2952,2806,2203,1552,1473,1353,1268,1221,1142,1032,919,891,843,772,744,720,633,573,547 cm-1.1HNMRδ:7.54(1H,d,J=8.4 Hz,ArH),7.60(1H,d,J=8.4 Hz,ArH),7.82(1H,d,J=1.6 Hz,ArH),11.77(1H,s,NH).HRMSm/z:C12H5Cl2N5O[M+H]+,计算值,305.9949;实测值,305.9954.
4d mp:246~247 ℃.IRν:3087,2952,2806,2203,1654,1552,1473,1353,1268,1221,1142,1032,919,891,843,772,744,720,633,573,547 cm-1.1HNMRδ:7.74(1H,d,J=8.0 Hz,ArH),7.86(1H,t,J=6.4 Hz,ArH),7.98(1H,d,J=2.0 Hz,ArH),11.59(1H,s,NH).HRMSm/z:C12H5Cl2N5O[M+H]+,计算值,305.9949;实测值,305.9954.
4e mp:274~276 ℃.IRν:3142,3086,2960,2806,2205,1512,1489,1466,1431,1352,1274,1252,1222,1072,1024,1010,837,774,727,627,564 cm-1.1HNMRδ:7.66(2H,d,J=8.4 Hz,ArH),7.78(2H,d,J=8.8 Hz,ArH),11.68(1H,s,NH).HRMSm/z:C12H6BrN5O[M+H]+,计算值,315.9834;实测值,315.9836.
4f mp:275~277 ℃.IRν:3240,3135,2933,2194,1709,1494,1380,1337,1292,1190,1118,1032,1019,828,807,698,627,583,546 cm-1.1HNMRδ:2.40(3H,s,CH3),7.39(2H,d,J=8.0 Hz,ArH),7.60(2H,d,J=8.0 Hz,ArH),11.75(1H,s,NH).HRMSm/z:C13H9N5O[M+H]+,计算值,252.0885;实测值,252.0876.
4g mp:252~254 ℃.IRν:2804,2199,1647,1465,1357,1287,1234,1122,1036,999,840,774,724 cm-1.1HNMRδ:2.32(3H,s,CH3),2.30(3H,s,CH3),7.33(1H,d,J=4.8 Hz,ArH),7.45(2H,t,J=8.0 Hz,ArH),11.67(1H,s,NH).HRMSm/z:C14H11N5O[M+H]+,计算值,266.1042;实测值,266.1037.
4h mp:266~268 ℃.IRν:3171,3092,3043,2957,2804,2212,1717,1670,1584,1502,1449,1342,1284,1223,1183,1131,1015,841,765,747,582 cm-1.1HNMRδ:3.85(3H,s,OCH3),7.11(2H,d,J=8.8 Hz,ArH),7.72(2H,d,J=8.8 Hz,ArH),11.64(1H,s,NH).HRMSm/z:C13H9N5O2[M+H]+,计算值,268.0834;实测值,268.0839.
4i mp:234~236 ℃.IRν:2978,2813,2209,1714,1663,1597,1568,1524,1462,1352,1330,1275,1213,1177,1154,1103,1016,945,866,813,764,646,556 cm-1.1HNMRδ:3.82(3H,s,OCH3),3.85(3H,s,OCH3),7.15(1H,d,J=8.4 Hz,ArH),7.35(1H,d,J=2.0 Hz,ArH),7.38(1H,d,J=8.0 Hz,ArH),11.82(1H,s,NH).HRMSm/z:C14H11N5O3[M+H]+,计算值,298.0940;实测值,298.0944.
4j mp:272~274 ℃.IRν:3233,2921,2795,2220,1705,1578,1491,1445,1331,1271,1215,1125,1097,1041,922,872,808,773,763,734,700,670,643,581,569,552 cm-1.1HNMRδ:6.16(2H,s,OCH2O),7.11(1H,d,J=8.0 Hz,ArH),7.27(2H,d,J=5.6 Hz,ArH),11.79(1H,s,NH).HRMSm/z:C13H7N5O3[M+H]+,计算值,282.0627;实测值,282.0626.
2 结果与讨论
从表1中可以看到,不同取代基的芳醛在反应中都具有较好的反应结果,虽然芳环上的取代基的化学性质不同,但无论是带有吸电子基(如卤原子),还是带有给电子基(如甲基和甲氧基),反应都没有受到明显的影响,说明本反应对不同电子性质的芳醛都具有良好的适应性.

本文报道了一种高效合成嘧啶-6-酮衍生物的方法,与传统的合成法相比,具有环境友好、操作简单、产物的收率较高的优点,是合成此类结构化合物的一条绿色途径.
参考文献:
[1] Tanaka K,Toda F.Solvent-free organic synthesis[J].Chem Rev,2000,100(3):1025.
[2] 荣良策,李小跃,王海营.固相合成α,β-不饱和酮[J].徐州师范大学学报:自然科学版,2006,24(2):61.
[3] George T,Kaul C L,Grewal R S,et al.Antihypertensive and monoamine oxidase inhibitory activity of some derivatives of 3-formyl-4-oxo-4H-pyrido[1,2-a]pyrimidine[J].J Med Chem,1971,14(10):913.
[4] Bergstorm D E,Brattesani A J,Ogawa M K,et al.Antiviral activity of C-5 substituted tubercidin analogued[J].J Med Chem,1984,27(3):285.
[5] Sanghvi Y S,Larson S B,Matsumoto S S,et al.Antitumor and antiviral activity of syntheticα- andβ-ribonucleosides of certain substituted pyrimido[5,4-d]pyrimidines:a new synthetic strategy for exocyclic aminonucleosides[J].J Med Chem,1989,32(3):629.
[6] Hinks D,Freeman H S,Arai Y,et al.Synthesis and evaluation of organic pigments:studies of bisazomethine pigments based on planar nonmutagenic benzidine analogs[J].Dyes Pigm,2001,48(1):7.
[7] Kappe C O,Fabian M F.Conformational analysis of 4-aryl-dihydropyrimidine calcium channelmodulators:a comparison of abinitio,semiemp irical and X-ray crystal-lographic studies[J].Tetrahedron,1997,53(8):2803.
[8] Hamper B C,Kesselring A S,Chott R C,et al.Parallel solid-phase synthesis and high-throughput1HNMR evaluation of 96-member 1,2,4-trisubstituted-pyrimidin-6-ones-5-carboxylic acid library[J].J Comb Chem,2009,11(3):469.
[9] Ramanjulu J M,DeMartino M P,Lan Y F,et al.Titanium(Ⅳ) isopropoxide mediated synthesis of pyrimidin-4-ones[J].Org Lett,2010,12(10):2270.
[10] Wu Minghu,Hu Jihuan,Shen Dongsheng,et al.Regiospecific synthesis of 6-aryl-3-cyano-5-alkylamino/arylamino-1-p-tolyl-1H-pyrazolo[4,3-d]pyrimidin-7(6H)-ones via iminophosphorane-mediated annulation[J].Tetrahedron,2010,66(27/28):5112.
[11] 刘丽华,殷姗,夏盛,等.无溶剂条件下简单、有效地合成1,6-二氢嘧啶-6-酮衍生物[J].有机化学,2010,32(3):612.
