亚硒酸钠预处理对Aβ损伤PC12细胞的保护性作用
2014-09-13王敏娟李亚军石少亭郭长江张世俊
王敏娟 李亚军 张 蓓 石少亭 郭长江 折 潇 张世俊 左 星
(西安医学院第一附属医院神经内科,陕西 西安 710077)
阿尔茨海默病(AD)病理变化之一是淀粉样蛋白前体(APP)裂解成的β淀粉样蛋白沉积脑内所形成的老年斑及神经元纤维缠结。AD的发病机制非常复杂,氧化应激被认为是AD的一个重要致病因素,有研究表明,由异常沉积Aβ诱导的氧化应激导致的神经元代谢障碍和突触功能丧失在AD发病中处于关键地位〔1,2〕。增强其抗氧化能力变成了近年来AD治疗的一个靶点。脑内主要的抗氧化含硒酶是谷胱甘肽过氧化物酶(GSH-Px),GSH-Px通过活性中心的硒代半胱氨酸与氧代谢产物发生接触反应,发挥其抗氧化功能,研究表明硒能够增强GSH-Px的抗氧化活性。本研究观察亚硒酸钠预处理对Aβ氧化损伤PC12细胞的影响。
1 材料与方法
1.1材料 PC12细胞株、亚硒酸钠(购自西安交通大学医学院中心实验室);Dulbecco改良的Eagle培养基(DMEM美国Gibco公司);胰蛋白酶(美国Gibco公司);小牛血清(杭州四季青公司);四甲基偶氮唑蓝(MTT)、Aβ1~40;二甲基亚砜(DMSO美国Sigma公司)。LDH、GSH-Px、丙二醛(MDA)测定试剂盒(南京建成生物工程研究所);碘化丙啶(PI)、FITC-Annexin V(美国Sigma公司);其余试剂为国产分析纯试剂。
1.2主要仪器设备 Thermo Forma CO2培养箱(美国Thermo Fisher Scientific);POLARstar OPTIMA酶标仪(德国BMGLABTECH实验仪器公司);倒置显微镜(日本Olympus公司);超净工作台(天津泰斯特仪器有限公司);流式细胞仪(美国Becton Dickinson公司)。
1.3方法
1.3.1细胞培养 PC12细胞用含10%的小牛血清的DMEM培养基(100 mg/L链霉素,100 mg/L青霉素)在37℃、5%的CO2及饱和湿度的培养箱中培养,每2~3天换液一次,5~6 d传代一次。
1.3.2MTT法检测亚硒酸钠对PC12细胞活性的影响 选择对数生长期的PC12细胞,胰酶消化后细胞计数,调整细胞密度为1×105接种到96孔板上,待其贴壁后,在各组中加入亚硒酸钠,使其终浓度为0、0.5、1、5、8、10、20、50、150 mg/L,总体积为200 μl,每组设6个复孔,培养44 h后,每孔内加入MTT 20 μl,继续孵育4 h,然后吸去上清液,每孔内加入DMSO 150 μl,振荡10 min,使紫蓝色结晶充分溶解。用酶标仪490 nm波长检测各孔吸光度(OD)值。
1.3.3分组 分为正常对照组、亚硒酸钠预处理组、亚硒酸钠预处理后损伤组、损伤组。正常对照组:PC12细胞培养72 h。亚硒酸钠预处理组:PC12细胞加入含有亚硒酸钠(终浓度0.5 mg/L)培养基培养48 h后,更换为完全培养基培养。预处理后损伤组:PC12细胞加入含有亚硒酸钠(终浓度0.5 mg/L)培养基培养48 h后,更换为含有Aβ的培养基(终浓度25 μmol/L)培养24 h。损伤组:PC12细胞培养48 h后加入含有Aβ的完全培养基(终浓度25 μmol/L)培养24 h。
1.3.4MTT法测定各组细胞的生存率 选择对数生长期的PC12细胞,分组处理方法同上,用MTT法(同上)检测各孔吸光度(OD)值。
1.3.5流式细胞仪检测凋亡 选择对数生长期的PC12细胞,分组处理方法同上,胰酶消化并收集各组细胞于10 ml离心管中,1000 r/min,离心5 min,弃去培养液,用PBS再洗涤两遍,1 000 r/min离心5 min,弃上清液。用100 μl的标记溶液(标记液:将FITC-Annexin V和PI加入到孵育缓冲液即10 mmol/L HEPES/NaOH,pH7.4,140 mmol/L NaCl,5 mmol/L CaCl2中,终浓度均为1 mg/L)重悬细胞,室温下避光孵育10~15 min,1 000 r/min离心5 min,沉淀细胞孵育缓冲液洗1次,加入荧光(SA-FLOUS)溶液4℃下孵育20 min,避光并不时振动,做流式细胞仪分析。
1.3.6MDA含量测定 过氧化脂质降解产物中的MDA可与硫代巴比妥酸结合,形成红色产物,在532 mm处比色测定各管吸光度,通过公式计算可求出被测样品中的MDA含量。测定方法严格按照试剂盒说明书操作。
1.3.7GSH-Px活性及LDH漏出率测定 测定方法严格按照试剂盒说明书操作。
1.4统计学处理 采用SPSS19.0统计学软件进行方差分析。
2 结 果
2.1亚硒酸钠对PC12细胞的影响 当亚硒酸钠浓度为0.5 mg/L时,处理细胞24 h后,其OD值为0.80±0.11,与正常对照组比较无统计学意义(0.812 4±0.145 0,P>0.05),随着亚硒酸钠浓度的增加(1,2,5,8,10,20,50 mg/L),各组细胞的OD值也越来越小(0.775 0±0.176 5,0.720 0±0.239 4,0.483 3±0.306 2,0.330 0±0.258 2,0.261 7±0.174 0,0.210 0±0.143 8,0.131 7±0.098 0),与正常对照组比较有统计学意义(P<0.05),当浓度为150 mg/L时,细胞的OD值接近于零(0.108 3±0.204 0)。
2.2亚硒酸钠对Aβ损伤PC12细胞的保护作用
2.2.1细胞形态学观察 正常对照组PC12细胞的形态完整规则,细胞呈梭形有立体感;亚硒酸钠预处理后的PC12细胞体积增大,形态丰满,胞核大,胞质丰富;Aβ损伤PC12细胞24 h后细胞的密度下降,融汇成片,细胞间空隙增大,形态有所改变,突起缩短甚至消失,大部分细胞呈球形,有活力细胞数目减少,胞质较暗淡,贴壁细胞欠透明;亚硒酸钠预处理后经Aβ损伤的PC12细胞与损伤组比较,分布较均匀,未见汇聚成片,可见细胞突起,细胞形态较规则完整(图1)。

正常对照组 亚硒酸钠预处理组 损伤组 预处理后损伤组
2.2.2MTT结果 亚硒酸钠预处理组细胞的OD值(1.04±0.09)较正常对照组(0.89±0.08)增高(P<0.05),损伤组细胞的OD值(0.41±0.05)较正常对照组下降(P<0.01),预处理后损伤组细胞的OD值(0.66±0.05)较损伤组增高(P<0.01)。
2.2.3流式细胞仪检测凋亡 预处理后损伤组与损伤组相比,细胞的早期和晚期凋亡率均降低(P<0.05)。见表1。
2.3GSH-Px活性测定 损伤组GSH-Px活性较正常对照组下降(P<0.01),亚硒酸钠预处理组GSH-Px活性较正常对照组显著增高(P<0.01),而预处理后损伤组GSH-Px活性较损伤组增高(P<0.01)。各组细胞相比亚硒酸钠预处理组GSH-Px活性最高,损伤组GSH-Px活性最低,预处理后损伤组GSH-Px活性较损伤组增高。见表2。

表1 亚硒酸钠对Aβ氧化损伤PC12细胞凋亡率的影响
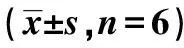
表2 亚硒酸钠对Aβ氧化损伤PC12细胞各指标影响
2.4MDA含量、LDH漏出率测定 损伤组的MDA含量较正常对照组增高(P<0.01),而预处理后损伤组较损伤组的MDA含量下降(P<0.05)。损伤组的LDH漏出率较正常对照组增高(P<0.01),而预处理后损伤组较损伤组的LDH漏出率下降(P<0.01)。见表2。
3 讨 论
AD临床主要表现为进行性认知功能损害,精神行为症状和社会生活功能减退〔3〕。据统计,2006年,AD在全球的发病率就达到了2 655万〔4〕,占了所有痴呆病例的50%~60%。本病最具特征性的病理改变为神经细胞外老年斑和细胞内神经元纤维缠结的形成。老年斑的主要成分是Aβ蛋白,Aβ蛋白在神经细胞外积聚,通过诱导氧化应激等多种方式对神经细胞造成损伤,最终导致神经细胞破裂而死亡。主要的损伤途径如下:①Aβ聚集可以产生大量自由基,破坏细胞膜的完整性,干扰细胞内离子稳态而诱导神经细胞凋亡;②Aβ与特异性的受体相结合激活胶质细胞产生肿瘤坏死因子等毒性物质而导致神经元死亡;③Aβ产生的脂质过氧化物介导细胞损伤,抑制再生〔5,6〕。④Aβ与Cu2+、Zn2+等氧化型的金属离子结合成复合物催化ROS生成。⑤AD早期Aβ即可进入线粒体与ABAD、CYPD等靶点结合诱导神经元细胞的凋亡〔7,8〕。有关动物实验表明过度表达Aβ的转基因小鼠出现与AD患者相似的氧化应激损伤〔9〕,本研究使用Aβ作用于PC12细胞来模拟AD的体外发病模型,Aβ损伤组细胞的密度下降,部分细胞死亡,凋亡细胞增加,大部分细胞形态改变,LDH漏出率增加,同时该组细胞的抗氧化能力下降,表现为GSH-Px活性下降,并且脂质过氧化物MDA的含量增加,这与AD的氧化应激发病机制是一致的,即抗氧化能力减弱的同时自由基生成增加。此外,有研究表明AD患者的血清甲状腺素水平显著低于正常人群〔10〕,这可能也与氧化应激有关。
大量证据显示氧化应激不仅是AD的早期事件,而且还激活特定的信号转导通路引起级联酶促反应〔1,11~15〕,它在AD的发病机制中处于关键的地位,因此针对抗氧化应激的治疗也受到极大关注。GSH-Px在机体的抗氧化防御体系中担任重要角色,它与体内的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)一起构成了机体的抗氧化防御体系。GSH-Px可以消除机体内的过氧化氢及脂质过氧化物,阻断活性氧自由基对机体的进一步损伤,是生物体内重要的活性氧自由基清除剂,它以Sec的形式发挥作用,以谷胱甘肽(GSH)为还原剂分解体内的脂质过氧化物,因而可防止细胞膜和其他生物组织免受过氧化损伤。GSH-Px是脑内主要的抗氧化酶,活性中心Sec被氧化成为半胱次磺酸或二硫化物,后者再被硫氧还蛋白还原酶还原成半胱氨酸从而恢复GSH-Px的抗氧化活性。有研究发现,氧化应激可以使GSH-Px的Sec被氧化为亚磺酸甚至磺酸,该产物不能在硫氧还蛋白还原酶作用下还原为GSH-Px〔16〕,这意味着氧化应激直接导致了GSH-Px的数量减少、活性下降。因此维持GSH-Px在脑内的含量和活性,在脑的抗氧化损伤中具有非常重要的意义。Aβ蛋白通过诱导氧化应激对神经细胞造成损伤,最终导致神经细胞破裂而死亡,那么诱导细胞产生更多的GSH-Px是否能够改善AD的痴呆症状、延缓神经功能的减退尚有待于进一步证实。目前,项长达5~12年PREADVISE研究将揭示硒对AD的保护效应。
本研究使用亚硒酸钠预处理PC12细胞,发现低浓度的亚硒酸钠可以促进细胞增殖,使细胞的存活率增加,细胞的突起延长,同时预处理组GSH-Px活性明显增强,分析原因可能是一方面亚硒酸钠通过强化神经生长因子(NGF)、胰岛素样生长因子受体(IGFR)、神经元特异性烯醇化酶(NSE)等因子表达,促进细胞生长发育与分化,使细胞的存活率增加,同时亚硒酸钠增强GSH-Px的表达最终提高了GSH-Px活性。经过亚硒酸钠预处理后的PC12细胞抵抗Aβ诱导的氧化损伤能力增强,与损伤组相比可见亚硒酸钠预处理组细胞形态规则完整,分布较均匀,可见细胞突起;细胞的存活率增高;凋亡率、LDH漏出率、MDA含量下降;GSH-Px活性消耗减少。因此,本研究认为亚硒酸钠可以诱导PC12细胞产生更多的GSH-Px,促进细胞增殖,增强细胞抵抗Aβ诱导的氧化应激的能力,对改善AD的痴呆症状、延缓神经功能的减退可能有一定的作用。
4 参考文献
1Querfurth HW,Laferla FM. Alzheimer's disease 〔J〕. N Engl J Med,2010;362(4): 329-44.
2Butterfield DA,Reed T,Newman SF,etal. Roles of amyloid beta-peptide-associated oxidative stress and brain protein modifications in the pathogenesis of Alzheimer,s disease and mild cognitive impairment 〔J〕. Free Radic Biol Med,2007;43 (5): 658-77.
3Hiu MJ,Chen TF,Yip PK,etal.Behavioral and psychologic symptoms in different types of dementia.〔J〕. Formos Med Assoc,2006;105 (7):556-62.
4Brookmeyer R,Johnson E,Ziegler G,etal. Forecasting the global burden of Alzheimer's disease 〔J〕. Alzheimers Dement,2007;3(3):186-91.
5Guan ZZ.Cross-talk between oxidative stress and modifications of cholinergic and glutaminergic receptors in the pathogenesis of Alzheimer's disease〔J〕.Acta Pharmacol Sin,2008;29(7):773-80.
6Zhu X,Smith MA,Honda K,etal.Vascular oxidative stress in Alzheimer disease 〔J〕.Neurol Sci,2007;257(1/2):240-6.
7Yan SD,Shi Y,Zhu A,etal.Role of ERAB/L-3- hydroxyacylcoenzyme A dehydrogenase type Ⅱ activity in A beta-induced cytotoxicity 〔J〕.Biol Chem,1999;274(4):2145-56.
8Du H,Guo L,Fang F,etal.Cyclophilin D deficiency at tenuates mitochondfial and neuronal perturbation and a meliorates learning and memory in Alzheimer's disease 〔J〕.Nat Med,2011;14(10):1097-105.
9Barde YA,Edgar D,Thoenen H.Purification of a new neurotrophic factor from mammalian brain 〔J〕.EMBO J,1982;1(5):549-53.
10方凌燕,刘衍宇,关俊文.阿尔茨海默病与生物节律相互关系的研究进展〔J〕.中国老年学杂志,2011;31(4):1486-8.
11Petersen RB,Nunomura A,Lee HG,etal. Signal transduction cascades associated with oxidative stress in Alzheimer’s disease 〔J〕. Alzheimers Dis,2010;11 (2): 143-52.
12Su B,Wang X,Nunomura A,etal. Oxidative stress signa-ling in Alzheimer’s disease 〔J〕. Curr Alzheimer Res,2008;5(6): 525-32.
13Durackova Z. Some current insights into oxidative stress 〔J〕. Physiol Res,2009;12 (1): 1-30.
14Su B,Wang X,Lee HG,etal. Chronic oxidative stress causes increased tau phosphorylation in M17 neuroblastoma cells 〔J〕.Neurosci Lett,2010;468 (3): 267-71.
15Cenini G,Sultana R,Memo M,etal. Effects of oxidative and nitrosative stress in brain on p53 proapoptotic protein in amnestic mild cognitive impairment and Alzheimer disease 〔J〕. Free Radic Biol Med,2011;45 (1): 81-5.
16Chevallet M,Wagner E,Luche S,etal.Regeneration of peroxiredoxins during recovery after oxidative stress 〔J〕. Biol Chem,2003;278(39):37146-53.
