液压冲击脑损伤大鼠炎性因子的表达及意义
2014-09-13张林会李胜超孙国柱
张林会 李胜超 孙国柱
(河北医科大学第二医院神经外科,河北 石家庄 050000)
颅脑损伤包括机械性冲击造成的原发性损伤和损伤后启动的一系列生化过程引起的继发性、进行性神经细胞损伤即继发性脑损伤,前者具有不可预料性和难控制性,后者则是在首次损伤后启动的包括一系列神经生化降解过程的损伤级联反应〔1〕,炎性细胞因子大量激活并分泌,导致神经细胞变性、坏死,与颅脑损伤的过程及其预后密切相关〔2〕,但有关炎性细胞因子表达规律的报道较少。为此,本研究通过制作液压打击颅脑损伤模型,观察脑组织含水量、组织学变化以及炎性细胞因子白细胞介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-α、ICAM-1表达的动态变化,探讨炎性细胞因子在继发脑损伤中的作用。
1 材料与方法
1.1材料 成年雄性SD大鼠48只,体重250~300 g,购于河北医科大学实验动物中心,兔抗鼠IL-1β、IL-6、TNF-α、ICAM-1多克隆抗体购于Sigma公司,兔二步法检测试剂盒购于Santa Cruz公司,其他试剂均为进口或国产分析纯。
1.2动物分组和模型制作 将实验动物随机分为2组,其中模型组40只,再按照伤后1、6、12、24 h、3、7 d又分为5个亚组,每个亚组8只;假手术组共8只。采用Dixon法制作动物模型〔3〕。假手术组,仅切开头皮,凿骨窗,不行液压打击,余同上。喂养标准饲料和饮用纯净水,使用动物专用笼箱和洁净垫料,恒温20~25℃饲养。自由进食水。
1.3标本的制作和采集 假手术组在术后,模型各亚组在相应时间点,在氯胺酮过度麻醉下,4%多聚甲醛经心灌注,开颅取脑,以经过挫伤灶的横线为基线,在基线前侧取(200±50) mg脑组织用于测定脑组织含水量,取挫伤灶后(断面跨挫伤灶)约4 mm厚的脑组织进行固定和石蜡包埋,获得的组织切片行HE染色和免疫组织化学染色。
1.4干湿法测定脑组织含水量 所取标本先用滤纸吸除表面水分,置电子分析天平(分度值0.000 1 g)称取湿重(W),再经110 ℃ 恒温烤箱烘烤24 h后称取干重(D)。应用公式:脑组织含水量(%)=(W-D)/ W ×100,计算出脑组织含水量。
1.5免疫组化观察AQP4表达 采用链霉菌抗生物素蛋白-过氧化物酶免疫组化染色试剂盒进行染色。阴性对照分别用正常山羊血清和PBS代替IL-1β、IL-6、TNF-α、ICAM-1一抗作孵育,其余步骤同上。以细胞膜上出现棕黄色粗颗粒或棕黄色细腻颗粒为阳性结果。采用Motic Med 6.0数码医学图像分析系统进行图像分析,以细胞平均光密度值(OD)表示IL-1β、IL-6、TNF-α、ICAM-1阳性表达的强弱。
1.6统计学方法 采用SPSS11.0软件单因素方差分析,计算Pearson相关系数进行相关性分析。
2 结 果
2.1脑组织含水量 与假手术组(78.46±1.112)%比较,模型组1 h(77.94±0.762)%时无差异(P>0.05),6 h时稍升高(79.11±1.276)%,12 h显著升高(80.26±1.473)%,24 h至3 d达到高峰(82.74%±1.097%,82.04%±1.694%),7 d时降低(80.72±1.866)%。
2.2IL-1β、IL-6、TNF-α、ICAM-1表达 IL-1β表达:与假手术组相比,模型组动物水肿脑组织的IL-1β表达6~12 h升高(P<0.05),24 h至3 d达到高峰,至3 d开始下降,至7 d仍高于SO组。IL-6表达:与SO组相比,TBI组动物水肿脑组织的IL-6蛋白表达自伤后1 h开始升高,12 h持续增加,在伤后24 h到达高峰,伤后3 d至7 d后逐渐降低。TNF-α表达:TBI组动物水肿脑组织TNF-α表达从1h开始增高,6 h至12 h达到高峰,24 h 后逐渐下降,仍高于SO组。ICAM-1表达:与假手术组相比,模型组动物水肿脑组织ICAM-1表达自伤后6 h开始升高,伤后12 h仍继续上升,24 h达高峰,3 d开始逐渐减低,7 d后仍高于SO组(P<0.05),见表1,图1。
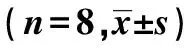
表1 不同时间点IL-1β、IL-6、TNF-α、ICAM-1的表达变化
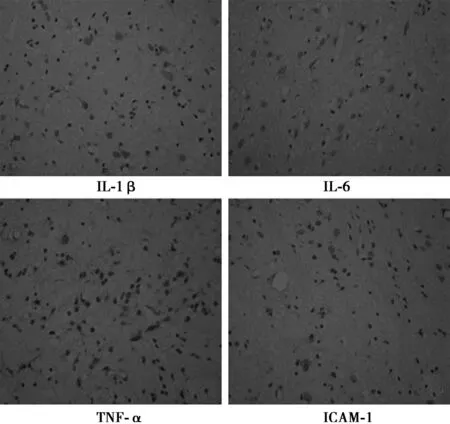
图1 模型组各炎性因子表达(DAB,×400)
2.3组织学观察 模型组大鼠伤后1 h可见挫裂伤灶结构破坏,点片状出血,胶质细胞胞浆有空泡样变。6 h挫裂伤灶组织崩解,其周围神经胶质细胞变形及出现空泡样变性,血管外间隙扩大。12 h神经胶质细胞空泡样继续增加。24 h胶质细胞胞浆空泡样变更加明显,数量增加;神经细胞胞体肿胀,胞质嗜酸性变,胞核固缩变形,偏心,且神经细胞及胶质细胞周围水肿,间隙变宽。3 d大量神经细胞变性坏死,胶质细胞显著增生,炎症细胞浸润。7 d坏死空洞由纤维组织填充,胶质细胞增生更加明显,水肿有所减轻,炎症细胞大量浸润。假手术组动物光镜下见脑组织结构完整,细胞排列有序,无损伤、水肿及出血,神经细胞类圆形,核仁蓝色淡染,核膜完整。
2.4IL-1β、IL-6、TNF-α、ICAM-1表达和脑水肿的关系 线性回归分析显示:水肿脑组织中IL-1β、IL-6、TNF-α、ICAM-1的表达与脑含水量之间呈正相关(r=0.805,r=0.763,r=0.927,r=0.866,均P<0.05)
3 讨 论
本实验说明炎性因子参与了继发性脑损伤的病理发生发展过程。正常脑组织中炎性细胞因子表达轻微,但是创伤性颅脑损伤发生后,由于受到机械性创伤以及合并缺血、缺氧等病理因素的作用下,脑组织产生大量的炎性细胞因子,破坏血脑屏障,引起脑水肿,加剧继发性损伤〔4,5〕。TNF-α、IL-1β、IL-6、ICAM-1被认为属于促炎细胞因子,它们在颅脑损伤后以及脑水肿的早期短暂超量表达是造成继发性颅脑损害的重要因素,甚至认为其表达水平可作为衡量颅脑损伤后继发性炎症反应程度的重要指标〔6~8〕。
TNF-α是损伤后较早期释放的促炎细胞因子,具有多种生物效应,可以激活细胞因子级联反应,诱导白细胞介素和次级炎症介质的合成〔9〕,高表达时会产生严重的神经毒性,加速神经细胞的死亡〔10〕。IL-1β其过量表达一方面,通过渗透进入血管外组织中,活化的白细胞释放大量的氧自由基和蛋白水解酶,损伤脑组织; 另一方面,白细胞的牢固黏附导致微血管阻塞,脑组织缺血缺氧,从而加重脑组织的损伤。其细胞因子IL-1β mRNA的表达与炎症程度呈正相关〔11〕。
IL-6作为一种重要的炎性介质,在脑损伤中对中枢神经系统影响是双向的。一方面在脑损伤的脑组织中显著增高,能促使白细胞与内皮细胞黏附,引起内皮细胞损伤,增加血脑屏障的通透性,并产生氧自由基,引起神经细胞死亡,参与继发性脑损伤的过程〔12〕,另一方面,IL-6也是一种具有神经营养和保护作用的因子。ICAM-1表达于血管内皮和白细胞表面,能够调节白细胞的渗透、迁移,对中性粒细胞具有募集作用。研究发现脑脊液中可溶性ICAM-1浓度与CT显示脑创伤范围呈正相关性,其变化水平反映颅脑损伤程度,应用ICAM-1抗体或将ICAM-1基因剔除可降低脑卒中鼠模型淋巴细胞浸润、减轻脑组织水肿及神经损伤程度,提高存活率〔13〕。
总之,损伤脑组织中 IL-1β、IL-6、IL-10、TNF-α均出现高表达,抑制炎性细胞因子表达可能有助于减轻继发性脑损伤,改善预后。
4 参考文献
1Levin H,Smith D.Traumatic brain injury: networks and neuropathology〔J〕.Lancet Neurol,2013;12(1):15-6.
2Stella N.Neuroscience inflammation to rebuild a brain〔J〕.Science,2012;338(6112):1303-4.
3孙国柱,刘性强,王目纲,等.一种大鼠液压冲击脑损伤装置的研制〔J〕.中华实验外科杂志,2011;28(5): 749-50.
4唐晓平,王远传,彭 华.颅脑损伤后炎性细胞的变化及其与继发性脑损伤的关系〔J〕.中国临床神经外科杂志,2007;12(3):406-8.
5Chaturvedi LS,Zhang P,Basson MD.Effects of extracellular pressure and alcohol on the microglial response to inflammatory stimulation〔J〕.Am J Surg,2012;204(5): 602-6.
6屈 强,史 忠.严重颅脑损伤患者早期外周血TNF-α、IL-1β、ACTH、皮质醇和淋巴细胞GR的变化〔J〕.重庆医学,2007;36 (9):1801-3.
7李小华.脑出血微创置管吸引术对老年脑出血患者血清IL-6、TNF-α和hs-CRP水平的影响〔J〕.中国老年学杂志,2013;33(7):1694-95.
8赵美玲,徐道妙.创伤性脑损伤与中枢炎症反应〔J〕.中国现代医生,2009;47(12):27-9.
9张信芳.亚低温疗法对重型脑损伤患者TNF-α、IL-6及IL-10的影响〔J〕.中国实用医药,2009;4(27):46-8.
10Oshima T,Lee S,Sato A,etal.TNF-alpha contributes to axonal sprouting and functional recovery following traumatic brain injury〔J〕.Brain Res,2009;1290(1): 102-4.
11Marks JA,Li S,Gong W,etal.Similar effects of hypertonic saline and mannitol on the inflammation of the blood-brain barrier microcirculation after brain injury in a mouse model〔J〕.J Trauma Acute Care Surg,2012;73(2):351-7.
12Wang GH,Jiang ZL,Li YC,etal.Free-radical scavenger edaravone treatment confers neuroprotection against traumatic brain injury in rats〔J〕.J Neurotrauma,2011;28(10):2123-34.
13Knoblach SM,Faden AI.Administration of either anti-intercellular adhesion molecule-1 or a nonspecific control antibody improves recovery after traumatic brain injury in the rat〔J〕.J Neurotrauma,2002;19(9):1039-50.
