抗阻训练对老年人肌肉含量与血清炎症因子水平的影响
2014-09-13李曙刚
李曙刚 周 园
(河北科技师范学院体育系,河北 秦皇岛 066004)
体内多种炎症因子水平与健康状况密切相关,例如血清白介素(IL)-6,肿瘤坏死因子(TNF)-α,C-反应蛋白(CRP)及血清淀粉样蛋白A(SAA)水平升高可促进心血管事件发生率增加〔1,2〕。感染或创伤引起多种炎症介质持续升高,将人体置于一种慢性炎症状态,进而诱导动脉粥样硬化发生,粥样硬块引起炎症细胞聚集并释放大量自由基及炎性细胞因子,这将加剧动脉粥样硬化进程及促进血栓形成〔3〕。老年群体其血清中CRP、TNF-α和IL-6水平显著增高,或许在一定程度上可解释动脉粥样硬化、2型糖尿病、高血压及其他心血管系统疾病在老年群体中的高发率〔4〕。研究还发现老年人由于神经肌肉、内分泌等各系统的变化,导致体内肌肉含量明显减少,肌肉萎缩,退化及功能衰减。规律运动可有效预防动脉粥样硬化及2型糖尿病的发生,同时也证实规律运动能够改善体内炎症状况〔5〕。很多研究者认为炎症与年龄增长诱导的肌肉力量及含量的丢失有关〔6,7〕。抗阻训练降低炎症相关疾病的发生已被研究证实〔8〕。虽然研究显示老年人体内炎症因子水平与肌肉力量及含量成反比,但抗阻训练对老年人肌肉含量及血清炎症因子的影响,及其内在关系目前尚未阐明。因此,本研究旨在探讨抗阻训练对老年人肌肉含量及血清TNF-α,CRP、SAA、IL-6的影响,并探讨肌肉含量及这些炎性因子的关系。
1 对象与方法
1.1研究对象 均为男性,年龄(65.65 ± 3.14)岁,体重(62.86 ± 7.22)kg,身高(168.41 ± 5.23)cm,体重指数(BMI)(22.23 ± 1.95)kg/m2,收缩压(SBP)(151.26 ± 13.72)mmHg,舒张压(DBP)(77.32 ± 8.34)mmHg,所有受试者身体基本健康,没有吸烟习惯,无心脑血管疾病及糖尿病,所有受试者在运动方案实施前进行常规体检,包括心电图、血尿常规、肝功能未见异常。所有受试者在平时没有规律运动的习惯。在运动方案实施期间所有受试者保持平时饮食习惯及一般的体力活动,遵守作息时间。
1.2研究方法
1.2.1运动方案设计 抗阻训练采用联合训练器械进行躯干及上下肢大肌群练习。抗阻训练共进行16 w,每周进行2次运动,每次运动间隔2~3 d,每次运动由3个循环构成,每一循环又包括10节运动,每节运动完成8次收缩,各节运动间休息30 s,每次循环间歇休息3 min。10节运动包括肩关节、肘关节、髋关节、膝关节和躯干大肌群的屈伸运动。每次训练前进行10 min的热身和柔韧性练习、训练后进行10 min的整理运动。训练时间统一安排在上午9:00~10:00进行。训练期间对所有受试者进行医务监督。
1.2.2测试指标
1.2.2.1肌肉含量的测定 肌肉含量利用生物电阻抗法测定,仪器采用Bios pace InBody3.0体成分分析仪(韩国NEOMYTH 公司),测定过程严格按照仪器使用说明书进行。本研究以四肢的骨骼肌质量来评价人体总体骨骼肌含量水平。训练完成前后2 h分别测定。
1.2.2.2血清炎性因子水平的测定 训练前后72 h,分别于清晨、空腹状态下,抽取肘静脉血3 ml,4℃环境静置后分离血清,在-20℃保存待用。血清TNF-α,CRP、SAA、IL-6的检测采用ELISA法,试剂盒购于上海逸峰生物科技有限公司。所有步骤均严格按照说明书进行。
1.2.2.3其他指标 身体形态学指标包括身高,体重,腰围;其他生理生化指标:血压,胰岛素及血糖水平。训练前后上述指标均有专人负责测试。
1.3数据处理 应用SPSS14.0 软件进行方差分析(ANOVA),配对样本t检验,并进行各指标间的相关性分析。
2 结 果
2.1训练前后受试者肌肉含量、腰围、血糖及胰岛素水平的变化 经过16 w的抗阻训练,受试者四肢骨骼肌含量与训练前相比显著增加(P<0.05),腰围和血糖水平与训练前比较没有显著变化(P>0.05),但胰岛素水平却有降低(P<0.01)。见表1。
2.2训练前后受试者血清炎性因子水平的变化 16 w抗阻训练后,受试者血清炎性因子水平都有下降的趋势,但是TNF-α和IL-6水平的变化无差异(P>0.05),而血清CRP水平显著降低(P<0.05),同时血清SAA水平的降低极为显著(P<0.01)。见表1。
2.3肌肉含量与血清炎性因子的相关性 受试者四肢骨骼肌含量的变化与CRP及SAA水平的降低呈正相关,CRP降低程度与骨骼肌含量的提高程度相关(r=0.607,P=0.01);SAA降低程度与骨骼肌含量提高程度相关(r=0.594,P=0.012)。
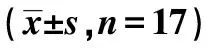
表1 受试者训练前后各指标变化
3 讨 论
老年人骨骼肌含量及力量显著减少是导致肌肉功能下降的重要原因之一〔9,10〕。而衰老和体力活动减少则是骨骼肌含量及力量下降的重要诱因,这个过程所产生的代谢效应与肥胖症、胰岛素抵抗、2型糖尿病、血脂异常及高血压等密切相关〔10〕。同时,骨骼肌功能下降还会引起老年人跌到、骨折、伤残、衰弱发生率的增加及生活质量的下降。此外,研究发现伴随着衰老发生体内炎症因子水平会明显增高。一般认为炎症是细胞衰老及机体老化的伴随反应,并起着维持和促进衰老及老化的作用。研究证实许多慢性疾病都与低度炎症有关,例如肥胖症,2型糖尿病,胰岛素抵抗,动脉粥样硬化等〔10,11〕。研究不但发现老年人血清中IL-6、TNF-α和CRP等炎性因子水平明显上升〔4〕,还发现炎症与衰老诱导的骨骼肌含量及力量的降低密切相关〔6,7〕。抗阻训练是健身运动处方中不可缺少的练习内容,其特点是能够改变体成分,显著增加骨骼肌的含量及力量。伴随着衰老的推进,日常活动提供的机械刺激难以有效地抵抗骨骼肌含量及功能的下降,规律的抗阻训练却能够减缓这个过程,成年人如果没有规律的抗阻练习,其在50岁后肌肉含量将以每年0.46 kg的速度递减,在80岁时,仅Ⅱ型肌纤维丢失量就超过了50%〔10〕。抗阻训练对人体肌肉骨骼系统所产生的有益效应主要包括能够保持骨骼肌功能,并且能够预防骨质疏松、少肌症及其伴随症〔12〕。Mathur等〔4〕的研究认为抗阻训练可有效降低慢性炎症相关疾病的发病风险。Hotamisligil〔13〕则发现抗阻训练可以显著降低血清炎性细胞因子的基础水平。由于血清炎性因子在体内炎症反应的启动过程中起重要作用,因此,其水平的高低可以预测炎症反应的发生程度。本研究结果显示经过16 w抗阻训练,老年人四肢骨骼肌含量显著增加,同时其血清CRP及SAA水平均显著降低。CRP是由一种主要由肝细胞合成的急相蛋白,是炎症或组织损伤时非特异的急性时相反应蛋白,其血清水平与局部或全身炎症反应的程度相关。正常人体中CRP含量极微,但在严重细菌感染、物理损伤、动脉粥样硬化、血管内皮损伤、组织器官老化等情况下可升高近百倍以上。虽然CRP在急性期反应中其水平显著增高,但无症状个体则较低。老年人血清CRP水平升高与心血管事件的发生率增加呈一致性〔4〕。本研究中抗阻训练对血清CRP水平的影响与Stewart等〔14〕的研究结果一致。SAA是组织淀粉样A 蛋白的前体, 在恶性肿瘤、感染等疾病可检测到,在急性时相反应中,经其他炎症因子的刺激,SAA可升高到最初浓度的数百倍,SAA水平的升高与人体器官系统炎症反应及动脉粥样硬化密切相关〔15〕。其特别重要的特性是降解产物能以淀粉样蛋白原纤维的方式沉积在不同的器官中,这在慢性炎症疾病中是严重的并发症之一。同时,SAA也经常作为心血管事件及冠心病的预测标志〔16〕。本研究发现16 w抗阻训练后,老年人血清SAA水平显著下降。上述这些结果都说明长期坚持低负荷的抗阻训练对老年人的健康有益。TNF-α是由多种细胞分泌的一种前炎性细胞因子,但主要是由巨噬细胞和淋巴细胞产生的。动物实验显示TNF-α会诱导胰岛素抵抗的发生,其可能机制与TNF-α降低胰岛素受体底物-1酪氨酸磷酸化水平有关。本研究没有发现抗阻训练对血清TNF-α水平有明显的影响。但也有研究认为抗阻训练可以使受试者血清TNF-α水平及其骨骼肌mRNA降低〔13〕。造成这种差异的原因可能是研究对象不同引起的。IL-6是由多种细胞分泌的细胞因子,在体内没有炎症状态下,约15%~30%的游离IL-6来源于脂肪组织。有研究认为在人体及动物模型的骨骼肌内IL-6的急性聚集会导致INS敏感度增强〔17〕。运动后血清IL-6水平的增加主要来源于骨骼肌,肌源性的IL-6可能会产生抑制炎症的作用,但是肌源性IL-6的释放主要由于骨骼肌收缩引起的〔18〕,因此,其在血清中的保留时间是有限的,所以本研究也并未发现受试者血清IL-6水平的显著变化。同时,本研究这说明骨骼肌含量可以在一定程度上抑制CRP和SAA的产生,对老年人心血管系统有着积极的影响。很多研究发现体脂含量可以明显影响到体内炎症状态,抗阻训练改变体成分主要是通过提高骨骼肌含量实现的,骨骼肌是人体内主要的糖脂代谢池,是机体基础代谢的主要决定因素,其含量提高可调节糖脂代谢,增加基础代谢率,改善胰岛素抵抗,从而降低了炎性因子的水平〔13〕。
本研究表明,16 w抗阻训练可以提高老年人四肢骨骼肌含量,降低血清CRP及SAA水平,显著改善老年人体内的炎症状态,提高胰岛素的敏感度。抗阻训练对老年人的抗炎作用可能在一定程度上与训练诱导的骨骼肌含量增加有关。
4 参考文献
1Khuseyinova N,Koenig W,Braith RW,etal. Biomarkers of outcome from cardiovascular disease 〔J〕. Cur Opin Crit Care,2006;12(5):412-9.
2Cesari M, Penninx BW,Newman AB,etal. Inflammatory markers and onset of cardiovascular events 〔J〕. Circulation,2003;108(19):2317-22.
3Libby P, Ridker PM. Novel inflammatory markers of coronary risk 〔J〕. Circulation,1999;100(11): 1148-50.
4Ridker PM, Hennekens CH, Buring JE,etal. C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women 〔J〕. New Engl J Med,2000;342(12): 836-43.
5Wilund KR. Is the anti-inflammatory effect of regular exercise responsible for reduced cardiovascular disease 〔J〕. Clin Sci,2007;112(11):543-55.
6Marjolein Visser, Saskia MF,Pluijm V,etal. Physical activity as a determinant change in mobility performance: the longitudinal aging study Amsterdam 〔J〕.J Am Geriatr Soci,2002;50(11): 1774-81.
7Schrager MA, Metter EJ, Simonsick E,etal. Sarcopenic obesity and inflammation in the InCHIANTI study 〔J〕.J App Physiol,2007;102 (3): 919-25.
8Mathur N,Pedersen BK. Exercise as a mean to control low-grade systemic inflammation 〔J〕. Media Inflam,2009;2008(2): 1-6.
9Hurley BF, Roth SM. Strength training in the elderly: effects on risk factors for age-related diseases 〔J〕.Sports Med,2000;30(4):249-68.
10Porter MM,Vandervoort AA,Lexell J.Aging of human muscle: structure, function and adaptability 〔J〕. Scandinavian J Med Sci Sports,1995;5(3): 129-42.
11Hae Young Chung, Matteo Cesari, Stephen Anton,etal. Molecular inflammation:underpinnings of aging and age-related diseases 〔J〕. Ageing Res Rev, 2009;8(1): 18-30.
12Braith RW,Stewart KJ. Resistance exercise training: its role in the prevention of cardiovascular disease 〔J〕. Circulation, 2006;113:2642-50.
13Hotamisligil GS. Inflammation and metabolic disorders 〔J〕. Nature, 2006;444(7121):860-7.
14Stewart LK, Flynn MG,Campbeu WW,etal. The influence of exercise training on inflammatory cytokines and C-reactive protein 〔J〕. Med Sci Sports, 2007,39(10): 1714-9.
15Wu TL, Chen IT ,Chang PY,etal. Establishment of an in-house ELISA and the reference range for serum amyloid A (SAA):complementarity between SAA and C-reactive protein as markers of inflammation 〔J〕. Clinica Chimica Acta, 2007;376(1): 72-6.
16Steven ES, Laura H, Afia N. Obesity, inflammation, and insulin resistance 〔J〕. Gastroenterol, 2007;132(6): 2169-80.
17Rebekah LC, Winston SC, Steven CE. Retinol binding protein 4 as a candidate gene for type 2 diabetes and prediabetic intermediate traits 〔J〕. Molecular Genetics Metab, 2007;90(3): 338-44.
18Pedersen BK, Fischer CP. Physiological role of muscle-derived interleukin-6 in response to exercise 〔J〕. Curr Opin Clin Nutr Metab Care, 2007;10(3): 265-71.
