体外联合培养体系中人脐静脉内皮细胞对人骨髓间充质干细胞成骨分化的影响及机制
2014-09-13刘之川简华刚王丽华
刘之川 简华刚 王丽华 梅 英
(重庆医科大学附属第二医院创伤烧伤科,重庆 400010)
本实验着重研究人脐静脉内皮细胞(hUVECs)在人骨髓间质干细胞(hBMSCs)体外联合培养中,对于hBMSCS的生长、形态以及细胞分化所产生的影响,并且对hUVECs在联合培养体系中对hBMSCs的Runx2与Bmi-1基因表达的作用。
1 实验方法
1.1骨髓间充质干细胞(BMSCs)与脐静脉内皮细胞(UVECs)的培养 将hBMSCs进行分离,并将其培养至第3代,然后在显微镜下倒置观察其细胞的形态结构。选择ATCC人脐静脉血管的内皮细胞系来作为hUVECs的来源,并在低血清培养基当中,放置在37℃,5%CO2饱和湿度的培养箱中进行培养,将其培养至第3代,并对各细胞的形态结构进行观察。
1.2建立联合培养装置 选用培养至第3代的人hBMSCs和hUVECs,准备6孔板,将6孔板置入插入式的培养皿当中,建立培养液和使细胞因子能够互相通连的联合培养装置,设单独hBMSCs组、单独hUVECs组及hUVECs组与hBMSCs1∶1联合培养,分别将其编号为1、2、3。在每孔中置入含有10%胎牛血清的L-DMEM液2 ml,并于隔日对液体进行置换,将样本放置于37℃,5%CO2饱和的湿度培养箱当中进行培养。分别在第4、6、8、10天在显微镜下对联合培养的细胞形态的变化进行倒置观察。
1.3细胞的生长曲线 分别在进行培养后的第1、2、3、4、5、6、7、8、9、10天各取每组1孔,用胰酶进行消化之后对1套联合培养装置中hBMSCs计数,并描绘出hBMSCs的生长曲线。
1.4对Bmi-1、Runx2基因的定量检测 分别在第4、6、8、10天对1.2中的各组6孔板各取6孔,采用荧光定量PCR(FQ-PCR)的方法,对各组中的Bmi-1、Runx2基因的相对表达量进行检测。具体的检测步骤操作如下。
1.4.1标本的收集 将Trizol试剂在6孔培养板当中的每孔中加入1 ml,然后对细胞使用移液枪进行反复的吹打之后装入1.5 ml的离心管中,保持在-80℃的冰箱当中。
1.4.2总RNA提取 ①在每毫升的Trizol当中加入0.2 ml的氯仿,vortex以15 s进行混匀或是晃动,在室温下放置2 min到3 min;②进行15 min的12 000 r/min 4℃离心,然后将含总RNA的上层水相吸取至一个新的离心管当中,每毫升的Trizol大约可以吸取到0.5~0.55 ml;③按照最初的每毫升的Trizol当中加入0.5 ml的异丙醇,并进行数次的颠倒以混匀,再在室温下进行10 min的沉淀;④在进行10 min的12 000 r/min 4℃离心,可在管底见RNA的沉淀,将上清弃掉;⑤将1 ml的75%乙醇加入每毫升最初的Trizol当中,vortex或是进行颠倒以将液体混匀,在进行5 min的7 500 r/min 4℃离心,将上清弃掉。再使用离心机将其轻甩一下,并将液体小心的吸尽;⑥待到RNA略微干了之后,加入20 L DEPC水溶解,并在-70℃条件下进行冻存。值得注意的是,要避免RNA过分的干燥,否则会不利于进行溶解,同时测出的A260/280的值也会比1.6低。
1.4.3逆转录 分别从两组的细胞当中对总RNA进行提取,并将其合成为cDNA。严格按照用逆转录试剂的说明书来进行操作。
1.4.4引物设计 β-actin、 Runx2、Bmi-1基因的引物以及PCR扩增的产物的长度的具体数据如下表1中所示。

表1 Bmi-1、Runx2、β-actin引物
1.4.5对样本的cDNA纯度与浓度的检测 对各样本的纯度与浓度采用核酸蛋白检测仪进行检测。
1.4.6对引物及模板的验证 在每次进行操作之后,对样本进行随机的抽取,选取5~8例,对样本采用电泳分析法,以检测看家基因-actin、Bmi-1、Runx2的PCR扩增的产物。
1.4.7PCR扩增 对所有的单管样本全部复设3孔。并根据具体的扩增反应对溶解曲线进行分析,以对扩增反应的特异性进行检测。

2 结 果
2.1细胞形态观察 当第3代的hBMSCs与HUVECs进行联合培养到第4天时,细胞的形态呈现出多样化的变化,出现梭形与多角形的混合生长,梭形多如图1所示;培养到第6天时细胞的体积如图1中所示表现有明显的增大;培养到第8天的时候有部分细胞如图1中所示开始出现连接的现象;培养到第10天的时候细胞如图1中所示失去了接触抑制进而形成了细胞的团块。
2.2两组中hMSCs生长曲线 hMSCs组与联合培养组相比其数据具有统计学意义(P<0.05),见表2。
2.3对碱性磷酸酶(ALP)的定量检测 各组检测的ALP的量随着时间的延长呈现出先增高而后逐渐减低的趋势,在第8天联合培养组的ALP量达到最高;而hBMSCs组与单独hUVECs组在各个时间点所检测到的ALP的量并没有明显的变化,见表3。
2.4荧光定量PCR扩增结果 联合组Bmi-1检测量随时间的延长先增高后降低,第8天时联合培养组Bmi-1最高;联合组与单独hMSCs组在各时间点差异较明显;单独hMSCs组Bmi-1在各时间点没有明显变化。
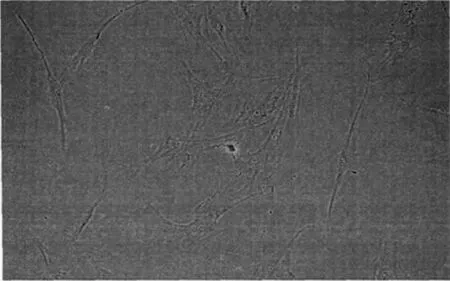
第4天

第6天

第8天
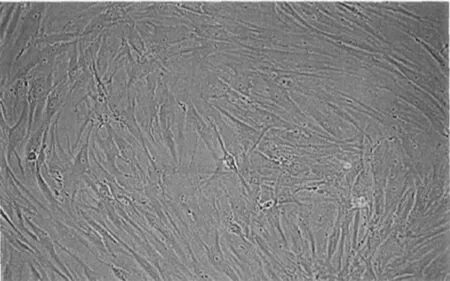
第10天


组别时间(d)1 2 3 4 5时间(d)6 7 8 9 10联合培养组3.0±0.133.4±0.345.7±0.097.7±0.1916.9±0.1520.6±0.2123.7±0.2224.6±0.4125.4±0.2425.1±0.11单独hMSCs组3.1±0.223.4±0.254.0±0.205.5± 0.2612.1±0.17117.0±0.3220.0±0.1522.9±0.3024.4±0.2124.3±0.22

表3 各细胞培养各时间点ALP含量(n=6,±s)

表4 各细胞培养组各个时间的Bmi-1含量(n=6,±s)
联合组Runx2检测量随时间延长先增高后降低,第8天时联合培养组Runx2最高;联合组与单独hMSCs组在各时间点差异较明显;单独hMSCs组Runx2在各时间点没有明显变化。见表5。

表5 各细胞培养组各个时间点的Runx2含量(n=6,±s)
3 讨 论
在体内由于hBMSCs所定居的位置的不同,同时又由于在微环境当中的细胞因子、生长因子等起调控作用物质的不同,可以使hBMSCs向不同的谱系进行分化,并且可以跨胚层进行分化。研究hBMSCs细胞周期表明,有大约20%的hBMSCs是处于G0期,表明hBMSCs是具有着十分强大的增殖能力与分化能力〔1〕。经研究表明,hBMSCs在进行了12代的体外培养之后仍然能够保持着正常的端粒酶活性以及染色体表型,在经过15代的培养之后仍然能够保持其自身的成骨分化的潜能。在对hBMSCs进行深入研究之后表明,在动物体内的骨祖细胞存在2种类型:一是仅仅在骨髓中存在的,不需要诱导物就可以自动进行分化的成骨干细胞,因此而被称为定向性成骨母细胞,定向性成骨母细胞的特点是处于胚胎期的间充质祖细胞存留在骨内;其二是必须由外源性的诱导物对其发生作用才可以被诱导分化成为成骨间充质干细胞,因此称为诱导型成骨母细胞〔2〕。诱导型成骨母细胞不能够自发形成骨组织,它必须在外源性的诱导物持续的作用之下才能够定向的分化成为骨组织。hBMSCs分化成为成骨细胞中的定向诱导既能够通过化学药物来实现,同时也可以通过细胞因子或是生长因子的作用来实现〔3〕。
多梳基因家族在果蝇发育是发挥使同源异形基因维持稳定表现的重要因子〔4〕。Bmi-1基因中有一个环指模序,它主要存在于N-末端环指结构域之中,同抑癌基因C-Myc在肿瘤形成和细胞增殖中发挥着协同的作用〔5〕。Bmi-1基因通过其环指结构同其他的环指蛋白相互结合,例如dinG等所形成的异源二聚体,进而对其靶基因的转录发挥抑制的作用。在Bmi-1基因中心还存在着一个保守DNA结合模序,螺旋-转角-螺旋-转角(H-T-H-T),也发挥着转录抑制的作用〔6〕。本研究结果提示Bmi-1基因两个结构在细胞生存期的延长和抑制p16上都发挥着不可或缺的作用,若将这两个结构敲除,那么Bmi-1基因将会失去其活性,进而导致早衰的现象出现〔7〕。在多细胞生物整个生命周期中,干细胞将会产生分化细胞的类型,进而对生物体最终的寿命起决定作用。经研究表明,经过纯化的鼠与人造血干细胞同样对Bmi-1的表达都具有十分高的水平〔8〕。Qiao等〔9〕在从脐带中分离出的间质干细胞上同样也发现了Bmi-1的表达。通过Bmi-1对能够决定干细胞命运的基因如干细胞、抗增殖基因以及生存基因等相关基因发挥控制作用从而对HSC的自我更新发挥调节的作用。
Runx2属于转录因子RUNXX家族中的成员之一,它作为成骨细胞特异转录因子,对于骨组织的形成以及重建发挥着十分重要的作用。Runx2具有3种类型的异构体〔10〕,它们分别具有不同的N-端序列。这3种类型分别是以MRIPVD作为起始的氨基酸序列的Ⅰ型,和以MASNSL作为起始的氨基酸序列的Ⅱ型以及以MLHSPH作为起始的氨基酸序列的Ⅲ型。Runx2对多能干细胞分化成为成骨细胞起着决定性的作用,Komori等〔11〕采取将目的基因敲除的方法发现,由于在敲除之后不能有效的分化成为成骨细胞,使得具有RUNX2缺陷的小鼠膜内软骨和内骨不能分化成骨,由此证实了RUNX2在成骨细胞分化的过程中是所一个必不可少的因子。RUNx2的表达比软骨细胞分化成为肥大软骨细胞要早〔12〕,由此说明了RUNXX蛋白能够在软骨形成的早期阶段参与。
体外联合培养体系中,hBMSCs同hUVECs具有良好的相容性,且hUVECs能够对hBMSCs的增殖起到促进的作用。
4 参考文献
1Du ZH,Wang HL,Song J,etal.Biological characteristics and application of adult bone marrow mesenchymal stem cells in tissue engineering and regenerative medieine〔J〕.J Clin Rehab Tissue Eng Res,2009;13(33):6553-4.
2Mauney JR,Sjostorm S,Blumberg J,etal.Mechanical stimulation promotes ostcogenic differentiation of human bone marrow stromal cells on 3-D partially demineralized bone scaffold in vitro〔J〕.Calcif Tissue Int,2004;74(5):458-68.
3Velazquez OC,Snyder R,Liu ZJ,etal.Fibroblast-dependent differentiation of human Microvascular endothelial cells into capillary-like 3-dimensional networks〔J〕.Faseb J,2002;16(10):1316-8.
4Villars F,Bordenave L,Bareille R.Effect of human endothelial cells on human bone Marrow stromal cell phenotype:role of VEGF〔J〕.J Cell Bio chem,2000;79(4):672-85.
5Finkenzeller G,Arabatzis G,Geyer M,etal.Gene expression profiling reveals platelet-derived growth factor receptor alpha as a target of cell contact-dependent gene regulation in an endothelial cell-osteoblast co-culture model〔J〕.Tissue Eng,2006;12(10):2889-903.
6Dimri GP,Martinez JL,Jacobs JJ,etal.The Bmi-1 oncogene induces telomerase activity and immortalizes human mammary epithelial cells〔J〕.Cancer Res,2002;62(16):4336-45.
7Itahana K,Zou Y,Itahana Y,etal.Control of the replicative life span of human fibroblasts by p16 and the poly comb protein Bmi-1〔J〕.Mol Cell Biol,2003;23(1):389-401.
8Park IK,Qian D,Kiel M,etal.Bmil is required for maintenance of adult self-renewing haematopoietic stem cells 〔J〕.Nature,2003;423(6937):302-5.
9Qiao C,Xu W,Zhu W,etal.Human mesenchymal stem cells isolated from the umbilical cord〔J〕.Cell Biol Int,2008;32(1):8-15.
10Stock M,Otto F.Control of RUNX2 isoform expression:The role of promoters and enhancers〔J〕.J Cell Biochem,2005;95(3):506-17.
11Komori T.Regulation of skeletal development by the RUNX family of transcription factors〔J〕.J Cell Biochem,2005;95(3):445-53.
12Terry A,Kilbey A,Vaillant F,etal.Conservation and expression of an alternative 3' exon of RUNX2 encoding a novel proline-rich C-terminal domain〔J〕.Gene,2004;336(1):115-25.
