食管癌调强放疗肿瘤退缩规律及其临床价值
2014-09-12唐华燕唐朝晖黄洪林
唐华燕 唐朝晖 黄洪林
食管癌是临床常见的恶性肿瘤之一,临床发病率和死亡率较高,多数患者确诊后即已至晚期,生存时间较短[1]。目前放射治疗是治疗中晚期食管癌的主要手段。现回顾性分析我院行调强放疗的食管癌患者放疗过程中肿瘤退缩的规律,为提高放疗准确性、降低周围组织受量提供研究依据,报告如下。
1 资料与方法
1.1 一般资料
选取2012年5月至2013年5月我院收治的38例食管癌患者作为研究对象。所有患者均符合中国抗癌协会食管癌专业委员会出版的《食管癌规范化诊治指南》[2]中食管癌相关诊断标准。患者年龄为42~76岁,平均年龄为(57.85±6.77)岁。原发肿瘤参照食管癌TNM分期标准[3]进行非手术T分期,为T2~T4期。排除合并其他恶性肿瘤或不能够完成放疗或新辅助联合放化疗计划者。38例中男性30例,女性8例;病理类型:鳞状细胞癌37例,小细胞癌1例;肿瘤部位:颈+胸上段17例,胸中段18例,胸下段3例;X线分型:髓质型33例,溃疡型4例,蕈伞型1例;非手术T分期:T2期13例,T3期16例,T4期9例;治疗方式:单纯放疗13例,同期放化疗25例;病变长度:<5 cm 17例,≥5 cm 21例。
1.2 方法
1.2.1 CT定位 所有患者放疗前均取仰卧位,使用GE64排螺旋CT扫描仪进行模拟定位。扫描范围为锁骨上至肝门水平区域,间隔5 mm重建后将信息传递至Varian-TPS三维治疗计划系统[4]。
1.2.2 确定靶区、拟定放疗计划 使用3D-TPS逐层勾画GTV及周围危及器官(包括心脏、肺部等),明确病变部位、长度及原发范围,并使用3D-TPS对放疗前GTV大小进行计算[5]。将GTV左右各扩展0.5~0.8 cm,上下各扩展2.0~3.0 cm作为临床靶区(clinical target volume,CTV),同时参考转移肿大淋巴结所累及区域和解剖结构对靶区进行适当调整。将CTV左右各扩展0.5~0.8 cm,上下各扩展1.0~1.5 cm作为计划靶区(planning target volume,PTV)。
1.2.3 处方剂量及危及器官限量 常规分割,1.8~2.3 Gy/次,5次/周,处方剂量为50~62 Gy,中位剂量为54 Gy。两肺V20≤30%,V30≤20%;脊髓最大剂量≤45 Gy;心脏V50≤50%[6]。
1.3 观察指标
所有患者均于外照射前、照射至中位剂量32 Gy时、放疗结束时、放疗后6个月内分别进行CT及X线钡餐造影检查,记录患者GTV变化情况,并以此计算放疗前半程、放疗后半程和放疗全程VRR。
计算公式:VRR=(pGTV-iGTV)/pGTV[7]。pGTV为放疗前大体肿瘤体积;iGTV为放疗后大体肿瘤体积。
1.4 统计学分析

2 结果
2.1 不同放疗时段患者GTV变化情况
所有患者外照射前、照射至中位剂量32 Gy时、放疗结束时及放疗后6个月GTV见表1。随着放疗进行,患者GTV逐渐缩小。完成6个月随访的32例患者中6例较放疗结束时GTV有所增加,18例有所减小,8例基本不变。

表1 不同放疗时段患者GTV变化情况/ml
2.2 患者放疗过程中肿瘤VRR
根据VRR计算公式得到放疗前半程、放疗后半程和放疗全程VRR值(表2)。放疗前半程患者VRR明显高于后半程,差异具有统计学意义(P<0.05)。
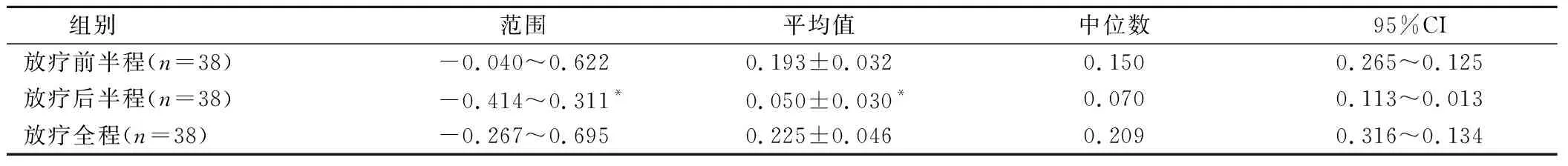
表2 患者放疗过程中肿瘤VRR/%
注:*为与放疗前半程VRR比较,P<0.05。
3 讨论
临床研究表明,食管癌患者肿瘤容积效应与放射性抵抗、乏氧及远处转移均有紧密联系,肿瘤负荷增加产生的副作用是影响肿瘤控制率的重要因素[8]。肿瘤体积也是影响预后的主要因素,患者肿瘤体积越小,表明治疗效果越好,局部控制率和长期生存率较高。患者GTV越大,表示肿瘤细胞数量越多,更易引起肿瘤内血运障碍、乏氧细胞增加甚至肿瘤中心坏死,而乏氧细胞增多会引发肿瘤侵袭性增加,对放疗的抗拒增加,影响治疗效果[9]。本研究中38例患者,随着放疗的逐步进行,肿瘤体积不断缩小,与上述文献报道相似,表明放射治疗对减小肿瘤体积具有显著效果。
肿瘤的体积变化情况不仅是放射治疗的监测指标,也是诊断食管癌临床分期和评估放疗效果的重要指标。临床研究表明,患者GTV缩小后肿瘤横径及前后径均会产生变化,此时仍按照放疗前测定的靶区和剂量采取常规调强放射治疗,易造成沉淀剂量明显改变[10],需要重新进行CT模拟定位,调整靶区治疗计划。螺旋CT增强扫描和容积扫描能够准确显示患者食管壁厚度、食管外浸润、淋巴结转移以及食管壁异常增强,不仅能够为放疗前食管癌诊断和TNM分期提供依据,还能为设计放疗计划和评估放疗效果提供参考。本研究中使用螺旋CT扫描技术为放疗进行指导,同时也为放疗患者的疗效进行评估。
随着自适应放疗观念被临床医师广泛认可,将影像学设备与放疗结合,随时修整靶区和剂量,以减少周围正常组织受照剂量和并发症发生率已经成为了临床研究的热点。临床研究表明,食管癌患者放疗过程中同时存在肿瘤退缩和靶区移位的情况,尤其是当照射剂量超过40 Gy时中心移位率更高[11]。采用自适应放疗提高了放疗的准确性,更加适应放疗过程中肿瘤和危及器官区的变化情况。
本研究结果显示,放疗前半程患者VRR明显高于后半程,差异具有统计学意义,表明患者肿瘤退缩主要发生在放疗前半程,放疗师需及时根据影像学检查结果调整靶区及放射剂量,保证在靶区高剂量照射的同时降低周围组织受量。
[1] 孙苏平,杨鸿鹏,黎 功,等.中国非手术治疗食管癌研究进展〔J〕.癌症进展,2008,6(1):30-35,52.
[2] 中国抗癌协会食管癌专业委员会.食管癌规范化诊治指南〔M〕.北京:中国协和医科大学出版社,2011:8-12.
[3] 陈龙奇.制订2009第7版食管癌TNM分期标准〔J〕.中国胸心血管外科临床杂志,2008,15(1):52-55.
[4] 施 怡,颜志勇,谢伯军,等.食管癌CT表现及其对放疗的预测价值〔J〕.实用癌症杂志,2013,28(1):73-76.
[5] 张先稳,张西志,花 威,等.AAA算法和PBC算法在食管癌调强放疗中的验证评估〔J〕.实用癌症杂志,2013,28(3):282-284.
[6] 葛小林,孙新臣,陈文湛,等.胸上段食管癌调强放疗和三维适形放疗剂量学研究〔J〕.中国医学物理学杂志,2010,27(2):1708-1711,1720.
[7] Hsu WH,Hsu PK,Hsieh CC,et al.The metastatic lymph node number and ratio are independent prognostic factors in esophageal cancer〔J〕.J Gastrointest Surg,2009,13(11):1913-1920.
[8] 王 军,韩 春,李晓宁,等.食管癌调强放射治疗初期疗效分析〔J〕.癌症,2009,28(11):1138-1142.
[9] 程 岩,王丽梅,张雪彬,等.食管癌调强放疗疗效和预后因素分析〔J〕.疾病监测与控制,2013,7(8):505-506.
[10] Yang SN,Liao CY,Chen SW,et al.Clinical implications of the tumor volume reduction rate in head-and-neck cancer during definitive intensity-modulated radiotherapy for organ preservation〔J〕.Int J Radiat Oncol Biol Phys,2011,79(4):1096-1103.
[11] 孙 军,张 强,祝 晨,等.胸中段食管癌调强放疗近期疗效观察〔J〕.肿瘤防治研究,2012,39(3):318-320.
