新辅助化疗单用及联合术前放疗治疗宫颈癌的疗效对比分析
2014-09-12郭芝亮龙燕芬
郭芝亮 季 冰 龙燕芬
本研究分析了新辅助化疗与术前放疗对宫颈癌手术治疗效果的影响,探讨宫颈癌术前治疗的合理方案。
1 资料与方法
1.1 一般资料
选择2010年11月-2012年12月间95例宫颈癌患者作为本次前瞻性研究的对象,研究期间失访5例,最终入组90例。将90例患者随机分为给予新辅助化疗联合放疗的观察组以及仅给予新辅助化疗的对照组,每组各45例。观察组患者年龄43~59岁、平均(49.33±7.86)岁;对照组患者年龄42~60岁、平均(48.92±7.32)岁。两组患者一般资料差异无统计意义(P>0.05)。
1.2 治疗方法
观察组患者给予新辅助化疗联合术前放疗。化疗方案:顺铂(DDP)20 mg/m2、静脉滴注、每周第1~5天给药;紫杉醇(TAX)90 mg/m2、静脉滴注、每个疗程的第1、8天给药。28天为1个治疗周期,共进行4个疗程的治疗。放疗方案:腔内后装放疗,放射源为钴60、剂量率为100 cGy/min,每周宫腔及隐刀腔内各放疗1次,A点剂量为5 Gy、总剂量为50 Gy/35 d。对照组患者仅给予新辅助化疗,方案与观察组相同。
1.3 观察指标
1.3.1 2组患者的治疗后肿瘤分期情况 根据术中情况并参照宫颈癌2009 FIGO分期法判断肿瘤分期:Ⅰ期:肿瘤局限于子宫颈范围;Ⅱ期:肿瘤累及子宫颈及阴道的上2/3;Ⅲ期:肿瘤累及子宫颈及阴道的下1/3;Ⅳ期:肿瘤侵犯膀胱黏膜或者直肠黏膜。
1.3.2 2组患者的肿瘤内分泌指标 术前1周时,采集2组患者的外周血5 ml、EDTA抗凝后于4 ℃、3 000 rpm离心10 min,收集血清检测肿瘤内分泌指标VEGF、sVEGF-1。检测方法:酶联免疫吸附法,检测试剂:VEGF、sVEGF-1的Elisa试剂盒。
1.3.3 2组患者的疗效相关指标 观察2组患者的疗效相关指标,包括手术相关指标和远期预后指标。其中,手术相关指标包括手术时间、术中出血量、术后引流量;远期预后指标包括局部复发例数、远处转移例数以及5年内存活例数。
1.3.4 2组放化疗前后生存质量比较 治疗后1个月,采用生活质量核心量表(QLQ-C30)进行测评,分值越高,生活质量越好。
1.3.5 不良反应比较 观察2组患者在化疗中出现的恶心呕吐、神经毒性、肾功能损害、肝功能损害例数。
1.4 统计学方法

2 结果
2.1 2组患者的肿瘤分期及肿瘤内分泌指标
治疗后,观察组肿瘤分期好于对照组,差异有统计学意义(χ2=8.942,P<0.05);肿瘤内分泌指标VEGF低于对照组、sVEGFR-1高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 2组患者的疗效相关指标
观察组手术时间、术中出血量、术后引流量均高于对照组,差异均有统计学意义;术后局部复发(8.89%)、远处转移(6.67%)等明显低于对照组,5年生存率(93.33%)明显高于对照组(P<0.05)。见表2。

表1 治疗后观察组和对照组患者的肿瘤内分泌指标比较

表2 观察组和对照组患者术前治疗疗效相关指标
2.3 生存质量
观察组与对照组治疗后躯体功能、心理功能、社会功能、总体生活质量均明显优于治疗前;观察组治疗后躯体功能(73.45±8.24)、心理功能(58.42±6.28)、社会功能(56.84±6.14)、总体生存质量(82.08±6.65)明显高于对照组(P<0.05),见表3。
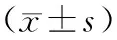
表3 观察组与对照组患者术前治疗前后生存质量评分比较
注:*为与治疗前比较,P<0.05;#为与对照组治疗后比较,P<0.05。
2.4 不良反应比较
观察组出现恶心呕吐(11.11%)、神经毒性(22.22%)、肝功能损害(11.11%)、肾功能损害(13.33%)均明显少于对照组(P<0.05)。见表4。

表4 观察组和对照组不良反应比较(例,%)
3 讨论
宫颈癌是女性常见的恶性肿瘤之一,具有发病率高、疾病发展快、5年生存率低的流行病学特征。由于该病早期无特异性的临床症状,容易与宫颈炎等良性疾病相混淆,多无法引起患者的足够重视;而当出现明显症状时,肿瘤多已发展至晚期,患者多错过了手术切除的最佳时机[1]。在临床中,针对上述情况需要通过放化疗来降低肿瘤分期、缩小瘤体体积来为患者争取手术治疗的机会[2]。
在上述研究中,我们分析了新辅助化疗与术前放疗对宫颈癌手术治疗效果的影响。新辅助化疗是由Skarin提出的1种在恶性肿瘤手术治疗前采用的全身性化疗,能够发挥杀灭肿瘤细胞、减小瘤体体积、降低肿瘤分期的作用,进而增加手术切除治疗中对肿瘤的根治率[3]。放射治疗则通过局部给予放射线来干扰DNA的复制过程,进而诱导细胞发生凋亡,同样也能起到杀灭肿瘤细胞、减小瘤体体积[4]。通过观察治疗后的肿瘤分期可知,观察组TNMⅠ期3例、Ⅱ期11例、Ⅲ期18例、Ⅳ期13例,肿瘤分期好于对照组。这就说明新辅助化疗联合放疗能更有效地降低肿瘤分期[5]。
宫颈癌的瘤体本身具有极强的内分泌功能,会产生大量的细胞因子来参与肿瘤的浸润过程。其中,血管内皮生长因子VEGF是参与肿瘤血管、淋巴管生成的一类重要细胞因子,能够通过血液循环播散并与周围组织细胞膜上的受体结合来发挥生物学作用[6];sVEGFR-1则是1种可溶性的受体,能够在外周血中与VEGF结合来拮抗其生物学作用。由此我们也可以看出,VEGF、sVEGFR-1与肿瘤新生血管形成、向周围组织浸润的过程密切相关,且作用互相拮抗,VEGF含量越低、sVEGFR-1含量越高,说明肿瘤的浸润能力越弱、治疗效果越好[7]。通过观察治疗后的两项指标,我们可以发现:观察组的肿瘤内分泌指标VEGF低于对照组、sVEGFR-1高于对照组。这就说明观察组患者的治疗效果更好、肿瘤浸润能力更弱。
但是,近年来的相关临床研究发现,联合放化疗虽然能够有效地降低肿瘤分期、减弱肿瘤浸润能力,但是局部化疗却会对宫颈局部的组织、黏膜造成损伤,使局部出现组织粘连、增加血管脆性[8]。这些因素都会影响手术治疗的过程。在本研究中,通过对手术相关指标的观察也能发现,观察组患者的手术时间、术中出血量、术后引流量均高于对照组。这就说明观察组患者手术历时时间更长、术中损伤更大、出血更多,其原因与术前局部放疗有密切关系。同时随访患者的远期预后情况,结果可知:观察组术后局部复发例数、远处转移例数少于对照组,5年内存活例数多于对照组。
综上所述,新辅助化疗联合放疗能有效降低肿瘤分期、减弱肿瘤浸润能力、防止术后复发和转移。
[1] 宋红林,黄清华,李 力,等.新辅助介入化疗在局部晚期宫颈癌治疗中的价值〔J〕.中国肿瘤临床,2012,39(5):283-286.
[2] 唐之雅,涂青松,吕如飞.局部晚期宫颈癌同步放化疗临床观察〔J〕.中国肿瘤临床与康复,2011,18(1):43-45.
[3] 饶卫农.宫颈疾病妇女HPV感染现状及基因型的分布〔J〕.中国现代医学杂志,2012,22(19):50-54.
[4] 姚霁航,郭科军.新辅助化疗对局部晚期子宫颈鳞癌近期疗效的分析〔J〕.中国医科大学学报,2012,41(9):834-837.
[5] 柯庆华,周世琼,杜 伟,等.同步放化疗联合重组人血管内皮抑制素治疗中晚期宫颈癌52例疗效分析〔J〕.实用癌症杂志,2012,27(4):373-375.
[6] 仇龙山,彭素蓉.巨块型Ⅰb、Ⅱa宫颈癌的术前处理方式探讨〔J〕.实用癌症杂志,2009,24(6):632-634.
[7] 蔡玉梅,秦玉坤,姚 嫱,等.晚期宫颈癌放射治疗进展〔J〕.现代肿瘤医学,2010,18(7):1440-1444.
[8] 朱慧庭,李淑霞.宫颈毛玻璃细胞癌五例临床病理分析〔J〕.中华病理学杂志,2011,40(8):523-527.
