敲低hnRNP H基因对子宫内膜癌细胞侵袭转移的影响
2014-09-12赵向寨
赵向寨 吕 欣 王 璟 田 瑛
(河北医科大学第三医院,河北 石家庄 050051)
子宫内膜癌是女性生殖道恶性肿瘤,占女性癌症6%〔1〕。肿瘤的预后与肿瘤细胞的恶性程度、侵袭、迁移能力息息相关〔2〕。探寻新的指标研究子宫内膜癌的高侵袭性、高迁移性是目前临床专家的热点问题。本研究沉默核不均一性核糖核蛋白H(hnRNP H)基因转染至子宫内膜癌Ishikawa细胞,观察沉默hnRNP H对子宫内膜癌Ishikawa细胞迁移及侵袭能力的影响,检测有关侵袭、迁移蛋白E-钙黏着蛋白(E-cadherin)、神经型钙黏着蛋白(N-cadherin)、基原金属蛋白酶(MMP)-2及MMP-7的变化。
1 材料与方法
1.1材料 人子宫内膜癌细胞株Ishikawa购于中国科学院上海细胞库,DMEM培养基、胎牛血清、胰蛋白酶购自GIBCO公司;hnRNP H siRNA、Control siRNA-A、siRNA转染试剂购自Santa Cruz公司;E-cadherin、N-cadherin、MMP-2及MMP-7抗体购北京中山金桥有限公司。
1.2细胞培养 人子宫内膜癌Ishikawa细胞株由中国科学院上海细胞库提供,细胞经10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素DMEM培养基培养,37℃、5%CO2饱和度和湿度恒温培养箱中孵育。0.25%胰蛋白酶消化细胞传代,取对数生长期细胞。胰酶消化细胞计数,稀释细胞,使细胞密度为4×105个/ml,铺于无菌6孔培养板中,培养12 h至Ishikawa细胞融合率达50%,弃去原细胞培养液,换无血清DMEM培养液,按转染试剂盒说明书要求用Transfection regent稀释hnRNP H siRNA、Control siRNA及转染试剂Transfection medium/regent。实验分组:正常培养Ishikawa细胞组(control)、转染hnRNP H siRNA细胞组、转染Control siRNA细胞株。转染试剂作用6 h,无血清培养基冲洗细胞,换含血清、抗生素培养基继续培养。于转染24 h后,分别搜集细胞提取总RNA及总蛋白待测。
1.3实时定量PCR检测hnRNP H、E-cadherin、N-cadherin、MMP-2及MMP-7 mRNA表达 转染后24 h,提取总RNA,测定A260/A280值介于1.8~2.0间。以β-actin作为内参,总RNA 浓度为1 mg/ml进行逆转录,将cDNA为模版进行PCR反应,PCR反应条件:预变性95℃ 10 s,95℃ 5 s,60℃ 30 s,目的基因30个循环,内参循环数设定为25个循环。扩增完毕,溶解曲线进行分析,以β-actin为内参,利用CT值计算各组hnRNP H mRNA相对值。用2-△△CT表示。各目的基因引物序列hnRNP H:5′-TGCCAAATATGAATAACGACCCA-3′,5′-GAGAAA AGTGCTCGTCACTGT-3′,E-cadherin:5′-CATCTCAAGCTCGCGGATAA-3′,5′-CACCGTTCTCCTCCGTAGAAA-3′,N-cadherin:5′-CAACTTGCCAGAAAACTCCAGG-3′和5′-ATGAAACCGGGCTA TCTGCTC-3′,MMP-2:5′-CTATTCTGCCAGCACTTTGG -3′和5′-CAGACTTTGGTTCTCCAACTT -3′,MMP-7:5′-TGG GAACAGGC TCAGGACTATCT-3′和5′-TTCGGGTCTACACCTCACGG-3′,内参引物序列5′-GGTCCTACGTTCACCAACACA -3′ 5′-CTCTGGGTCACATGGCTCT -3′。
1.4Western印迹法检测hnRNP H、E-cadherin、N-cadherin、MMP-2及MMP-7 蛋白表达 转染24 h后,提取各组细胞,预冷磷酸盐缓冲液(PBS)洗涤,于冰上进行操作,细胞裂解液裂解细胞,提取蛋白,二喹啉甲酸(BCA)法蛋白定量,各组取等量细胞总蛋白于12%+二烷基硫酸钠-聚丙烯酸胺凝胶(SDS-PAGE)电泳分离蛋白,半干法转至NC膜,含5%脱脂奶粉TBS室温封闭1 h, hnRNP H(鼠抗1∶200,SANTA CRUZ)E-cadherin(兔抗1∶500,中山金桥)、N-cadherin(兔抗1∶500,中山金桥)、MMP-2(鼠抗1∶300,中山金桥)、MMP-7(鼠抗1∶300,中山金桥)和GAPDH(兔抗1∶2 000,Abcam),4℃过夜;二抗(羊抗鼠或羊抗兔1∶5 000)37℃ 1.5 h;增强化学发光法(ECL)显色 ,凝胶成像系统扫描分析。
1.5划痕实验 分别用最佳浓度的Control siRNA及目的siRNA预处理的Ishikawa细胞,待细胞长满90%后做划痕试验, 用10 μl枪头在中间划一横线, 于24 h分别观察照相,重复3次。
1.6Transwell实验 将siRNA处理好的细胞含血清100 ml/L的DMEM培养基用悬浮, 以2×105接种于Fibronectin包被的Transwell孔板其中的12个Transwell上, 上室每孔加入100 μl,下室加入600 μl含血清200 ml/L的DMEM培养基,24 h后, 取出上室, 用棉签蘸去上层的细胞, 加入100 ml/L新鲜配置的甲醛溶液固定30 min,然后用SyTOXGreen染色15 min。甘油封片后用荧光显微镜检测细胞通过情况,平均每个小时计数5个视野,取平均值分析细胞的穿透能力。

2 结 果
2.1siRNA转染后各组hnRNP H在mRNA及蛋白的表达 转染hnRNP H siRNA 24 h后hnRNP H 表达明显降低约为对照组的(19±2.3)% 。转染hnRNP H siRNA 24 h后hnRNP H 表达在mRNA水平明显降低约为对照组的(23±1.6)%。见图1。
2.2实时定量PCR、Western印迹检测三组细胞E-cadherin、N-cadherin、MMP-2、MMP-7表达的影响 转染hnRNP H siRNA 24 h后N-cadherin、MMP-2、MMP-7 表达明显降低,分别约为对照组的(67±1.6)%,(59±1.8)%,(70±2.3)%。E-cadherin表达明显上调约为对照组的(25.6±7.9)%。转染hnRNP H siRNA 24 h后N-cadherin、MMP-2、MMP-7在mRNA水平明显降低,结果以2-△△CT表示分别为 0.43±0.164,0.38±0.124,0.54±0.102。见图2。
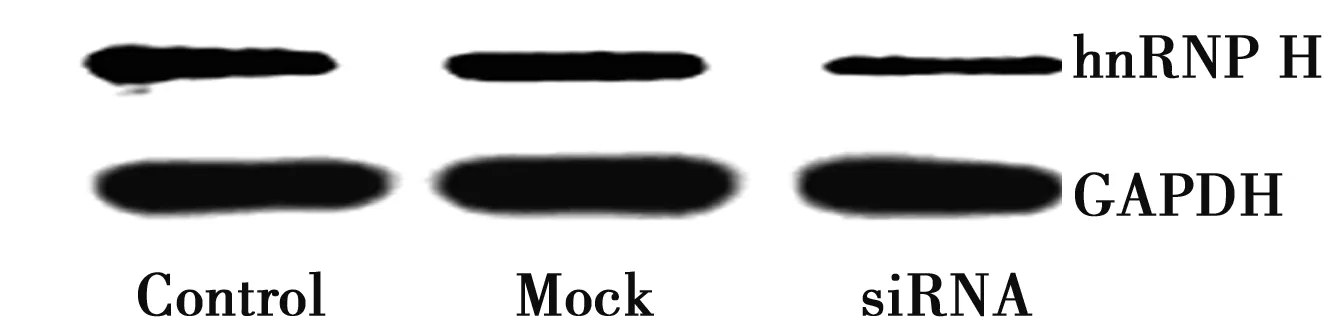
图1 各组hnRNP H mRNA表达

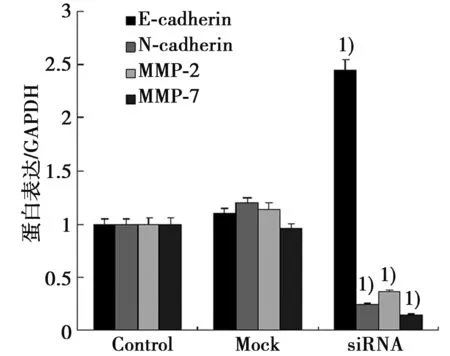

与Control组比较:1)P<0.05 与Control组比较:1)P<0.05
图2各组细胞E-cadherin、N-cadherin、MMP-2、MMP-7表达
2.3划痕实验及Transwell检测细胞迁移能力的改变 划痕后培养24 h后,三组细胞迁移率差异有统计学意义(P<0.05 ) , siRNA组细胞的迁移率(21.26±2.16)%明显低于阴性对照组(59.17±1.4)%和对照组(74.75±3.49)%(P<0.05)。而阴性对照组和对照组的细胞迁移率比较差异无统计学意义(P>0.05)。见图3。
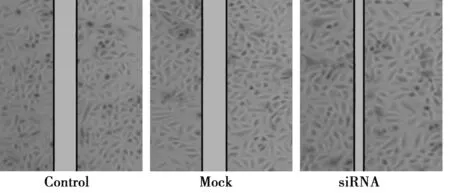
图3 各组细胞迁移率

图4 各组穿膜细胞数
Transwell试验结果显示:转染后24 h,siRNA组穿膜细胞为(36±8)个,阴性对照组和对照组穿膜细胞数分别为(164±14)和(171±9)个,与阴性对照组和对照组比较,siRNA组穿膜细胞数明显减少(P<0.05)。而阴性对照组和对照组穿膜细胞数比较差异无统计学意义(P>0.05)。见图4。
3 讨 论
上皮间质转变(EMT)是上皮细胞在一定因素作用下,细胞间无紧密连接和黏附连接,且失去细胞极性,上皮细胞具有浸润、游走迁徙的能力,从而上皮细胞变成具有间质细胞形态和特性的一类细胞,代表标志物:E-cadherin、N-cadherin。研究发现E-cadherin表达缺失是EMT的关键特征〔3,4〕,也是判断是否发生EMT〔5,6〕的标志指标,E-cadherin是维持上皮形态及细胞间黏附连接的重要黏附分子。其中在乳腺癌、卵巢癌、泌尿生殖系统等多种癌症都已证实E-cadherin表达缺失〔7,8〕。
综上,沉默hnRNP H基因能抑制子宫内膜癌Ishikawa细胞上皮间质转化,有效抑制子宫内膜癌细胞转移和侵袭。
4 参考文献
1Jemal A, Siegel RN, Ward E,etal.Cancer statistics, 2009〔J〕.CA Cancer J Clin, 2009;59(4):225-49.
2Matias-Guiu X,Prat J.Molecular pathology of endometrial carcinoma〔J〕.Histopathology,2013;62(1):111-23.
3Tryndyak VP, Beland FA, Pogribny IP.E-cadherin transcriptional down-regulation by epigenetic and microRNA-200 family alterations is related to mesenchymal and durg-resisitant phenotypes in human breast cancer cells〔J〕.Int J Cancer,2010;126(11):2575-83.
4Sun L, Yao Y, Liu B,etal.MiR-200b and miR-15b regulate chemotherapy-induced epithelial-mesenchymal transition in human tongue cancer cells by targeting BMI1〔J〕.Oncogene,2012;31(4):432-45.
5Cufi S, Vazquez-Martin A, Oliveras-Ferraros C,etal.Metformin against TGF beta-induced epithelial-to-mesenchymal transition(EMT):from cancer stem cells to aging-associated fibrosis〔J〕.Cell Cycle,2010;9(22):4461-8.
6Wang Z, Li Y, Ahmad A,etal.Targeting miRNAs involved in cancer stem cell and EMT regulation:an emerging concept in overcoming drug resistance〔J〕.Drug Resist Updat,2010;13(4-5):109-18.
7Planas-Sliva MD, Waltz PK.Estrogen promotes reversible epithelial-to-mesenchymal-like transition and collective motility in MCF-7 breast cancer cells〔J〕.J Steroid Biochem Mol Biol,2007;104(1-2):11-21.
8Haslehurst AM, Koti M, Dharsee M,etal.EMT transcription factors snail and slug directly contribute to cisplatin resistance in ovarian cancer〔J〕.BMJ Cancer, 2012;12(1):91.
