黄芪对糖尿病大鼠胰岛素信号传导的影响
2014-09-12武月婷侯雨菲
魏 倩 武月婷 侯雨菲 高 影
(吉林大学公共卫生学院卫生毒理学教研室,吉林 长春 130021)
胰岛素抵抗在糖尿病(DM)的发生发展中起重要作用,在Ⅰ型、Ⅱ型DM中均存在〔1,2〕,因此单纯通过注射胰岛素治疗DM并不能最大程度改善机体的代谢情况。氧化应激可以导致酪氨酸磷酸酶类的失活〔3〕,使胰岛素信号传导通路出现异常,从而产生胰岛素抵抗〔4〕。因此,改善机体的氧化应激状态,可以在一定程度上改善机体的胰岛素抵抗。天然药物黄芪具有很好的抗氧化作用〔5,6〕。本研究拟探讨黄芪通过改善机体氧化应激状态从而改善胰岛素信号传导的相关机制。
1 材料与方法
1.1实验动物及主要试剂 成年Wistar雄性大鼠,质量为(200±10)g,购于北京华阜康生物科技有限公司。链脲佐菌素(STZ,Sigma公司);黄芪注射液由黑龙江珍宝岛制药公司生产;鱼精蛋白锌胰岛素注射液由江苏万邦生化医药股份有限公司生产(批号:国药准字H10890001),4℃保存。糖基化终末产物(AGEs)酶联免疫吸附(ELISA)试剂盒购于武汉华美生物工程有限公司。抗磷酸化c-jun氨基末端激酶(JNK)抗体购于美国CST公司。BCA蛋白浓度测定试剂盒(增强型)由中国碧云天生物技术研究所提供。抗磷酸化胰岛素受体底物(IRS)-1 Ser307和抗p-IRS-1 Tyr612抗体购于美国圣克鲁斯生物技术公司。抗IRS-1、抗肌动蛋白(β-actin)、二抗山羊抗兔和二抗兔抗山羊抗体购于北京博奥森生物技术有限公司。
1.2模型复制、分组及给药方法 Wistar大鼠适应性喂养1 w后,禁食12 h,给予60 mg/kg STZ药量腹腔注射。STZ溶液现用现配,溶剂为0.1 mol/L,pH=4.5的枸橼酸-枸橼酸钠缓冲液。2 d后尾静脉采血测空腹血糖(FBG)值,以FBG≥16.7 mmol/L作为DM模型成功标准,不成功则隔日给予STZ 40 mg/kg进行二次注射。若1,3和5 d大鼠FBG值均≥16.7 mmol/L,则DM模型造模成功。将DM模型大鼠随机分为模型组(DM组)、黄芪组(RA组)、胰岛素组(Ins组)和黄芪加胰岛素组(RA+Ins组),每组6只。另取6只大鼠,腹腔注射等剂量溶剂,作为对照组。每天10点,给予DM组和对照组生理盐水灌胃,RA和RA+Ins组黄芪注射液5 mg/ml灌胃,RA+Ins和Ins组2 U胰岛素大腿外侧皮下注射的处理。每3 d检测FBG,根据血糖情况调整胰岛素剂量,使FBG水平在4~8 mmol/L。持续给药8 w。自由饮食饮水。
1.3样本采集及指标检测 给药8 w后,禁食,称量大鼠体重。使用10%水合氯醛麻醉后,腹主动脉取血,静置30 min,1 500 r/min离心10 min,收集血清,-20℃保存备用。摘取大鼠肾脏和骨骼肌称重后,液氮冷冻,-80℃保存备用。
1.3.1大鼠肾脏、视网膜AGEs含量的测定 采用酶联免疫吸附法,操作过程严格按照试剂盒的说明书。
1.3.2Western印迹检测大鼠骨骼肌中p-SAPK/JNK、p-IRS-1 Ser307和p-IRS-1 Tyr612的表达 称量大鼠骨骼肌组织 40 mg,加入400 μl RIPA裂解液(含1 mmol/L PMSF),充分匀浆,4℃静置30 min,每5 min 震荡1次。4℃ 14 000 r/min离心5 min,取上清。BCA法蛋白浓度测定试剂盒进行蛋白定量,操作过程严格按照说明书进行,样本定量为5 mg/ml。配制分离胶和浓缩胶;在加样孔中加入30 μg样品,接通电源,80 V电泳;调电流至100 mA,转膜120 min;取出PVDF膜,放入装有10 ml封闭液平皿内,室温轻摇3 h;一抗过夜;TBST室温洗膜10 min×3次;二抗1 h;用TBST洗膜10 min×3次;等体积适量ECL A和B液,直接在保鲜膜上混合;将膜取出,用滤纸略吸TBST,置于保鲜膜上;涂匀,用保鲜膜包裹,滤纸吸去多余ECL;将膜固定于暗盒内,压片曝光;显影定影;用Quantity one软件对条带进行分析。
1.4统计学分析 使用SPSS17.0软件进行单因素方差分析和SNK检验。
2 结 果
2.1各组大鼠肾脏和视网膜AGEs比较 与对照组比较,其他组大鼠肾脏和视网膜AGEs水平均较高(P<0.05)。与RA和Ins组比较,RA+Ins组肾脏和视网膜AGEs水平显著较低(P<0.05),DM组肾脏和视网膜AGEs水平显著较高(P<0.05)。RA组与Ins组大鼠肾脏和视网膜AGEs水平差异不具有统计学意义(P>0.05)。见表1。
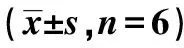
表1 各组大鼠肾脏和视网膜AGEs水平的比较
2.2各组大鼠骨骼肌组织中p-SAPK/JNK的表达 表2和图1可见,与对照组相比,其他组大鼠骨骼肌中p-SAPK/JNK Thr183的表达水平显著较高(P<0.05)。与DM组比较,RA、Ins和RA+Ins组表达水平显著较低(P<0.05),其中RA+Ins组最低,Ins组次之。各组大鼠骨骼肌中p-SAPK/JNK Tyr185的表达情况与p-SAPK/JNK Thr183相同。
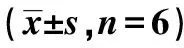
表2 各组大鼠骨骼肌组织中p-SAPK/JNK表达的比较

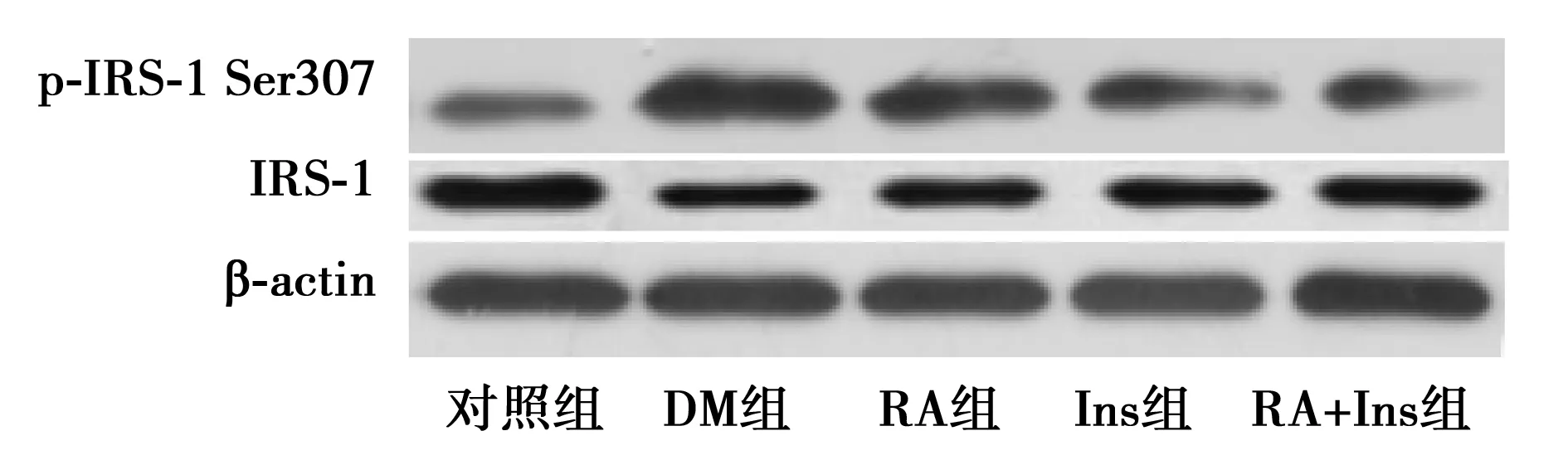
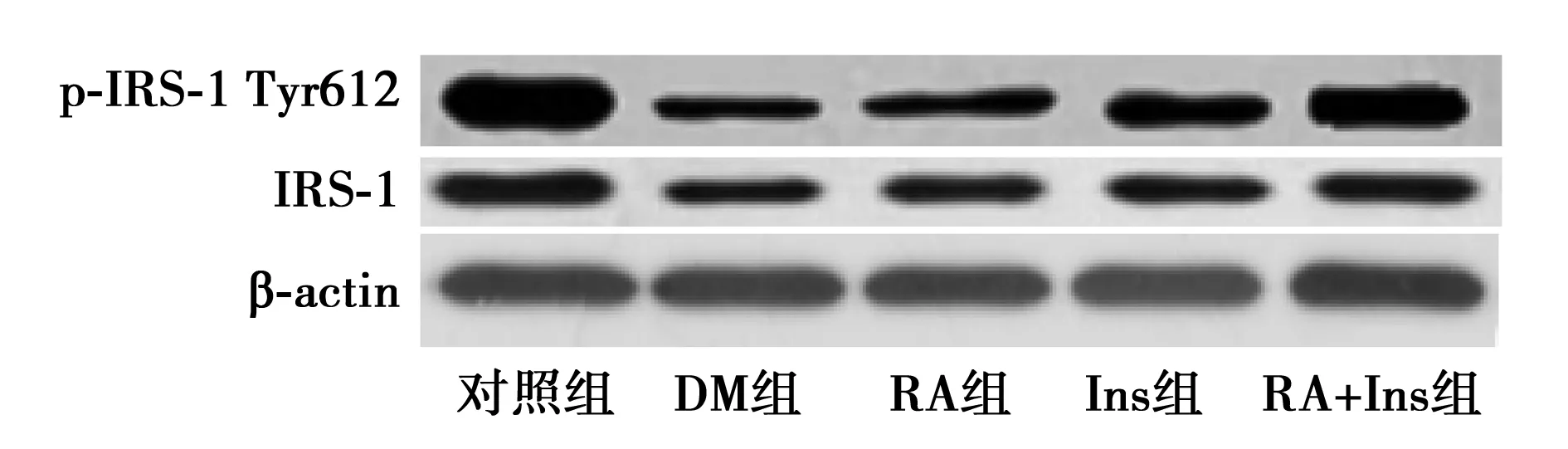
图1 Western印迹检测p-SAPK/JNK及p-IRS-1蛋白表达
2.3各组大鼠骨骼肌组织中p-IRS-1 Ser307和p-IRS-1 Tyr612的表达 与对照组相比,组大鼠骨骼肌中p-IRS-1 Ser307的表达水平显著较高(P<0.05)。与RA+Ins组比较,DM、RA和Ins组表达水平显著较高(P<0.05),DM组最高,RA组次之。与DM组比较,RA、Ins和RA+Ins组大鼠骨骼肌p-IRS-1 Tyr612的表达水平显著较高(P<0.05);与RA+Ins组比较,RA和Ins组显著较低(P<0.05),对照组显著较高(P<0.05)。见表3和图1。
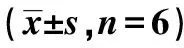
表3 各组大鼠骨骼肌组织中p-IRS-1 Ser307和p-IRS-1 Tyr612表达的比较
3 讨 论
流行病学资料表明在世界范围内,DM的患病人数已经将近3亿,预计到2050年患病人数将达到3.5亿〔7〕。目前,注射胰岛素是最为有效的治疗方法,但是单纯胰岛素疗法存在很多问题,如胰岛素注射间隔期血糖波动难以控制,胰岛素注射时可能产生的低血糖问题〔8〕等。这些问题甚至比DM本身更损伤机体。本研究结果提示黄芪可以改善DM大鼠机体内氧化应激状态,降低氧化应激产物水平,缓解胰岛素抵抗效应,黄芪与胰岛素联合使用效果最佳。
氧化应激是造成胰岛素抵抗和DM的重要因素,胰腺本身抗氧化能力弱,大量的活性氧簇(ROS)能够直接损伤胰岛β细胞〔9〕。机体的高糖状态可以进一步加剧氧化应激,从而产生恶性循环。AGEs在DM慢性并发症发生发展过程中起重要作用,是由持续高血糖引起体内多种蛋白质非酶糖基化产生,可以加剧机体的氧化应激,主要存在于肾脏及视网膜中。本研究结果提示黄芪和胰岛素均可以降低DM大鼠AGEs的水平,改善机体氧化应激状态。
JNK是丝裂原活化蛋白激酶家族中重要的一员,JNK的激活与炎症信号通路和氧化应激密切相关。目前已经公认JNK可以使IRS-1第307位的丝氨酸磷酸化导致胰岛素抵抗〔10〕。IRS-1在胰岛素信号传导过程中起主要作用,在DM患者的骨骼肌中注入胰岛素后IRS-1络氨酸磷酸化程度明显低于正常人〔11〕。IRS-1 Ser307磷酸化在介导胰岛素负反馈调节方面起重要作用,它不仅可以干扰IRS-1与其受体的结合而且减少IRS-1酪氨酸的磷酸化,从而使胰岛素信号传导异常〔12~14〕。本研究显示,黄芪可以降低p-SAPK/JNK的表达,从而降低IRS-1 丝氨酸磷酸化程度,使酪氨酸磷酸化程度升高,保证胰岛素信号的传导,改善胰岛素抵抗效应。
4 参考文献
1Alberti KG,Zimmet P.Epidemiology:global burden of disease—where does diabetes mellitus fit in〔J〕?Nat Rev Endocrinol,2013;9(5):258-60.
2Liu HY,Cao SY,Hong T,etal.Insulin is a stronger inducer of insulin resistance than hyperglycemia in mice with type 1 diabetes mellitus (T1DM)〔J〕.J Biol Chem,2009;284(40):27090-100.
3Boura-Halfon S,Zick Y.Phosphorylation of IRS proteins,insulin action,and insulin resistance〔J〕.Am J Physiol-Endocrinol Metab,2009;296(4):E581-91.
4Conceição EPS,Franco JG,Oliveira E,etal.Oxidative stress programming in a rat model of postnatal early overnutrition—role of insulin resistance〔J〕.J Nutrit Biochem,2013;24(1):81-7.
5Huang WM,Liang YQ,Tang LJ,etal.Antioxidant and anti-inflammatory effects of Astragalus polysaccharide on EA.hy926 cells〔J〕.Exp Therap Med,2013;6(1):199-203.
6Yu KZ,Liu J,Guo BL,etal.Microscopic research on a multi-source traditional Chinese medicine,Astragali Radix〔J〕.J Natural Med,2014;68(2):340-50.
7Olshansky SJ.Projecting the future of US health and longevity〔J〕.Health Aff(Millwood),2005;24:(S2):W5R86-9.
8Grunberger G.The need for better insulin therapy〔J〕.Diab Obes Metab,2013;15(s1):1-5.
9Dave GS,Kalia K.Hyperglycemia induced oxidative stress in type-1 and type-2 diabetic patients with and without nephropathy〔J〕.Cell Molec Biol(Noisy-le-Grand,France),2006;53(5):68-78.
10Kaneto H,Xu G,Fujii N,etal.Involvement of c-Jun N-terminal kinase in oxidative stress-mediated suppression of insulin gene expression〔J〕.J Biol Chem,2002;277(33):30010-8.
11Björnholm M,Kawano Y,Lehtihet M,etal.Insulin receptor substrate-1 phosphorylation and phosphatidylinositol 3-kinase activity in skeletal muscle from NIDDM subjects after in vivo insulin stimulation〔J〕.Diabetes,1997;46(3):524-7.
12Aguirre V,Werner ED,Giraud J,etal.Phosphorylation of Ser307 in insulin receptor substrate-1 blocks interactions with the insulin receptor and inhibits insulin action〔J〕.J Biolog Chem,2002;277(2):1531-7.
13Egawa T,Tsuda S,Ma X,etal.Caffeine modulates phosphorylation of insulin receptor substrate-1 and impairs insulin signal transduction in rat skeletal muscle〔J〕.J Appl Physiol,2011;111(6):1629-36.
14Herschkovitz A,Liu YF,Ilan E,etal.Common inhibitory serine sites phosphorylated by IRS-1 kinases,triggered by insulin and inducers of insulin resistance〔J〕.J Biol Chem,2007;282(25):18018-27.
