养寿丹对老年性痴呆模型大鼠海马神经细胞凋亡的干预作用
2014-09-12李雪岩林春荣董海影谢志平牛英才兴桂华
胡 南 李雪岩 林春荣 董海影 谢志平 牛英才 兴桂华
(齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
老年性痴呆(AD)是一种原因不明、以认知功能减退为主要临床表现的神经系统退行性疾病,其患病率在世界各国均呈上升趋势,在发达国家已列于第四大死因〔1〕。AD形态学上主要病理特征为神经元纤维缠结、老年斑和神经元丢失。研究证实,神经细胞的凋亡是AD发生的一个重要机制〔2〕,AD脑内神经元的丢失机制与细胞凋亡有关〔3〕。养寿丹是出自《御药院方》的传统名方,具有延缓衰老、抗应激及免疫调节、改善学习记忆功能及抗AD等药理作用〔4~6〕。本实验采用大鼠基底核内联合注射β-淀粉样蛋白1~40(Aβ1~40)和兴奋性氨基酸,诱导AD动物模型,探讨养寿丹对AD海马区半胱氨酸蛋白酶(Caspase-3)mRNA表达的影响,以揭示养寿丹对神经细胞凋亡保护作用的可能机制,从而为临床防治AD 提供理论依据。
1 材料与方法
1.1材料 养寿丹组成:何首乌、熟地、巴戟、枸杞子、川断、牛膝、肉苁蓉、茯苓、菟丝子、白术、远志、石菖蒲等,上述药材均购自安国市弘发中药材饮片有限公司,处方中各味药比例为3∶1.5∶1.5∶1.5∶1.5∶1.5∶2∶1.5∶1.5∶1.5∶1∶1〔7〕。加水煎煮2次,第1次3 h,第2次2 h,合并煎液,滤过,浓缩液含生药5.6 g/ml, 贴标签后将药液贮存于4℃保存备用。Aβ1~40为北京中杉金桥生物技术有限公司产品。盐酸多奈哌齐片由卫材(中国)药业有限公司制造,产品批号110917A。鹅膏蕈氨酸(Ibotenic acid,IBO, Sigma公司),均为分析纯。
1.2动物与分组 健康雄性清洁级SD大鼠100只,购于长春市亿斯实验动物技术有限责任公司,许可证编号SCXK(吉)2011-0004,鼠龄8~12 w,体重(280±20)g,经适应性饲养1 w,随机分为空白组、假手术组、模型组、盐酸多奈哌齐组(西药对照组)和养寿丹组,每组20只。
1.3主要仪器及试剂 SYBR®ExScriptTMRT-PCR kit(Perfect Real Time)为TAKARA公司产品,RNAiso Reagent为TAKARA公司产品,DEPC为瑞兴化学产品。ABI7300荧光定量PCR仪为美国ABI公司产品,2700型PCR System扩增仪为Applied Biosystems公司产品。FACS Calibur流式细胞仪为美国BD公司。UV-2550型紫外分光光度计为日本岛津产品。江湾Ⅰ型C立体定向器(第二军医大学)。
1.4方法
1.4.1造模〔8〕将实验大鼠用10%水合氯醛(0.35 ml/100 g体重)腹腔注射麻醉后,立体定位仪固定头部,备皮消毒,沿颅顶中线作2 cm切口,分离骨膜暴露头骨,以前囟门为基点,由前囟向后0.5 mm,再从正中向右移至2.8 mm处,用牙科钻打开颅骨,垂直插入微量注射器,使针尖自脑表面进针7 mm至Myenert核,将1 μl溶液(内含Aβ1~404 μg和IBO 1 μg溶于生理盐水)混合液缓慢注入,20 min内分4次注射完毕,留针5 min,缝合皮肤。模型组、盐酸多奈哌齐组、养寿丹组分别注射1 μl Aβ1~40和Iboteni cacid的混合液。用同样方法假手术组注射1 μl生理盐水。
1.4.2给药方法 造模后第3天开始给予药物干预,根据人和动物按体表面积折算的等效剂量。空白对照组、假手术组、模型组均按0.5 ml/100 g体重给予生理盐水灌胃,1次/d,盐酸多奈哌齐对照组按0.33 mg·kg-1·d-1,养寿丹组(含5.6 g生药/ml)给药,灌胃方法同模型组,连续2个月。
1.4.3流式细胞技术检测海马区神经细胞的凋亡率 行为学测试完成后,每组各取5只大鼠,断头处死,在冰台上开颅,快速取出海马组织。滴加无菌磷酸盐缓冲液(PBS)1.5 ml冲洗1次,将组织剪碎后,放入于50 μm无菌旋液中,并用流式样品制备仪制成单细胞悬液;用2.5 ml注射器抽取悬液,经0.7 μm,200目规格的滤网过滤到离心管中,离心5 min(1 500 r/min),弃去上清液;加入缓冲液重新悬浮细胞,调细胞浓度约1×106个/ml,然后用冰冻的PBS冲洗1次,轻轻震荡,使细胞悬浮,离心,去上清;加入10 μl的AnnexinV-FITC和5 μl的PI,轻轻摇匀,避光室温孵育 15 min 。加入400 μl Binding Buffer后,在1 h内上流式细胞仪测定。
1.4.4荧光实时定量PCR检测大鼠大脑海马组织Caspase-3 mRNA表达 总RNA的提取: 按RNAiso Reagent操作说明书提取大鼠右侧海马组织总RNA,紫外分光光度计分析及琼脂糖凝胶电泳检测总RNA的纯度、浓度及完整性。逆转录反应: 逆转录反应在2700型PCR System扩增仪上按SYBR®ExScriptTMRT-PCR Kit反转录反应试剂盒方法操作,反应参数如下:反转录反应42℃ 15 min,反转录酶失活反应95℃ 2 min。PCR反应采用SYBR Premix Ex Taq(Perfect Real Time) kit试剂,在ABI 7300荧光定量PCR仪(美国ABI公司)上进行。引物由TaKaRa公司设计合成,引物序列如下:Caspase-3:上游引物序列为5′-GAGACAGACAGTGGAACTGACGATG-3′,下游引物序列为5′-GGCGCAAAGTGACTGGATGA-3′。GAPDH:上游引物序列为5′-GACAACTTTGGCATCGTGGA-3′;下游引物序列为5′-ATGCAGGGATGATGTTCTGG-3′。反应条件如下:第一步是预变性,95℃,10 s (1个循环)。第二步是PCR反应,95℃,5 s;60℃,31 s(40个循环)。反应结束后,使用Sequence Detection software version 1.2.3软件(Applied Biosystems公司)分析PCR过程个检测样本的Ct(Threshold cycle)值。

2 结 果
2.1养寿丹对实验大鼠海马区神经细胞凋亡率的影响 模型组(18.27±0.66)比空白对照组(4.10±0.30)、假手术组(4.36±0.59)神经细胞凋亡率明显升高,而养寿丹组海马神经细胞凋亡情况(14.32±0.64)较模型组明显改善(均P<0.05),盐酸多奈哌齐组凋亡率(13.78±0.95)与模型组比较差异显著(P<0.05)。
2.2养寿丹对AD模型大鼠海马组织Caspase-3 mRNA表达的影响 模型组Caspase-3 2-△△CT明显升高,与假手术组比较差异显著(P<0.05);与模型组相比较,假手术组、养寿丹组Caspase-3 2-△△CT均明显著降低(P<0.05)。见表1。
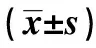
表1 养寿丹对AD模型大鼠海马组织Caspase-3 mRNA表达的影响
3 讨 论
AD是一种严重影响老年人健康及其家庭生活质量的神经系统退行性疾病,已成为当前导致老年人死亡的重要原因之一。因此,老年病防治已成为我国十分紧迫的社会和医学问题,研究AD的发病机制和防治措施,具有重要的医学科学价值和社会现实意义。研究表明,Aβ引起神经细胞凋亡,导致AD患者脑内神经细胞和突触丢失,最后引起AD〔9〕。Aβ诱发的神经细胞凋亡可能是AD认知功能障碍的主要病理学基础。在AD发病早期即出现突触和神经元的大量丢失,而AD脑内神经元的丢失机制与细胞凋亡有关,细胞凋亡是引起神经元丢失的重要途径,并受Caspase家族和Bcl-2家族调控。近年来,Caspase家族是与细胞凋亡最密切相关的一类蛋白酶,Caspase蛋白酶激活是细胞凋亡发生过程中的中心环节 。其中Caspase-3是细胞凋亡信号途径中最关键的效应酶,在凋亡信号转导中起重要的核心作用〔10〕,它被公认是细胞凋亡蛋白级联反应的必经之路〔11〕。新近研究〔12,13〕认为,Aβ活化 Caspase-3可剪辑 Tau,导致 Tau 的积聚,参与AD发病过程。因此,Caspase-3是治疗神经退行性疾病的新靶点,寻找Caspase-3高效高选择性的抑制剂将为治疗神经退行性疾病提供新的途径〔14〕。
中医认为,肾主骨生髓,脑为髓之海,肾脑关系尤为重要。衰老的发生发展,学习记忆能力的下降以及AD的发病均与增龄性的肾虚密切相关。肾虚髓减是AD发病的关键因素所在,由于肾精不足,髓海空虚而致AD,学习记忆能力下降。因此,中医临床防治AD多以补肾为主要原则,运用补肾方药进行治疗,且具有独特的疗效。补肾填精、化痰开窍法是治疗AD的基本治法。研究还表明,养寿丹具有延缓衰老、抗应激及免疫调节、改善学习记忆功能及抗AD等药理作用。本实验流式细胞术检测结果显示,养寿丹能够抑制Aβ和兴奋性氨基酸所致的细胞凋亡,减少神经元的凋亡数量,对损伤的神经细胞起到保护作用。RT-PCR检测结果表明,AD发生可能是由于Caspase-3 mRNA被激活,进而导致神经细胞不可逆性凋亡,造成脑内神经细胞和突触丢失,最终引起AD,并且提示养寿丹对细胞凋亡执行蛋白 Caspase-3 表达具有调控效应。因此,推测养寿丹可能通过下调Caspase-3的表达,阻止Caspase-3诱导的凋亡级联效应发生,减少了神经元丢失,从而发挥抗神经细胞凋亡的保护作用,可能为养寿丹防治AD的作用机制之一。
4 参考文献
1Gamaldo A, Moghekar A, Kilada S,etal.Effect of a clinical stroke on the risk of dementia in a prospective cohort〔J〕.Neurology,2006;67(8):1363-9.
2Yang DS, Kumar A, Stavrides P,etal.Neuronal apoptosis and autophagy cross talk in aging PS/APP mice, a model of Alzheimer′s disease〔J〕.Am J Pathol, 2008;173(3): 665-81.
3Caricasole A,Copani A,Caraci F,etal.Induction of Dickkopf-1,a negative modulator of the wnt pathway,is associated with neuronal degeneration in alzheimer's brain〔J〕.J Neurosci,2004;24(26):6021-7.
4黄兆胜,孙维广,刘明平,等.养寿丹对肾阳虚痴呆模型的抗衰益智作用观察〔J〕.中国中医基础医学杂志, 2003;9(6):436-9.
5黄兆胜,孙维广,刘明平,等.养寿丹对阿尔茨海默病肾阳虚模型大鼠学习记忆的影响〔J〕.中成药, 2002;24(2):113-5.
6王 玲,黄兆胜,刘明平,等.养寿丹对Alzheimer病模型大鼠学习记忆的影响研究〔J〕.中医药学刊,2005;23(1):136-8.
7黄兆胜,刘明平,孙维养,等.养寿丹对阿尔茨海默病肾阳虚大鼠脑神经递质的影响〔J〕.中国实验方剂学杂志,2002;8(2):26-8.
8陈 勤,胡雅儿,夏宗勤.知母皂甙元对脑内注射β- 淀粉样肽痴呆模型大鼠的影响〔J〕.上海第二医科大学学报,2001;21(5):401-3.
9Biswas SC, Shi Y, Vonsattel JP,etal.Bim is elevated in Alzheimer's disease neurons and is required for beta-amyloid-induced neuronal apoptosis〔J〕.J Neurosci, 2007;27(4):893-900.
10张拥波,罗 勇,董为伟.Caspase-3在脑缺血神经元损伤中的作用〔J〕.国外医学·脑血管病分册,2000;8(2):79-81.
11Cheng EH,Kisch DG, Clem RJ,etal.Conversion of bcl-2 to a Bax-like death effector by caspases〔J〕.Science, 1997;278(5345):1966-8.
12Prvulovic D,Hampel H.Amyloid β (Aβ) and phospho-tau(p-tau) as diagnostic biomarkers in Alzheimer's disease〔J〕.Clin Chem Lab Med,2011;49(3):367-74
13Marwarha G,Dasari B,Prabhakara JP,etal.β-Amyloid regulates leptin expression and tau phosphorylation through the mTORC1 signaling pathway〔J〕.J Neurochem,2010;115(2):373-84.
14Louneva N,Cohen JW,Han LY,etal.Caspase-3 is enriched in postsynaptic densities and increased in Alzheimers Disease〔J〕.Am J Pathol,2008;173(5):1488-95.
