芎龙胶囊对大鼠急性脑缺血再灌注损伤的保护作用及机制
2014-09-12刘秀梅张丁华杨庆宇
刘秀梅 张丁华 杨庆宇
(郑州人民医院药学部,河南 郑州 450000)
缺血性脑血管病发病率、死亡率、致残率高,严重影响人类的健康。脑缺血再灌注损伤(CIRI)是指脑缺血致脑组织坏死前,闭塞的脑血管再通后缺血性损伤却进一步加重的现象〔1〕。CIRI发生的机制非常复杂,主要的病理生理过程包括兴奋性氨基酸毒性、钙超载、能量代谢障碍、炎症反应及氧自由基增多〔2~4〕。目前,中药复方已经广泛应用于CIRI的干预,其多途径性与CIRI病理基础的多样性具有多靶点效应和协同作用。本课题组根据川芎、地龙及人参等有效成分的药理基础,研制了复方芎龙胶囊,观察其对线栓法制备的大鼠CIRI模型的治疗作用,同时通过对大鼠脑组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)含量,探讨其保护脑组织的机制。
1 材料与方法
1.1实验动物、试剂和仪器 雄性Wistar大鼠120只,洁净级,体重(200±20)g,购自郑州大学实验动物中心。大鼠维持饲料由郑州大学实验动物中心提供。胶囊由本实验中心研制而成,主要成分有川芎、地龙和人参等名贵中药材,按特定比例混合而成。复方丹参滴丸,天士力制药股份有限公司。苏木精,伊红染液,SOD,MDA和NO试剂盒购自南京建成生物工程研究所。电子天平,沈阳龙腾电子有限公司。低温离心机,Thermo公司。切片机,德国徕卡公司。光学显微镜,奥林巴斯工业有限公司。
1.2动物分组、模型复制及给药 120只大鼠随机分为假手术(Sham)组、模型(Model)组、阳性药复方丹参滴丸(DSDW)组、胶囊低、中、高剂量组,每组20只。各组大鼠饲养于清洁级环境中,自由饮食、饮水,维持12/12 h明暗交替,温度(25±1)℃,湿度55%~65%。治疗组以胶囊及复方丹参滴丸的羧甲基纤维素钠悬液灌胃,0.5 ml/100 g,2次/d连续2 d,然后采用线栓法堵塞大鼠中动脉复制大鼠急性CIRI模型。10%水合氯醛0.3 ml/100g腹腔注射麻醉大鼠,仰位固定于鼠板并使颈部充分舒展以便手术造模,备皮并右侧切开皮肤,钝性分离游离颈总动脉,模型组经颈总动脉插入尼龙线栓至大脑中动脉闭塞,缺血2 h后将线栓抽回缝合伤口,再灌注24 h后,进行神经功能学评分。同样方法麻醉后,行腹主动脉取血,处死大鼠,冰磷酸盐缓冲液(PBS)灌流后,8只大鼠取脑组织冻存备用,其余12只继续用4%多聚甲醛溶液灌流,取完整脑组织,置于10%甲醛溶液中固定待用。Sham组除不进行线栓法堵塞外,其他手术操作与模型组相同。同样方法缺血,并固定完整脑组织样本。Sham组与Model组用生理盐水等体积灌胃,给药方法与时间同前。
1.3神经功能学评分 在各组大鼠缺血2 h再灌注2 h后,按照Longa等方法,对各组大鼠进行神经功能学评分:0分,无任何神经功能缺失体征;1分,未损伤侧前肢不能伸展;2分,向未损伤侧弧线行走或追尾转圈;3分,向未损伤侧倾斜或倾倒;4分,意识障碍,无自主行走分。
1.4脑组织含水量的测定 各组大鼠经冰PBS灌流后,任意选取6只检测脑组织含水量。断头取脑后,用滤纸吸干表面水分,分析天平称质量,再置于烘箱中,105℃烘烤24 h至恒重,分析天平称量干质量,计算脑组织含水量:P脑含水=(m湿脑-m干脑)/m湿脑×100%。
1.5组织切片的制备及凋亡细胞检测 固定完全的脑组织进行梯度乙醇脱水,二甲苯透明,常规石蜡包埋,经顶部行冠状位连续切片,皮厚6 μm。切片依次经二甲苯脱蜡,梯度酒精水化,酸水及氨水中分色,伊红染色,梯度酒精脱水,二甲苯透明,中性树脂封片。
1.6脑组织SOD、MDA和NO含量的测定 实验结束时,各组任选其中8只大鼠断头取脑,冰盒上分离大脑右中段皮质,称重,用生理盐水制备10%的组织匀浆,4 000 r/min离心,取上清,严格按照二喹啉甲酸(BCA)、SOD、MDA和NO试剂盒说明操作。
1.7统计学方法 计量资料组间比较采用t检验。
2 结 果
2.1各组大鼠神经功能学评分及脑组织含水量 Sham组神经功能学评分为0;Model组大鼠与Sham组相比升高(3.42±0.27),表明本实验中模型建立成功;芎龙胶囊低、中、高剂量组大鼠神经功能学评分与Model组相比均有不同程度的降低(P<0.05或P<0.01),且具有一定的剂量依赖性。阳性药组大鼠神经功能学评分降低程度与胶囊中剂量组相当。Model组大鼠脑组织在缺血2 h,再灌注24 h后含水量明显高于Sham组(P<0.01)。芎龙胶囊低剂量组能显著降低模型大鼠脑组织中的含水量(P<0.05),中、高剂量组相比Model组具有极显著意义(P<0.01),且各组间具有剂量依赖性。阳性药复方丹参滴丸降低模型大鼠脑组织中含水量作用与芎龙胶囊中剂量组作用相当。见表1。
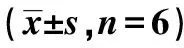
表1 各组大鼠神经功能学评分及脑组织含水量
2.2各组大鼠皮质区形态学变化 Sham组可见神经元结构完整,核仁大且核膜清晰,数量丰富,神经元突起明显;Model组神经元空泡状坏死严重,且伴有严重的水肿;芎龙胶囊低、中、高给药组与Model组相比神经元结构损伤减轻,数量有所恢复,且水肿程度减轻。见图1。
2.3各组大鼠脑组织匀浆中SOD、MDA及NO含量 Model组与Sham组相比,SOD、NO含量下降,MDA含量升高,差异有统计学意义(均P<0.01),而芎龙胶囊相对于Model组而言,SOD、NO含量显著上调,MDA含量显著下降,且芎龙胶囊低、中、高剂量组具有一定的剂量依赖性,复方丹参滴丸组对Model大鼠脑组织中上述三个指标调节作用与芎龙胶囊中剂量组相当。见表2。
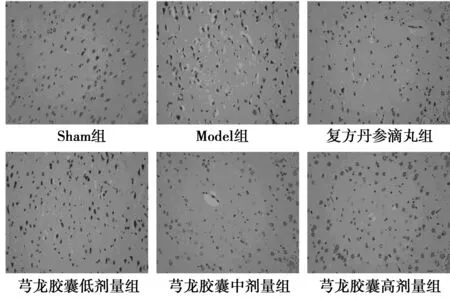
图1 各组大鼠皮质区形态学变化
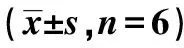
表2 各组大鼠脑组织中SOD、MDA及NO含量
3 讨 论
脑缺血后细胞的死亡主要是坏死和凋亡〔5, 6〕。坏死是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡过程,主要特征是细胞迅速肿胀和崩解,表现为细胞内蛋白的变性、降解、内容物流出,进而引起周围组织炎性反应。凋亡是细胞受到病理生理性信号刺激或者条件的变化后,自身对这种刺激产生的有序变化的死亡过程。有研究证明,CIRI过程中,凋亡在神经元的死亡过程中起着重要作用。这种低氧、低糖的信号刺激神经元细胞产生级联反应,如ATP减少,胞浆内外离子浓度的改变,兴奋性氨基酸的释放以及氧化应激等,其中氧化应激被认为对神经元的凋亡起着关键作用〔7〕,此外,NO释放的减少被认为会进一步加重神经元细胞的凋亡〔8〕。
中医药治疗CIRI有着悠久的历史。中药复方多途径、多靶点效应与CIRI病理变化的多样性有针对性作用。现代药理研究证实,川芎的主要成分是川芎嗪、阿魏酸等能够通过血脑屏障,抑制血小板聚集,降低血液黏稠度,增加脑血流量;地龙富含丰富的纤溶酶原,可直接降解纤维蛋白,达到增加脑部血流供应的目的;人参则有营养神经元细胞,抗氧化损伤的作用。实验结果可以看出,芎龙胶囊对CIRI有很好的治疗效果,可以降低大鼠脑组织的水肿情况,减少神经元凋亡,提高模型大鼠的神经功能学评分。这种治疗作用主要是通过增加NO含量从而增加脑组织血流供应,增加SOD、降低MDA,从而减少脑组织中氧化损伤实现的。本研究将为芎龙胶囊成为治疗CIRI治疗药物提供一定的理论基础。
4 参考文献
1Pan J, Konstas AA, Bateman B,etal.Reperfusion injury following cerebral ischemia: pathophysiology, MR imaging, and potential therapies〔J〕. Neuroradiology, 2007;49(2):93-102.
2Zhao Q, Wang S, Li Y,etal. The role of the mitochondrial calcium uniporter in cerebral ischemia/reperfusion injury in rats involves regulation of mitochondrial energy metabolism〔J〕. Mol Med Rep, 2013;7(4):1073-80.
3Zhang ZG, Sun X, Zhang QI,etal. Neuroprotective effects of ultra-low-molecular-weight heparin on cerebral ischemia/reperfusion injury in rats: involvement of apoptosis, inflammatory reaction and energy metabolism〔J〕. Int J Mol Sci, 2013;14(1):1932-9.
4Zhang TS, Yang L, Hu R,etal. Effect of electroacupuncture on the contents of excitatory amino acids in cerebral tissue at different time courses in rats with cerebral ischemia and reperfusion injury〔J〕. Zhen Ci Yan Jiu, 2007;32(4):234-6.
5Gaur V,Kumar A.Effect of nonselective and selective COX-2 inhibitors on memory dysfunction, glutathione system, and tumor necrosis factor alpha level against cerebral ischemia reperfusion injury〔J〕.Drug Chem Toxicol, 2012;35(2):218-24.
6Chen L,Xue Z, Jiang H.Effect of propofol on pathologic time-course and apoptosis after cerebral ischemia-reperfusion injury〔J〕. Acta Anaesthesiol Scand, 2008;52(3):413-9.
7Tu Q, Wang R, Qing B,etal. Protective and antioxidant effect of Danshen polysaccharides on cerebral ischemia/reperfusion injury in rats〔J〕. Int J Biol Macromol, 2013;60:268-71.
8Gursoy-Ozdemir Y, Bolay H, Saribas O,etal. Role of endothelial nitric oxide generation and peroxynitrite formation in reperfusion injury after focal cerebral ischemia〔J〕. Stroke, 2000;31(8):1974-80.
