连接蛋白43在猪冠状动脉平滑肌细胞表型转换中的作用
2014-09-12马晓烨张旭敏王小东姚义安
马晓烨 张旭敏 王小东 姚义安
(上海市同济大学附属东方医院心内科,上海 200120)
随着社会物质生活富裕与老龄化趋势加速,冠心病在我国的发病率也越来越高。然而血管平滑肌细胞(VSMC)的增殖是导致动脉粥样硬化和冠状动脉支架术后再狭窄等的心血管疾病的重要原因〔1~3〕。在动脉粥样硬化形成的早期阶段,VSMC受到血小板源生长因子(PDGF-BB)的刺激导致细胞增殖和迁移,促进动脉粥样硬化斑块的增大。介入治疗是严重狭窄的动脉粥样硬化的血管病变的主要治疗手段,但治疗时手术损伤深达中膜,激活血小板活化释放化学因子如PDGF-BB,造成的原位损伤修复反应能刺激VSMC的增殖和迁移,同时VSMC迁移的细胞形态发生改变,从而导致新生血管形成和显著的血管狭窄〔4,5〕。因此,研究VSMC增殖的机制对控制动脉粥样硬化和支架内再狭窄的预防有重要意义。已有研究报道,缝隙连接在动脉粥样硬化中起重要作用,其中缝隙连接蛋白(Cx)43在平滑肌细胞(SMC)增殖中作用明显〔6~10〕,但Cx43表达与细胞形态变化关系尚不明确。本研究以PDGF-BB作为体外培养的冠状动脉SMC细胞的刺激源,观察细胞表型转换与Cx43蛋白表达量的关系,探讨Cx43对冠状动脉SMC细胞表型转换的影响,从而阐明Cx43表达在冠状动脉介入治疗术后再狭窄中的作用。
1 材料与方法
1.1主要材料 细胞培养基(DMEM,美国GIBCO公司)培养,20%的胎牛血清(FCS,美国GIBCO公司)、电泳仪(美国Bio-Rad公司Mini Protein Ⅱ型)、投射电镜 (日本Olympus公司)、PCR仪(Applied Biosystems 7900HT Fast Real-Time PCR System)、光镜观察(日本olympus公司)、胰酶(Gibco公司)、S100A4、α-SMA 兔二抗体均为Abcam公司生产,其他试剂均为国产。
1.2SMC培养 根据同济大学动物伦理委员会批准,将3月龄家猪雌雄不限处死,分离冠状动脉前降支、回旋支、右冠状动脉,纵形破开分离出中层,进行原代细胞培养;SMC培养基(DMEM,美国GIBCO公司)培养,加入20%的FCS放入37℃,体积分数5%的CO2培养箱(Thermo公司),逐日倒置显微镜观察,每隔3 d换1次液。
1.3冠状动脉SMC应用PDGF诱导 经原代培养正常冠脉平SMC在含20%FCS的DMEM中培养,将贴壁90%细胞用胰酶消化1 min后,依次铺入6孔板内,24 h贴壁牢固后,加入PDGF-BB (10 ng/ml,Roche)共同培育,PDGF-BB浓度为10 ng/ml作用24 h;然后加入连接蛋白阻断剂(18-α-glycyrrhetinic acid浓度100 μmol/L)阻断作用48 h,后分别在24、48 h电镜观察细胞结构变化及连接蛋白变化〔8〕。
实验分为三组:正常对照组,诱导组:PDGF-BB(10 ng/ml),阻断组:PDFG-BB(10 ng/ml)+Cx43阻断剂(100 μmol/L)。各组细胞培养24 h后收集用于以下各项指标检测。
1.4电镜观察各组细胞形态与结构 离心收集贴壁细胞,2.5%戊二醛固定2~3 h,1%娥酸固定2~3 h,脱水临界点干燥,3%醋酸钠枸橼酸铅双染色,透射电镜(日本Olympus公司)观察SMC的形态与结构。
1.5Western 印迹检测蛋白表达 采用Western 印迹方法检测Cx43、Cx40、α-SMA、S100A4的蛋白表达。离心收集贴壁细胞,提取蛋白质,进行样品总蛋白含量测定,制胶,制备蛋白质样品并加样,免疫印迹显色,抗体均为Abcam公司生产,将膜放入曝光仪器中,滴加发光液,曝光3次,5 min/次,选择3次曝光的重叠值。
1.6实时荧光定量PCR测定Cx43、Cx40 mRNA的表达 Trizol一步法抽提平滑肌细胞正常对照组、诱导组及阻断组冠状动脉平滑肌细胞RNA。测定总RNA纯度、浓度及RNA完整性的检测,进行逆转录反应及cDNA合成(RT)和聚合酶链式反应(PCR)。放入荧光定量PCR仪(Applied Biosystems 7900HT Fast Real-Time PCR System),反应结束后,仪器自动进行溶解曲线分析,并计算得到每个样本的CT值,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参照,计算得到目的基因mRNA的含量。

2 结 果
2.1显微镜观察细胞形态变化 光镜观察结果见图1。通过电镜检查可见加入10 ng/ml PDFG-BB后细胞增殖加速分化。正常冠状动脉SMC呈纺锤状形态(S-SMC),胞浆内含SMC特征性结构肌丝和密体,细胞内高尔基体粗面内质网和游离核糖体含量很少。诱导组呈长菱形(R-SMC),核呈锯齿状,核大且呈异染性,核浆比例及平均细胞直径均较大,粗丝和密体减少,胞内粗面内质网扩张,游离核糖体丰富,并含有大量高尔基体。当加入100 μmol/ml Cx43阻断剂后又抑制增殖,细胞恢复成S-SMC,细胞内高尔基体粗面内质网和游离核糖体含量减少。见图2。
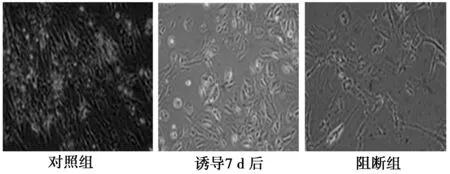
图1 显微镜观察细胞形态变化(×100)

图2 电镜下结果(×200)
2.2Western 印迹检测蛋白表达 与对照组相比,经PDFG-BB诱导后,Cx43、S100A4(R-SMC的标志)的蛋白表达量增加(P<0.01),Cx40、α-SMA(SMC分化标志)的蛋白表达量减少(P<0.01);而加入Cx43阻断剂后Cx43、S100A4的蛋白表达量减少(P<0.01), Cx40、α-SMA蛋白表达量增加(P<0.01),见图3。
2.3实时荧光定量PCR测定mRNA的表达 实时荧光定量PCR测定mRNA的表达:在对照组,Cx40的mRNA表达较高,Cx43少量表达;与诱导组相比较,Cx43的mRNA表达显著升高(P<0.01),Cx40表达明显减少(P<0.01);阻断组通过反义RNA降低Cx43表达,这种变化受抑制,且阻断组与诱导组在Cx43及Cx40mRNA的表达有统计学意义(P<0.01)。见图4。

图3 Western 印迹检测诱导后及阻断后蛋白变化

图4 PDGF-BB诱导及阻断Cx40、Cx43表达
3 讨 论
经皮冠状动脉介入治疗(PCI)是冠心病最有效治疗手段之一,但术后再狭窄影响远期疗效。再狭窄是一种局部血管对损伤的反应过程,包括炎性细胞的浸润和血小板的聚集释放各种细胞因子和生长因子,刺激血管中层SMC的增殖、迁移、表型转换,以及分泌细胞外基质,最终导致血管内膜增厚以及血管狭窄〔11,12〕。
动脉粥样硬化斑块的形成包括SMC从中层向内膜的迁移,在内膜受到PDFG等细胞因子的刺激而导致的增殖,以及细胞外基质的合成。Cx在SMC表型转换中可能起了重要作用。研究发现收缩型SMC向合成型SMC转换中有更多的缝隙连接,同时细胞中Cx43表达上调〔13〕。为进一步说明以上问题本文采用体外培养冠状动脉SMC,模拟体内动脉硬化过程观察细胞表型变化与蛋白表达关系,从而阐明再狭窄过程。正常冠状动脉血管中层SMC有S-SMC和R-SMC,与S-SMC相比,R-SMC具有较高的增殖、迁移和合成、分泌大量细胞外基质的能力,但分化能力较差〔14〕。本研究结果与以往报道结果一致〔8〕。
SMC之间通过Cx参与相邻细胞间的物质和信息交换〔15〕。连接蛋白在哺乳动物组织和细胞中广泛表达,SMC中主要表达Cx43、Cx37、Cx40和Cx45〔16〕。Cx43在动脉粥样斑块形成中可见较高的表达〔7,17〕,而降低Cx43表达可以限制小鼠动脉粥样硬化和斑块的发展〔18〕。研究〔19〕报道给予Cx43+/-LDLR-/-小鼠高脂饲料喂养14 w后,与Cx43+/+LDLR-/-小鼠相比,其动脉粥样硬化斑块减小,而且斑块中出现较少的炎症细胞和带有更多胶原蛋白和SMC的厚纤维帽,提示限制Cx43表达不仅可以减少斑块面积,而是可以稳定斑块,后者可能与Cs43抑制巨噬细胞活性有关。在小鼠颈动脉球囊扩张损伤的动物模型中,与Cx43+/+LDLR-/-小鼠相比,Cx43+/-LDLR-/-小鼠血管炎性反应减轻,并且可以降低SMC增殖与迁移〔20〕。
然而,Cx43在动脉粥样硬化中具体机制仍不清楚。以往研究认为,VSMC表型转换可能与氧化型低密度脂蛋白中的氧化磷脂成分POVPC和PGPC有关。POVPC降低Cx43的表达水平,但增加了其丝氨酸279/282磷酸化,导致SMC增殖;然而PGPC增加了Cx43丝氨酸368磷酸化,但并没有促进SMC的进一步增殖〔6〕。Johnstone等〔21〕的研究发现PDGF通过Cx43的丝裂原活化蛋白激酶(MAPK)磷酸化促进血管SMC增殖,而在血管损伤后Cx43的MAPK磷酸化可以显著增加新生血管形成。但其作用机制仍有待于进一步研究。
综上,PDGF-BB诱导SMC由S-SMC向R-SMC转换,伴有Cx43表达升高,细胞增殖,而阻断Cx43表达后SMC向S-SMC转换,抑制细胞增殖,但其具体作用机制仍有待于进一步研究,通过本研究为冠状动脉粥样硬化及PCI术后再狭窄的防治提供新的理论基础。
4 参考文献
1Ross R,Glomset JA.Atherosclerosis and the arterial smooth muscle cell:proliferation of smooth muscle is a key event in the genesis of the lesions of atherosclerosis〔J〕.Science,1973;180(4093):1332-9.
2Rekhter MD,Gordon D.Active proliferation of different cell types,including lympocytes,in human atherosclerotic plaques〔J〕.Am J Pathol,1995;147(3):668-77.
3Manolakou P,Angelopoulou R,Bakoyiannis C,etal.Cellular proliferation in complicated versus uncomplicated atherosclerotic lesions:total cell population,foam cells an newly formed microvessels〔J〕.Tissue Cell,2009;41(6):408-13.
4Fuster JJ,Fernandez P,Gonzalez-Navarro H,etal.Control of cell proliferation in atherosclerosis :insights from animal models and human studies〔J〕.Cardiovasc Res,2010;86(2):254-64.
5Bhardwaj S,Roy H,Babu M,etal.Adventitial gene transfer of VEFGr-2 specific VEGF-E chimera induces MCP-1 expression in vascular smooth muscle cells and enhances neointimal for mation〔J〕.Atherosclerosis,2011;219(1):84-91.
6Johnstone SR,Ross J,Rizzo MJ,etal.Oxidized phospolipid species promote in vivo differential Cx43 phosphorylation and vascular smooth muscle cell proliferation〔J〕.Am J Pathol,2009;175(2):916-24.
7Kwak BR,Mulhaupt F,Veillard N,etal.Altered pattern of vascular connexin expression in atherosclerotic plaques〔J〕.Arterioscler Thromb Vasc Biol,2002;22(2):225-30.
8Chadjicharistos CE,Morel S,Derouette JP,etal.Targeting connexin 43 prevents platelet-derived growth factor-BB-induced phenotypic change in porcine coronary artery smooth muscle cells〔J〕.Cirs Res,2008;102(6):653-60.
9Plenz G,Ko YS,Yeh HI,etal.Upregulation of connexin43 gap junctions between neointimal smooth muscle cells〔J〕.Eur J Cell Biol,2004;83(10):521-30.
10Yeh HI,Lupu F,Dupont E,etal.Upregulation of connexin43 gap junctions between smooth muscle cells after ballooon catheter injury in the rat carotid artery〔J〕.Arterioscler Thromb Vasc Biol,1997;17(11):3174-84.
11Myllarniemi M,Frosen J,Calderon-Ramirez LG,etal.Selective tyrosine kinase inhibitor for the platelet-derived growth factor receptor in vitro inhibits smooth muscle cell proliferation after reinjury of arterial intima in vivo〔J〕.Cardiovasc Drug Therp,1999;13(2):159-68.
12SabatéM,Serruys PW,van der Giessen WJ,etal.Geometric vascular remodeling after balloon angioplasty and beta-radiation therapy:A three-dimensional intravascular ultrasound study.Circulation〔J〕.1999;100(11):1182-8.
13Rennick RE,Connat JL,Burnstock G,etal.Expression of connexin43 gap junctions between cultured vascular smooth muscle cells is dependent upon phenotype〔J〕.Cell Tissue Res,1993;271(2):323-2.
14Hao H,Ropraz P,Verin V,etal.Heterogeneity of smooth muscle cell populations cultured from pig coronary artery〔J〕.Arterioscler Thromb Vasc Biol,2002;22(7):1093-9.
15Saez JC,Berthoud VM,Branes MC,etal.Plasma membrane channels formed by connexins:their regulation and functions〔J〕.Physiol Rev,2003;83(4):1359-400.
16Brisset AC,Isakson BE,Kwak BR,etal.Connexins in vascular physiology and pathology.Antioxid Redox Signal〔J〕.2009;11:267-82.
17Blackburn JP,Peters NS,Yeh HI,etal.Upregulation of connexin43 gap junctions during early stages of human coronary atherosclerosis〔J〕.Arterioscler Thromb Vasc Biol,1995;15(8):1219-28.
18Kwak BR,Veillard N,Pelli G,etal.Reduced connexin43 expression inhibits atherosclerotic lesion formation in low-density lipoprotein receptor-deficient mice〔J〕.Circulation,2003;107(7):1033-9.
19Wong CW,Burger F,Pelli G,etal.Dual benefit of reduced Cx43 on atherosclerosis in LDL receptor-deficient mice〔J〕.Cell Commun Adhes,2003;10(4-6):395-400.
20Chadjichristors CE,Matter CM,Roth I,etal.Reduced connexin43 expression limits neointima formation after balloon distension injury in hypercholesterolemic mice〔J〕.Circulation,2006;113(24):2835-3843.
21Johnstone SR,Kroncke BM,Straub AC,etal.MAPK phosphorylation of connexin 43 promotes binding of cycle E and smooth muscle cell proliferation〔J〕.Circ Res,2012;111(2):202-11.
