S-腺苷蛋氨酸对活化人肝星状细胞增殖和凋亡的影响*
2014-09-11诸葛宇征顾建祥李昱江
张 峰 诸葛宇征 顾建祥 李昱江
南京大学医学院附属鼓楼医院消化内科(210008)
肝纤维化是各种慢性肝病所致的一种创伤愈合反应,其特点是肝星状细胞(hepatic stellate cells, HSCs)活化导致细胞外基质大量沉积[1]。HSCs的活化是肝纤维化发生的中心环节,因此抑制HSCs活化表型是肝纤维化治疗的重要策略。S-腺苷蛋氨酸(S-adenosylmethionine, SAM)是机体最重要的甲基供体,亦是临床上常用的保肝退黄药物,近年研究表明SAM具有一定的抗纤维化作用[2],SAM能抑制HSCs的增殖,并可通过抑制HSCs的某些信号通路而阻止其活化[3-4],但目前尚不能完全阐释SAM对活化HSCs的影响及其抗纤维化机制。本研究通过探讨SAM对活化人肝星状细胞株LX-2细胞增殖、细胞周期、凋亡以及α-平滑肌肌动蛋白(smooth muscle actin, SMA)的影响,以期为进一步研究SAM的抗纤维化作用机制奠定基础。
材料与方法
一、细胞株、主要试剂
人肝星状细胞株LX-2购于博慧斯生物医药科技有限公司,为人HSCs转染SV40后经低浓度血清筛选得到的细胞株。
SAM购自雅培中国,应用含10%胎牛血清的DMEM培养基配制成浓度为10 mmol/L的母液,以0.22 μm微孔滤器过滤,调节pH值至7.4,4 ℃保存备用,保存时间不超过6 h。DMEM高糖培养基、青霉素和链霉素购自美国Gibco公司;胎牛血清、0.25%胰蛋白酶购自美国Hyclone公司;Cell Counting Kit-8(CCK-8)试剂盒、Annexin V-FITC/PI双染细胞凋亡检测试剂盒、BCA蛋白定量试剂购自南京凯基生物科技发展有限公司;PI/RNase染色缓冲液、ECL试剂盒购自美国BD公司;实时定量PCR试剂盒、Trizol试剂购自日本Takara公司;鼠抗人α-SMA抗体、山羊抗鼠IgG、GAPDH抗体购自美国Abcam公司。
二、实验方法
1. 细胞培养:LX-2细胞株采用DMEM培养基(含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素)在37 ℃、5% CO2的培养箱中培养。0.25%胰酶消化传代,取对数生长期的细胞用于后续实验。
2. CCK-8实验:取对数生长期细胞,以100 μL/孔接种于96孔培养板,细胞浓度约5×104/mL,常规培养24 h后细胞贴壁良好,弃上清,改用含不同浓度SAM(0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mmol/L)的培养基,每个浓度设6个复孔。继续培养24 h后轻轻吸去上清液,含胎牛血清培养基100 μL/孔漂洗1次,加入已混匀的含CCK-8的培养基(培养基与CCK-8体积之比为9∶1)100 μL/孔,继续培养1 h后,上酶标仪检测波长为450 nm处的吸光度(A)值。6个复孔的结果去掉最大和最小A值,计算生长抑制率。抑制率(%)=(A对照组-A药物组)/A对照组×100%,并绘制增殖抑制曲线。
3. 流式细胞术:①细胞周期:取对数生长期细胞,加入含不同浓度SAM(0、1.0、2.0、4.0 mmol/L)的培养基,常规培养24 h。采用不含EDTA的胰酶消化,收集约1×106个细胞,离心弃上清,PBS漂洗1次;加入-20 ℃预冷的70%乙醇重悬,4 ℃固定至少24 h;离心弃固定液;PBS漂洗2次,加500 μL PI/RNase缓冲液重悬,室温避光15 min,上机检测细胞周期。②细胞凋亡:取对数生长期细胞,加入含不同浓度SAM(0、1.0、2.0、4.0、8.0 mmol/L)的培养基,胰酶消化、收集1×105~5×105个细胞;加入500 μL Binding Buffer悬浮细胞;先后加入5 μL Annexin V-FITC和5 μL PI,混匀;室温避光反应5~15 min;上机检测。
4. 实时定量PCR法检测细胞周期蛋白D1(cyclin D1) mRNA表达:取对数生长期细胞,加入含不同浓度SAM(0、1.0、2.0、4.0 mmol/L)培养基,常规培养24 h。采用Trizol试剂提取LX-2细胞总RNA并合成cDNA模板。PCR引物由日本Takara公司设计合成,cyclin D1上游:5’-ATG TTC GTG GCC TCT AAG ATG A-3’,下游:5’-CAG GTT CCA CTT GAG CTT GTT C-3’;以GAPDH为内参,上游:5’-GCA CCG TCA AGG CTG AGA AC-3’,下游:5’-TGG TGA AGA CGC CAG TGG A-3’。使用SYBR Green PCR Master Mix试剂盒行PCR,以2-△△Ct法计算目的基因的表达,上ABI 7500 Biosystem行结果分析。
5. 蛋白质印迹法检测α-SMA蛋白表达:取对数生长期细胞,加入含不同浓度SAM(0、1.0、2.0、4.0 mmol/L)的培养基,常规培养24 h。采用细胞裂解液裂解细胞,BCA法蛋白量,行常规SDS-PAGE电泳。5%脱脂奶粉封闭转印膜。加入抗α-SMA单克隆抗体(1∶1 000)4 ℃孵育过夜,辣根过氧化物酶标记的山羊抗鼠IgG抗体(1∶2 500)室温孵育1 h,最后ECL发光液显影。
三、统计学分析

结 果
一、SAM抑制LX-2细胞增殖
CCK-8实验结果显示,随着SAM浓度增加,LX-2细胞增殖抑制率逐渐升高;与对照组相比,3.0~8.0 mmol/L SAM组细胞增殖抑制率明显升高(P<0.05),而1.0、2.0 mmol/L组无明显差异(P>0.05)(见图1)。说明在一定浓度范围内,SAM能抑制LX-2细胞的增殖,并呈剂量依赖效应。

图1 SAM对LX-2细胞增殖的影响
二、SAM阻滞LX-2细胞周期于S期
流式细胞术结果显示,随着SAM浓度的增加,G1/G0期细胞比例逐渐下降(F=20.149,P<0.001),S期细胞比例逐渐升高(F=17.979,P=0.001),G2/M期细胞比例无明确变化趋势。与对照组相比,1.0 mmol/L组G1/G0、S、G2/M期细胞比例均无明显差异(P>0.05);2.0、4.0 mmol/L组G1/G0期细胞比例显著降低(P<0.05),S期细胞比例显著升高(P<0.05),G2/M期细胞比例无明显差异(见表1)。说明SAM可使LX-2细胞周期阻滞于S期。

表1 各组细胞周期分布情况
*与对照组比较,P<0.05
三、SAM诱导LX-2细胞凋亡
流式细胞术结果显示,SAM能诱导LX-2 细胞凋亡,并呈剂量依赖效应。与对照组相比,1.0、2.0 mmol/L组的细胞早期、晚期和总体凋亡率均无明显差异(P>0.05);4.0、8.0 mmol/L组的早期凋亡率显著升高(27.3%、36.8%对7.0%,P<0.05),总体凋亡率亦显著升高(33.3%、44.5%对9.9%,P<0.05),而晚期凋亡率无明显差异(见图2)。
四、SAM 增强cyclin D1 mRNA表达
实时定量PCR法结果显示,不同浓度SAM组cyclin D1 mRNA表达较对照组呈逐渐增高的趋势,其中2.0、4.0 mmol/L组与对照组相比差异有统计学意义(P<0.05)(见表2)。
五、SAM降低α-SMA蛋白表达
蛋白质印迹法结果显示,1.0、2.0、4.0 mmol/L SMA组细胞内纤维化标记物α-SMA蛋白表达均显著低于对照组(P<0.05)(见表2、图3)。

*与对照组比较,P<0.05
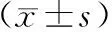
表2 各组cyclin D1 mRNA表达和α-SMA蛋白表达情况
*与对照组比较,P<0.05
1 Da=0.9921 u
讨 论
静息HSCs转化为活化HSCs表型是肝纤维化发生的重要环节,而活化HSCs转化为静息HSCs表型是肝纤维化逆转的关键。因此,抑制甚至逆转活化HSCs是肝纤维化的潜在治疗策略。目前,抑制HSCs活化和抗纤维化的药物层出不穷,但绝大多数仍处于动物实验阶段,尚缺乏能广泛用于临床且疗效显著的药物[5]。
SAM为一种临床应用多年的保肝降黄药物。近年研究发现,体外原代培养的HSCs在自动活化过程中细胞内SAM水平下降,DNA甲基化水平降低,进而促进HSCs活化[6]。同时,有研究表明SAM能调节原代培养HSCs的激活、增殖和收缩能力[3],抑制HSCs的活化[7],在肝纤维化的逆转中起一定作用。SAM抗纤维化的相关作用机制的研究发现,SAM可能通过抑制H2O2介导的信号通路而抑制基质金属蛋白酶抑制剂(TIMP)-1产生以及胶原沉积[4,8];Oliva等[9]发现SAM亦可能通过抑制Toll样受体的上调而发挥抗纤维化作用。但SAM对活化HSCs的作用尚无足够研究证据。国内刘梅等[10]的研究表明SAM能显著抑制活化HSCs的增殖,但目前尚无研究探讨其机制。本研究以活化的人肝星状细胞株LX-2作为研究对象,旨在探讨SAM对HSCs增殖、细胞周期和凋亡等的影响。
本实验参照相关研究[3-4]设置SAM溶液浓度,并由预实验验证。结果显示,在一定浓度范围内(3.0~8.0 mmol/L),SAM能有效抑制LX-2细胞增殖,并呈剂量依赖效应,与Matsui等[3]的研究结果相符。为进一步探讨其作用机制,检测细胞周期发现2.0、4.0 mmol/L SAM将LX-2细胞周期阻滞于S期,上调cyclin D1表达。推测SAM通过上调cyclin D1表达使LX-2细胞周期阻滞于S期,从而发挥抑制细胞增殖的作用。流式细胞术检测发现,4.0、8.0 mmol/L SAM能明显诱导LX-2细胞凋亡;但晚期凋亡率无明显差异,这可能是由于SAM处理时间较短所致。在非毒性浓度下(1.0、2.0 mmol/L SAM组细胞增殖和凋亡率与对照组无明显差异),SAM即可明显抑制活化HSCs的标志性分子α-SMA的蛋白表达,进一步证实SAM能抑制活化HSCs。
综上所述,SAM能抑制LX-2细胞增殖,其机制可能为通过上调cyclin D1表达使LX-2细胞周期阻滞于S期;同时,SAM能诱导LX-2细胞凋亡,下调α-SMA表达;提示SAM能通过影响HSCs的生物学行为而起抗纤维化作用,为进一步探讨SAM对HSCs的机制及其抗纤维化作用奠定一定分子基础。
1 Friedman SL. Mechanisms of hepatic fibrogenesis[J]. Gastroenterology, 2008, 134 (6): 1655-1669.
2 Nieto N, Cederbaum AI. S-adenosylmethionine blocks collagen Ⅰ production by preventing transforming growth factor-beta induction of the COL1A2 promoter[J]. J Biol Chem, 2005, 280 (35): 30963-30974.
3 Matsui H, Kawada N. Effect of S-adenosyl-L-methionine on the activation, proliferation and contraction of hepatic stellate cells[J]. Eur J Pharmacol, 2005, 509 (1): 31-36.
4 Cao Q, Mak KM, Lieber CS. DLPC and SAMe combined prevent leptin-stimulated TIMP-1 production in LX-2 human hepatic stellate cells by inhibiting HO-mediated signal transduction[J]. Liver Int, 2006, 26 (2): 221-231.
5 吴盛迪, 王吉耀. 抗肝纤维化治疗研究进展[J]. 肝脏, 2009, 14 (1): 71-73.
6 Ramani K, Yang H, Kuhlenkamp J, et al. Changes in the expression of methionine adenosyltransferase genes and S-adenosylmethionine homeostasis during hepatic stellate cell activation[J]. Hepatology, 2010, 51 (3): 986-995.
7 Karaa A, Thompson KJ, McKillop IH, et al. S-adenosyl-L-methionine attenuates oxidative stress and hepatic stellate cell activation in an ethanol-LPS-induced fibrotic rat model[J]. Shock, 2008, 30 (2): 197-205.
8 Thompson KJ, Lakner AM, Cross BW, et al. S-adenosyl-L-methionine inhibits collagen secretion in hepatic stellate cells via increased ubiquitination[J]. Liver Int, 2011, 31 (6): 891-901.
9 Oliva J, Bardag-Gorce F, Li J, et al. S-adenosylmethionine prevents the up regulation of Toll-like receptor (TLR) signaling caused by chronic ethanol feeding in rats[J]. Exp Mol Pathol, 2011, 90 (3): 239-243.
10 刘梅, 陆伦根, 窦爱霞, 等. S-腺苷蛋氨酸对人肝星状细胞增殖和氧应激及转化生长因子β1表达的影响[J]. 肝脏, 2007, 12 (2): 99-102.
