两种人胚胎干细胞体外诱导CD34+造血前体细胞方法的比较
2014-09-11董晓雅潘光锦刘加军
董晓雅 潘光锦 刘加军
30多年前小鼠胚胎干细胞的发现开启了人类对于多能干细胞研究的新篇章[1]。至1998年,人胚胎干细胞(hESCs)的发现则为人类再生医学的发展带来了新的希望。目前,我们已能在体外培养由未着床的胚胎内细胞团分离的hESCs,并使其长期维持在未分化的状态。CD34+造血前体细胞在血液病的临床和基础研究中具有潜在的优势。首先,血液系统分级明显,所有血液前体细胞及各类型成熟血液细胞均可由造血干细胞分化发育而来,而对各类细胞我们已有一定程度的了解。其次,体外建立hESCs向造血前体细胞分化的模型有助于我们研究造血早期发育的过程,而此前由于该过程开始于胚胎发育第一周,受条件所限我们很难详细研究。第三,高效的体外诱导分化体系的建立将有助于研究各类血液系统疾病的发生与发展,而诱导得到的造血前体细胞将有可能最终应用于临床造血干细胞的移植[2]。经由hESCs模拟的体外诱导造血发育已先后在多个体系中实现,主要方法包括形成拟胚体的方法,与各类基质细胞系共培养的方法,以及二维单层诱导的方法[3-5]。每种方法均各有特点,鉴于此,我们利用实验室现有资源,对比hESCs/OP9共培养方法和二维单层诱导方法在诱导效率上的差异,以期为后续的早期造血发育研究打好基础。
材料与方法
一、细胞系及主要试剂
hESCs系H1、小鼠骨髓基质细胞系OP9、人胚胎干细胞完全培养基、胚胎干细胞基质胶、胎牛血清、重组人骨形态发生蛋白-4及重组人碱性成纤维细胞生长因子均由中国医学科学院广州健康研究院提供。
二、方 法
1.H1的传代培养方法
选用hESCs完全培养基mTeSR1做常规培养,H1细胞经乙二胺四乙酸(EDTA)处理后,以1∶3~4的比例接种于hESCs基质胶Matrigel(MG)包被的6孔板中,置于5% 二氧化碳、37℃培养箱中培养,每日换液,4 d传一代,将细胞维持在未分化状态[6]。
2.OP9的传代培养方法
用含20%胎牛血清的Alpha-MEM培养液常规培养,OP2细胞用0.25%胰酶消化后,以1∶5的比例接种于0.1% 明胶包被的10 cm盘中,置于5% 二氧化碳、37℃培养箱中培养,4 d传一代,传代间期不换液[7]。
3.hESCs/OP9共培养方法
将未分化的H1在MG包被的6孔板中培养3~4 d,每孔细胞密度达80%,经0.02 g/L分散酶(dispase)处理后,用1 ml枪头轻缓刮散成碎片,加至培养OP9细胞的10 cm盘中,10 cm盘中H1细胞计数约为5×106,培养基为Alpha-MEM加上10%胎牛血清、100μM 硫代甘油。将10 cm盘放至37℃培养箱中培养9 d,并在第4、6、8日半量换液[7]。H1与OP9细胞共培养体系的模式图见图1。在培养过程中应注意OP9细胞密度,防止细胞出现脂肪化。
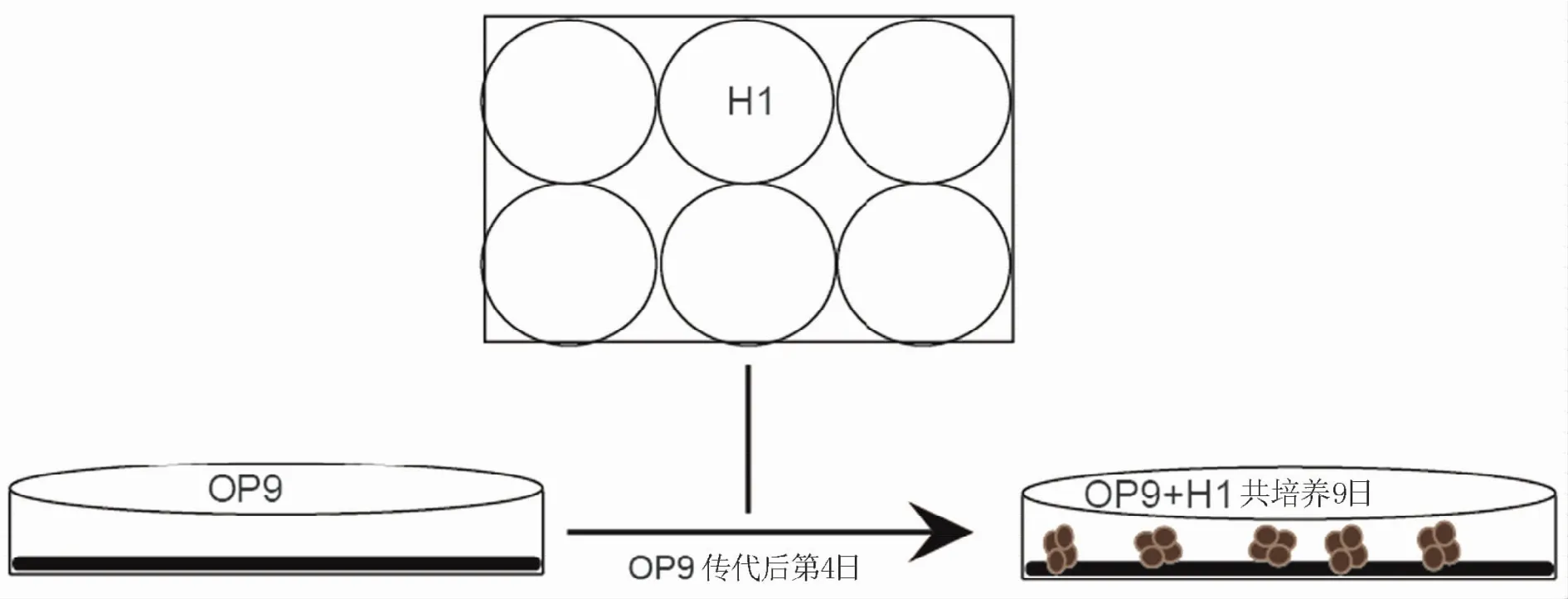
图1 H1与OP9细胞共培养体系模式图
4.H1的二维单层诱导分化方法
将未分化的H1细胞按照上述普通传代方法经EDTA处理后,按照1∶4比例接种到MG包被的6孔板中,并于传代第二日细胞贴壁后更换含有细胞因子的分化培养基,培养基为IMDM培养基,同时添加胰岛素-转铁蛋白-硒添加剂(100×)、硫代甘油(450 mM)、非必需氨基酸(0.1 mM)、左旋谷氨酰胺 (2 mM),重组人骨形态发生蛋白-4(BMP4,50μg/L),重组人血管内皮生长因子(VEGF,50μg/L),重组人碱性成纤维细胞生长因子(bFGF,50μg/L)。隔日半量换液[5]。H1二维单层诱导分化模式图见图2。
5.流式细胞仪检测
取hESCs/OP9共培养分化后第9日和二维单层诱导分化后第6日的细胞,经0.25%胰酶处理后,置15 ml离心管,300×g离心5 min,用流式缓冲液冲洗2遍后,再次离心弃上清液,用1 ml流式缓冲液重悬,70μm滤网过滤,取细胞悬液100μl,加2μl抗人PE-CyTM5-CD34荧光标记抗体,设阴性对照,加入2μl小鼠PE-CyTM5-IgG1κ同型对照抗体。4℃作用30 min,加2 ml流式缓冲液混匀,300×g离心5 min,弃上清液,用200μl流式缓冲液重悬后置4℃,待机检测两类方法体外诱导分化CD34+细胞比例。

图2 H1二维单层诱导分化模式图
三、统计学处理
结 果
一、hESCs/OP9共培养诱导分化情况
镜下观察传代培养的H1细胞贴壁生长,呈未分化状态,单个克隆内细胞排列紧密,视野内无分化细胞,见图3A。OP9细胞传代后亦为贴壁生长,细胞纤长,见图3B。图3C所示为H1细胞贴壁,共培养第1日的细胞形态,由图示可知,此时H1仍处于未分化状态。随着分化过程的进展,在第3~4日,贴壁的H1细胞克隆内逐渐出现分化形态的细胞。而至共培养第9日,如图3D所示,即出现典型放射状囊样结构,出现CD34+细胞。将此时的细胞经胰酶处理后,用流式细胞仪检测CD34+细胞的百分率。

图3 hESCs/OP9共培养诱导分化细胞图
二、H1的二维单层诱导分化
如图4A为传代后贴壁的H1,为典型未分化状态,后更换分化培养基,如图4B在诱导分化第2日H1即出现分化现象,分化第6日,如图4C,细胞密度显著增加且分化明显,产生CD34+细胞。此时将细胞用胰酶处理后,同样用流式细胞仪检测分化细胞中CD34+细胞比例。

图4 二维单层诱导分化细胞图
三、hESCs/OP9共培养方法和二维单层诱导方法得到CD34+细胞的百分率比较
hESCs/OP9共培养方法第9日,CD34+细胞的比例可达(19.7±7.9)%;二维单层诱导方法尽管诱导时间较短,但CD34+细胞的比例仅为(5.8±1.8)%。hESCs/OP9共培养方法诱导效率明显高于二维单层诱导方法(实验独立重复8次,t=3.598,df=7,P=0.009)。见图5。
讨 论
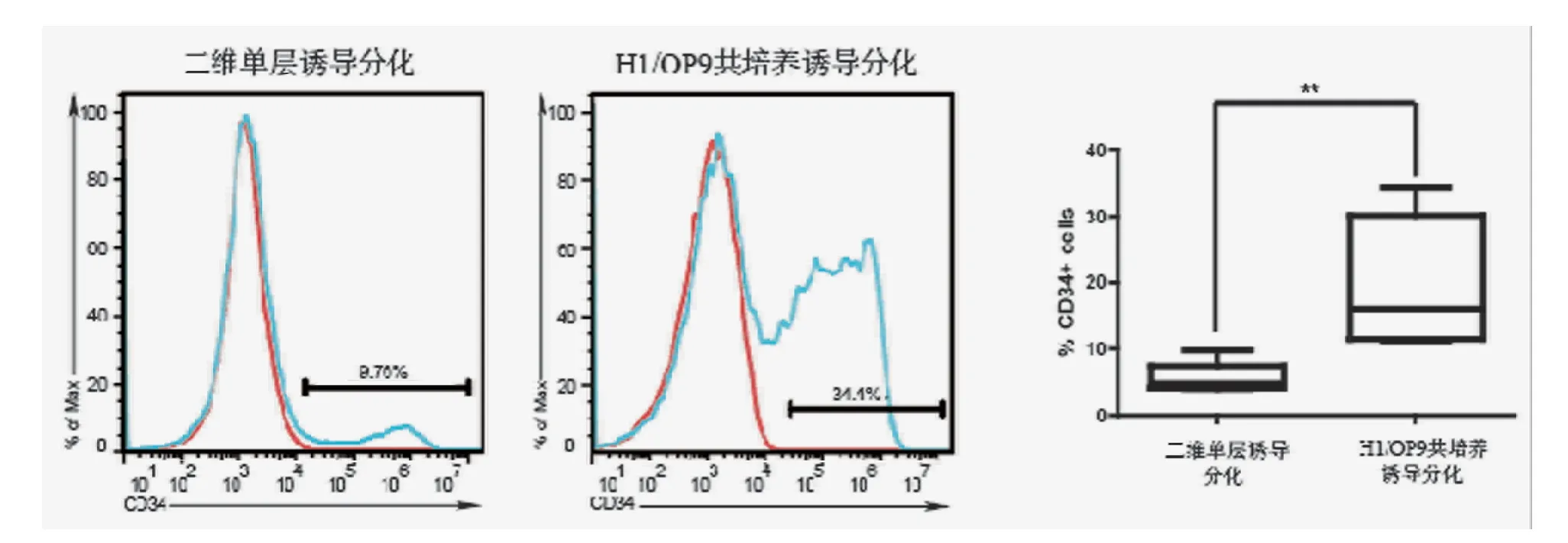
图5 hESCs/OP9共培养和二维单层诱导方法诱导得到CD34+细胞百分率的流式细胞术图
目前,临床上应用最广泛也最成熟的细胞替代治疗方法即造血干细胞的移植。移植细胞的来源主要包括骨髓、动员的外周血以及脐带血干细胞,但此3类细胞在临床应用中均受到数量和质量上的双重限制。尽管越来越多的研究表明,成体造血干细胞可通过体外增殖来满足数量的需求,但是经体外培养的造血干细胞在体内造血重建的能力仍受到质疑。而hESCs则具备体外无限增殖的能力,且能体外诱导分化为各级血液细胞,包括造血干/祖细胞,前体细胞以及各类成熟细胞。且通过不断完善的体外诱导体系,hESCs将有可能满足临床造血干细胞移植的标准,并促使我们加深对人类早期造血发育机制以及各类血液疾病发生发展的认识。
我们的实验涉及了两类具有代表性的诱导体系,其一为将hESCs与骨髓基质细胞系共培养进行体外诱导分化。作为共培养体系,除在本实验中涉及的骨髓基质细胞系OP9外,研究人员曾尝试过多种不同类型,不同来源的基质细胞,如小鼠骨髓基质细胞系S17、小鼠卵黄囊细胞系C166、人胎肝细胞系FH-B-hTERT等[8-10]。但目前应用最为广泛的仍是OP9细胞系,在过去的大量实验研究中,OP9共培养体系曾被用于体外诱导获得血液系统各系前体细胞以及成熟的血液细胞,如淋巴细胞以及巨核细胞[11]。此外,OP9共培养体系还有一个非常重要的优势,即它可以在不添加大量细胞因子的情况下相对高效地诱导hESCs向造血分化,节省了实验成本。另有研究人员曾尝试将拟胚体体外诱导与OP9共培养体系结合,进行造血分化,同样取得了比较好的结果[12]。在本实验中,相对于二维单层诱导的低诱导效率,OP9共培养体系显得更加稳定、高效,因此更适合于后续基础研究的进展。
本实验涉及的第二类诱导体系为二给单层诱导体系,该体系的优势在于能够采用无饲养层无血清且成分完全明确的培养基,在体外直接将人胚胎干细胞诱导为造血前体细胞,这就避免了应用鼠源细胞及异源性血清,进而更容易克服异种问题,有助于未来体外诱导得到的各类血液细胞应用于临床。但该系统较低的诱导效率以及更高的实验成本大大限制了其应用及发展。
OP9共培养体系模拟了骨髓造血微环境,从而为hESCs提供了造血分化的条件,而骨髓微环境是极为复杂的,到目前为止,我们还不能完全了解所有参与造血的细胞因子、化学小分子及各类信号通路,单纯通过提供几类细胞因子而达到体外直接高效诱导造血分化是非常困难的。因此,对于后续基础研究,我们建议以OP9共培养体系为主,深入了解hESCs造血分化的详细过程及各类调控机制,从而不断完善包括这两类诱导体系在内的各类体内、体外造血分化方法,以期在提高诱导效率的同时,也不断提高诱导质量,来满足基础研究和临床应用的需要。
[1]Evans MJ,Kaufman MH.Establishment in culture of pluripotential cells from mouse embryos. Nature,1981,198:154-156.
[2]Lengerke C,Daley GQ.Autologous blood cell therapies from pluripotent stem cells.Blood Rev,2010,24:27-37.
[3]Grigoriadis AE,Kennedy M,Bozec A,et al.Directed differentiation of hematopoietic precursors and functional osteoclasts from human ESand iPScells.Blood,2010,115:2769-2776.
[4]Choi KD,Yu J,Smuga-Otto K,et al.Hematopoietic and endothelial differentiation of human induced pluripotent stem cells.Stem Cells,2009,27:559-567.
[5]Salvagiotto G,Burton S,Daigh CA,et al.A defined,feeder-free,serum-free system to generate in vitro hematopoietic progenitors and differentiated blood cells from hESCs and hiPSCs.PLoSOne,2011,6:e17829.
[6]Ludwig TE,Bergendahl V,Levenstein ME,et al.Feeder-independent culture of human embryonic stem cells.Nat Methods,2006,3:637-646.
[7]Choi KD,Vodyanik M,Slukvin II.The hematopoietic differentiation and production of mature myeloid cells from human pluripotent stem cells.Nat Protoc,2011,6:296-313.
[8]Lim WF,Inoue-Yokoo T,Tan KS,et al.Hematopoietic cell differentiation from embryonic and induced pluripotent stem cells.Stem Cell Res Ther,2013,4:71.
[9]Moon SH,Kim JM,Hong KS,et al.Differentiation of hESCs into mesodermal subtypes:vascular-,hematopoietic and mesenchymal-lineage cells.Int J Stem Cells,2011,4:24-34.
[10]Bouhassira EE.Concise review:production of cultured red blood cells from stem cells.Stem Cells Transl Med,2012,1:927-933.
[11]Matsubara Y,Ono Y,Suzuki H,et al.OP9 bone marrow stroma cells differentiate into megakaryocytes and platelets.PLoSOne,2013,8:e58123.
[12]Woods NB,Parker AS,Moraghebi R,et al.Brief report:efficient generation of hematopoietic precursors and progenitors from human pluripotent stem cell lines.Stem Cells,2011,29:1158-1164.
