蛋白酶及其活性检测方法研究进展
2014-09-10孙梅好陈果果倪逸琳
徐 滕,孙梅好,陈果果,倪逸琳,张 静
(浙江师范大学化学与生命科学学院,浙江金华321004)
蛋白酶(Protease)又称蛋白水解酶[1]。自1905年10月 1日,Levene[2]发表了《The Cleavage Products of Proteoses》,至今,对蛋白酶的研究仅仅经过100多年,已有35万篇与蛋白酶相关的文献。蛋白酶参与DNA遗传信息的传递、血管生成、创伤修复、干细胞动员、止血、凝血、炎症反应、免疫反应、细胞自噬、衰老、坏死和细胞凋亡等生物过程[3-4]。许多蛋白酶已经成为疾病预测及诊断的生物标志,在药物治疗方面为我们提供了新的方向。
1 蛋白酶的种类
蛋白酶最初分为:内肽酶切割蛋白质内部的肽键和外肽酶(氨肽酶和羧肽酶)切割其相应的底物NH2和COOH末端[5]。根据其催化机理,蛋白酶又可以分为2类:一类利用活化的水分子作为亲核试剂攻击底物中的肽键,催化底物反应,包含了天冬氨酸蛋白酶和金属蛋白酶;另一类蛋白酶是利用其活性位点的氨基酸残基作为亲核试剂,包括半胱氨酸、丝氨酸和苏氨酸[6]。不同种类的蛋白酶又可以根据其氨基酸序列以及蛋白三维结构进一步分为不同的蛋白酶家族。
1.1 半胱氨酸蛋白酶
其也被称为硫醇蛋白酶,是降解蛋白质的酶。在一些水果中,半胱氨酸蛋白酶比较常见,如木瓜、菠萝、无花果和猕猴桃等。目前,已知几十个不同植物科的胶乳含有半胱氨酸蛋白酶[7]。
半胱氨酸蛋白酶在生理和发育过程中发挥多方面的作用。在植物中,它们参与信号传导、生物和非生物胁迫。在人类中,它们参与细胞的衰老和凋亡、MHCII类免疫应答、激素原的加工和细胞外基质重塑等。在炎症疾病(如动脉粥样硬化)中,半胱氨酸蛋白酶可加速胶原蛋白和弹性蛋白的降解[8]。
1.2 丝氨酸蛋白酶
丝氨酸蛋白酶(或丝氨酸内肽酶)是裂解肽键的蛋白质酶,其中,活性中心的亲和氨基酸为丝氨酸[9-10]。它们是在真核生物和原核生物中普遍存在的酶。根据丝氨酸蛋白酶的结构可以分为两大类:胰凝乳蛋白酶类和枯草杆菌蛋白酶类[11]。在人类中,它们参与各种生理过程,包括消化、免疫应答、凝血和繁殖等。
捕食线虫性真菌分泌胞外蛋白酶固定线虫并降解其体壁,从而发挥杀线虫效应,丝氨酸蛋白酶便是其中之一[12]。
1.3 金属蛋白酶
金属蛋白酶是一类催化反应时需要金属离子参与的蛋白酶,大多数金属蛋白酶需要锌离子参与,有一些蛋白酶需要钴离子参与。EDTA能够螯合二价阳离子,抑制金属蛋白酶的活性[13]。
1.4 天门冬氨酸蛋白酶
天门冬氨酸蛋白酶催化蛋白降解时需要用天门冬氨酸残基。在一般情况下,它们在活性位点有2个高度保守天门冬氨酸残基,并且其在酸性pH值时具有最高活性。几乎所有已知的天门冬氨酸蛋白酶都能被胃蛋白酶抑制剂所抑制。在脊椎动物、真菌和逆转录病毒中,天门冬氨酸肽酶均已被鉴定[14]。
1.5 苏氨酸蛋白酶
苏氨酸蛋白酶活性中心具苏氨酸残基,此酶的原型是蛋白酶体的催化亚基。苏氨酸蛋白酶使用其N-末端的苏氨酸仲醇作为亲核基团进行催化[15-16]。
2 蛋白酶的功能及其应用
在进化的初始阶段,蛋白酶有可能仅仅作为蛋白质分解所必须的一种破坏性酶,并参与原始生物中氨基酸的生产。在很长一段时期内,蛋白酶研究主要集中在其原始功能蛋白质的分解[5]。然而,此类酶除了具有这些非特异性降解的功能外,更能够作为一种分子工具,催化高度特异性蛋白水解,产生新的蛋白质产物,这些发现开创了蛋白酶研究的一个新时代[17]。
蛋白水解酶具有多种生理功能,从宏观的蛋白质消化到微观的调节过程。酶原的激活、血液凝固和纤维蛋白凝块的裂解、蛋白激素前体和活性肽的释放、跨膜蛋白的分泌等都需要蛋白酶的参与。另有研究表明,蛋白酶在植物的生长、发育、死亡及其对周围环境的适应中也同样具有重要的生物学功能。许多致病微生物的繁殖需要蛋白酶的参与,有些蛋白酶还作为微生物的毒力因子。
正是由于蛋白酶在细胞的各种行为、在生物的生存以及死亡中扮演着重要的角色。疾病能够导致蛋白质水解系统发生变化,如癌症、神经变性疾病、炎症和心血管疾病等。许多蛋白酶已经成为潜在的药物靶点和疾病诊断以及预测的生物标志。
蛋白酶制剂目前已在饲料生产加工中得到应用。在家畜养殖过程中,部分蛋白饲料未能充分利用而直接被排出体外,其原因可能是由于其自身内源酶分泌不足与饲料中含大量抗营养因子,从而影响其蛋白质等营养物质的消化吸收[18]。在饲料中添加蛋白酶制剂能促进畜禽对养分的消化、吸收,提高饲料的利用率,促进生长。蛋白酶制剂也可用于动物生产中,对提高其生产性能起到很大的作用[19]。
蛋白酶也是生物技术研究的重要工具,在表达蛋白时,有时需要与特定的亲和性标签融合表达、纯化目的蛋白,但标签可能会影响目的蛋白的活性,需要用蛋白酶去除标签。目前,在比较常用的蛋白酶中,3C蛋白酶在低温下也具有良好的活性,使其应用时更有前景[20-21]。
3 蛋白酶活性的检测方法
蛋白酶的生化分析类型可分为2类:均相检测和分离型检测。在均相检测中,无需进行进一步的加工,即可在反应混合液中检测到底物信号转变;在分离型检测中,酶反应停止后反应混合液中的产物以及残余的底物需要经过进一步的分离定量来检测反应的进行。
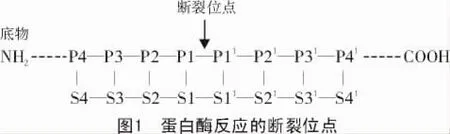
一般蛋白酶切反应底物是易断裂的酰胺键,底物可以是蛋白质也可以是合成的多肽。图1显示,底物氨基酸在易断裂的氨基端编号为P1,P2和P3等(称为P位点),最接近易断裂位置的氨基酸残基编号为P1。羧基端的命名与氨基端一致,该残基被编号为 P1',P2',P3'等(称为 P'点)。不同的蛋白酶其易断裂酰胺键两侧的氨基酸数目不同:氨肽酶的底物在易断裂酰胺键位点的氨基端只有1,2个氨基酸残基;羧肽酶的易断裂位点的羧基端也只有1,2个氨基酸残基;但是在内肽酶底物的易断裂位点两侧有数个氨基酸残基。
3.1 均相检测蛋白酶活性
均相检测无需将溶液中的产物和底物分离,它依赖于底物的物理性改变,通过荧光或发色基团等报告基团标记,底物的物理性变化表现为荧光或者比色度的改变。
许多荧光标记技术已被应用于蛋白酶活性的检测。目前,检测蛋白酶活性应用广泛的有4种方法:化学淬灭染料、荧光能量共振转移(FRET)、双标签荧光淬灭、荧光偏振强度。
3.1.1 通过化学淬灭染料测定蛋白酶活性 荧光染料通过共价键连接到多肽羧基端作为蛋白酶活性的指示剂,蛋白酶识别多肽并与其形成复合物,切割底物的酰胺键。荧光染料连接到多肽的羧基端,荧光染料荧光淬灭,蛋白酶识别多肽序列进行切割时,荧光染料与多肽分离,荧光强度急剧上升(图2)。在一定范围内,被释放荧光染料的强度与酶活性成线性关系。其中,最常用的荧光染料是香豆素衍生物和若丹明[22-23]。

氨基酸P'位点的C端需连接荧光基团,且需保持蛋白酶识别位点周围氨基酸序列的完整性。特别是内肽酶等需严格保持断裂位点周围序列的完整性,对底物修饰应避免在P'位点相邻的位置。
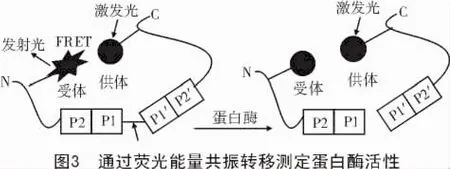
3.1.2 通过荧光能量共振转移(FRET)测定蛋白酶活性 FRET(Fluorescence Resonance Energy Transfer)即荧光共振能量转移:当2个发射荧光的物质距离比较接近时,一个荧光分子能够将能量转移到另外相近的一个荧光分子。基于以上要求,FRET被应用到蛋白酶活性检测中,此方法中,2种荧光基团连接到多肽链的两端,一个为供体,另一个为受体。供体的发射波长与受体的激发波长重叠,当用激发光激发供体时,供体发射出的荧光被受体接收并发射出特定波长的荧光。选择供体和受体位置时,不能影响蛋白酶识别序列的完整性,并且它们之间距离足够近,能产生FRET信号。随着肽链的断裂,荧光基团相互分离,FRET信号减弱(图3)。
3.1.3 通过双标签荧光淬灭机理测定蛋白酶活性
在某些条件下需要检测上升信号,基于这种需求,双标签荧光淬灭被应用到检测蛋白酶活性中[24]。供体荧光激发波谱与受体吸收波谱的最大波峰重叠,受体与供体距离足够近,供体的发射光被重新吸收,导致荧光信号强度较低。蛋白酶将肽链断裂,供体与受体分离,受体不能接受供体发射的荧光,导致观察到的供体荧光强度增加。在这种情况下,供体仅作为呈现酶活性的报告基团,而受体仅仅作为供体的荧光淬灭剂(图4)。

DeNEDDylases和DeSUMOlyases的酶活性应用此种方法检测[25-26]。DeNEDDylases和DeSUMOlyases通过切割NEDD8或者SUMO与被修饰蛋白之间的连接键,催化一些蛋白质的去NEDD化修饰和去SUMO化修饰。
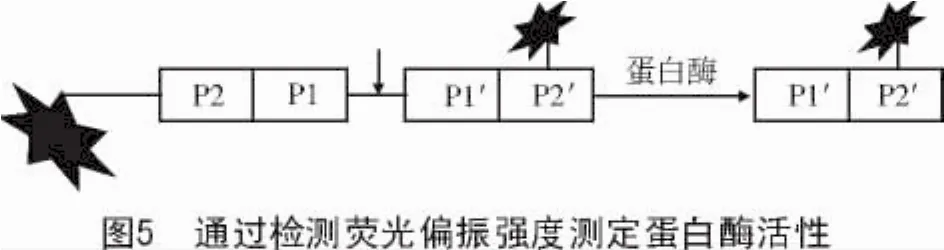
3.1.4 通过检测荧光偏振(FP)强度测定蛋白酶活性 荧光偏振分析[27]有时也被称作消化荧光偏振法。蛋白质或者多肽被标记一个或多个荧光染料,底物体积将会变得较大,转动变慢,通常会表现出较大的偏振信号。蛋白酶切割底物时,大型底物转化为小的片段,小分子的转动速度快,测量的荧光偏振程度较低(图5)。
FP分析可用于测定竞争结合试验。在这种情况下,所监测的偏振信号来自于荧光标记的多肽底物。当多肽底物与较大蛋白质相互作用而形成较大的复合子时,而小分子竞争物与蛋白质结合阻止荧光标记的多肽与蛋白质结合,多肽则会保持较高的转动速度,呈现较低的荧光偏振信号。因此,当FP信号下降时,表明存在小分子能与标记肽竞争结合蛋白酶的底物结合位点。
值得一提的是,FP测量的荧光偏振与非荧光偏振比值仅仅是在一定的浓度范围内准确可靠,超过这一浓度范围检测敏感度会下降,从而限制该方法的应用。
3.2 基于分离的活性检测试验
基于标记肽的检测方式为检测蛋白酶活性提供了便利的条件,它不仅适合于大文库的筛选,也能记录酶活反应的动力学数据。动力学数据则进一步反映了复合物与靶点相互作用的具体信息(如抑制剂的时间依赖性,与靶点的解离常数等)。
然而,某些情况下底物不能被标记,或者标记的底物不能满足测定要求,一种基于分离的检测方法应运而生。将酶活反应停止于预先确定的线性范围内,底物的转化量必须达到检测的水平,将反应混合液中的组分分开,分别测量。反应液中的底物与产物通常通过高效液相色谱法等方法分离,然后通过柱层析或者质谱检测,液相色谱和质谱原理已经很明确,且具有高通量检测平台。例如,一种多微型通道高效液相系统可以同时运行多个微型柱,其适用于筛选较大复合物集合。此外,BIOCIUSLife Sciences已开发RapidFireTM高通量质谱系统,其可以以每秒一个样品的速度运行[28-29]。均相检测不适合检测蛋白酶活性时,可以采用该方法初步测定蛋白酶酶活。
4 改进型蛋白酶活性的测定方法
近年来,随着技术的发展,多种新型的蛋白酶活性检测方法得到应用。其中一种是利用石墨烯氧化物作为新型平台来检测蛋白酶活性:利用其荧光淬灭特性以及结合多肽的能力,石墨烯氧化物与荧光标记多肽分别作为FRET中的供体及受体。标记的多肽结合到石墨烯氧化物基底上,而蛋白酶切割多肽使得荧光染料与石墨烯氧化物分离,促使荧光强度增强。
电化学方法也可以用来检测蛋白酶活性,该方法是利用高聚阴离子或者阳离子作为底物,具体为富含精氨酸的鱼精蛋白和多硫酸戊聚糖(PPS,一种高度硫酸化多糖)的配合物。由于蛋白酶将精蛋白切割为较小的片段,产生游离的PPS,通过聚阴离子敏感膜电极检测其电位变化。因此,游离的PPS产生速率与溶液中蛋白酶活性成正比[30]。这种方法可在10 min内检测蛋白酶活性,与之前检测鱼精蛋白消耗的方法[31-32]相比毫不逊色。
在过去的10 a中,已有许多蛋白酶活性检测方法的报道,但其中大部分方法都是费时的、不切实际的。因此,开发简单、快速、灵敏、高通量的常规测定方法势在必行。
[1]路英华.蛋白酶的研究进展[J].生命科学信息,1991,8(2):8.
[2]Levene PA.Thecleavageproductsof proteoses[J].Journal of Biological Chemistry,1905,1(1):45-58.
[3]Hans Neurath,Kenneth A Walsh.Roleof proteolytic enzymesin biological regulation(areview)[J].Proceedingsof the National Academyof Sciences,1976,73(11):3825-3832.
[4]Michael Ehrmann,Tim Clausen.Proteolysis as a regulatory mechanism[J].Annu Rev Genet,2004,38(3):709-724.
[5] Carlos López-Otín,Judith S Bond.Proteases:multifunctional enzymes in life and disease[J].Journal of Biological Chemistry,2008,283(45):30433-30437.
[6] Katsuhisa Saeki,Katsuya Ozaki,Tohru Kobayashi.Detergent alkaline proteases:enzymatic properties,genes,and crystal structures[J].Journal of Bioscienceand Bioengineering,2007,103(6):501-508.
[7]Jerzy MBehnke.Developing novel anthelmintics from plant cysteine proteinases[J].Parasites&Vectors,2008,1(1):29.
[8]Harold A Chapman.Emerging roles for cysteine proteases in human biology[J].Annual Review of Physiology,1997,59(1):63-88.
[9] Lizbeth Hedstrom.Serine protease mechanism and specificity[J].Chemical Reviews,2002,102(12):4501-4524.
[10]Praveen K Madala,Joel DA Tyndall,Tessa Nall,et al.Update1 of:Proteases universally recognize beta strands in their active sites[J].Chemical Reviews,2011,110(6):1-31.
[11] Gábor Iván,Zoltán Szabadka,Rafael Ördög,et al.Four spatial pointsthat defineenzymefamilies[J].Biochemical and Biophysical Research Communications,2009,383(4):417-420.
[12]王瑞,王军,杨晓野.少孢节丛孢菌丝氨酸蛋白酶基因同源性分析[J].华北农学报,2013,28(1):123-127.
[13] Noel Vinay Thomas,Se-Kwon Kim.Metalloproteinase inhibitors:statusand scopefrommarineorganisms[J].Biochemistry Research International,2010(2):184-190.
[14] Eric T Baldwin,T Narayana Bhat,Sergei Gulnik,et al.Crystal structuresof nativeand inhibited formsof human cathepsin D:implications for lysosomal targeting and drug design[J].Proceedings of the National Academy of Sciences,1993,90(14):6796-6800.
[15]James A Brannigan,Guy Dodson,Helen JDuggleby,et al.A protein catalytic framework with an N-terminal nucleophile is capable of self-activation[J].Nature,1995,78:644.
[16] Hua Cheng.DOM fold:A structure with crossing loops found in DmpA,ornithine acetyltransferase,and molybdenum cofactor bindingdomain[J].Protein Science,2005,14(7):1902-1910.
[17]刘玉德,曹雁平.生物蛋白肽的开发研究展望 [J].食品科学,2002,23(8):319-320.
[18]闻治国.不同酶制剂水平对北京填鸭生长性能、血浆生化指标和肝脏组织学的影响[J].华北农学报,2012,27(6):78-83.
[19]李林珂,高玉千,崔锦,等.一株蛋白酶产生菌的筛选及酶学性质研究[J].河南农业科学,2006(3):50-52.
[20] Sreedevi Nallamsetty.Efficient site-specific processing of fusion proteinsby tobaccovein mottlingvirusproteasein vivoand in vitro[J].Protein Expression and Purification,2004,38(1):108-115.
[21]Cordingley M G,Pia L Callahan.Substrate requirements of human rhinovirus 3Cprotease for peptide cleavage in vitro[J].Journal of Biological Chemistry,1990,265(16):9062-9065.
[22] Kazuo Murakami,Tamiko Ohsawa.New fluorogenic substrates for renin[J].Analytical Biochemistry,1981,110(1):232-239.
[23] Zimmerman M,Ashe B,Yurewicz E C,et al.Sensitive assays for trypsin,elastase,and chymotrypsin using new fluorogenic substrates[J].Analytical Biochemistry,1977,78(1):47-51.
[24] Brian Y Feng,Anang Shelat,Thompson N Doman,et al.High-throughput assays for promiscuous inhibitors[J].Nature Chemical Biology,2005,1(3):146-148.
[25]Grzegorz Nalepa.Drug discovery in the ubiquitin-proteasome system[J].Nature Reviews Drug Discovery,2006,5(7):596-613.
[26]Lynn Bedford,James Lowe,Lawrence R Dick,et al.Ubiquitin-like protein conjugation and the ubiquitin-proteasome system as drug targets[J].Nature Reviews Drug Discovery,2011,10(1):29-46.
[27]朱广华,郑洪,鞠烷先.荧光偏振免疫分析技术的研究进展[J].分析化学,2004,32(1):102-106.
[28] Tom GHolt,Bernard K Choi,Neil SGeoghagen,et al.Label-free high-throughput screening via mass spectrometry:a single cystathionine quantitative method for multiple applications[J].Assay and Drug Development Technologies,2009,7(5):495-506.
[29] Can C Özbal,William A LaMarr.High throughput screening via massspectrometry:acasestudy usingacetylcholinesterase[J].Assay and Drug Development Technologies,2004,2(4):373-382.
[30]Jaemyung Kim.Graphene oxide sheets at interfaces[J].Journal of the American Chemical Society,2010,132(23):8180-8186.
[31] Jong Hoon Yun,Mark E Meyerhoff.Protamine-sensitive polymer membrane electrode:characterization and bioanalytical applications[J].Analytical Biochemistry,1995,224(1):212-220.
[32] Ibrahim HA Badr,Narayanan Ramamurthy.Electrochemical assay of proteinase inhibitors usingpolycation-sensitive membraneelectrodedetection[J].Analytical Biochemistry,1997,250(1):74-81.
