嗜水气单胞菌生物被膜形成突变株的筛选及其特性
2014-09-10马有智于媛媛舒妙安徐海圣
马有智,于媛媛,舒妙安,胡 斌,徐海圣*
(1.浙江大学动物科学学院,浙江杭州 310058;2.湖州市杨家埠街道农业公共服务中心,浙江湖州 313005)
嗜水气单胞菌生物被膜形成突变株的筛选及其特性
马有智1,于媛媛1,舒妙安1,胡 斌2,徐海圣1*
(1.浙江大学动物科学学院,浙江杭州 310058;2.湖州市杨家埠街道农业公共服务中心,浙江湖州 313005)
为研究调控基因对嗜水气单胞菌生物被膜的形成机制,本研究利用二亲本结合转座的方法,将携带mTn5gusA-pgfp21的载体pFAJ1819导入嗜水气单胞菌野生株AH7中进行转座突变。通过对153株突变株的生物被膜测定,筛选出形成被膜能力较高的AHΔ82和形成被膜能力较低的AHΔ148。扫描电镜观察显示AHΔ82生物被膜最致密,其次是AH7,AHΔ148较疏松。SDS-PAGE电泳表明,与AH7相比,两个突变株在25 ku和35 ku之间缺少一条带,AHΔ82比野生株多3条蛋白条带。毒力测定表明3株细菌的毒力强度为:AH7>AHΔ148>AHΔ82,突变株毒力降低。实验结果提示Tn5转座子的插入突变影响细菌生物被膜的形成和毒力。
嗜水气单胞菌;生物被膜;Tn 5;突变株
嗜水气单胞菌(Aeromonas hydrophila)为有鞭毛、无荚膜的革兰氏阴性短杆菌,是广泛存在于水生环境中的一种常见条件致病菌,可以引起鱼类、蛙类等水生动物的疾病[1]。生物被膜(Biofilms,BF)是细菌为适应生存环境,在生长过程中不可逆地粘附于固体表面形成的具有一定结构的微生物群体,其外包裹了一层自分泌的胞外多糖类基质[2]。研究发现,A.hydrophila在水生环境中能够形成BF,进而在水体中增殖。BF的形成能够增强细菌的抗药性,还能使细菌逃避机体的免疫防御反应,并且在细菌的感染过程中发挥重要作用,与细菌毒力和持续感染密切相关[3]。本实验利用mTn5转座子进行转座突变,并筛选A.hydrophilaBF形成突变株,利用扫描电镜观察了突变株BF的结构特征和形成过程,探讨了A.hydrophila毒力与BF的关系,为深入研究A.hydrophila的致病机理奠定基础。
1 材料和方法
1.1 菌株、质粒及培养条件E.coilS17-1λpir(Smr,recA,thi,pro,hsdR M+RP4:2-Tc:Mu:Km:Tn7,λpir),含有质粒pFAJ1819(AprKmr,mTn5gusA-pgfp21),由广西大学分子遗传研究所提供。A.hydrophilaAH7菌株由本实验室自患病棘胸蛙肝脏分离鉴定;AH7菌株及其突变株在脑心浸出液(BHI)培养基中28℃培养24 h,E.coil在37℃培养16 h。所用抗生素的终浓度分别为氨苄青霉素(Ap)50 μg/mL、卡那霉素(Km)50 μg/mL、萘啶酮酸(Nal)50 μg/mL。
1.2 试验动物 试验用斑马鱼购自杭州花鸟市场,采用充分曝气的清水饲养。
1.3 菌株A H 7突变体的制备 参照文献[4]的方法,通过双亲本结合的方法将携带mTn5gusA-pgfp21的载体 pFAJ1819导入 AH7中。将E.coilS17-1λpir作为供体菌,AH7菌株作为受体菌。以0.0l mol/L MgSO4溶液将供体菌和受体菌分别洗涤2次后,按照1∶3的比例混匀,0.45 μm无菌滤膜过滤,取下滤膜置于BHI平板中央,于37℃培养36 h。用0.01 mol/L的MgSO4溶液将滤膜上生长的菌苔洗下,适当比例稀释后涂布于含有Nal和Km的BHI平板上进行选择培养。
1.4 A H 7突变株的筛选和鉴定 挑取在Nal和Km抗性选择平板上生长的细菌克隆,液体培养基培养过夜,煮沸法提取细菌基因组DNA作为PCR反应模板。通过PCR扩增mTn5gusA-pgfp21中的gusA基因和gfp基因来鉴定突变株,扩增引物分别为:PgusA1:5'-GGTACCTGACTAGCTAAGGAGGAGT-3',PgusA2:5'-ACCGTTGATTCATTGTTTGCCT-3';Pgfp1:5'-TTGGTACCATGGCTAGCAAAGGAGAAG-3',Pgfp2:5'-TAGGGCCCTTATTTGTAGAGCTCATCC-3',由上海生工生物工程技术服务有限公司合成。PCR扩增后经1%琼脂糖凝胶电泳检测PCR产物。
1.5 突变株B F测定和粘附程度的测量 体外BF形成测定方法参照文献[5]的微孔板法进行适当改进。每株细菌设8个重复,以不含细菌的培养液为空白对照。
依据临界OD570nm(ODc)即空白孔的平均OD570nm值(X)加上3倍标准差(SD)作为判断BF与接触表面粘附的牢固程度:OD≤ODc为不粘附(0),ODc
1.6 生物被膜的扫描电镜观察 将细菌过夜培养液按1∶20稀释转接到24孔细胞培养板,各孔中垂直放置无菌盖玻片,28℃分别培养6 h、24 h、72 h后,取出盖玻片,制片观察。
1.7 S D S-P A G E检测 将AH7及突变株在BHI培养基培养过夜,调整OD600nm至1.8,离心收集菌体,制备全细胞蛋白,进行SDS-PAGE电泳分析。
1.8 半数致死量(L D50)测定 将筛选和鉴定的突变体于28℃过夜培养,取1 mL菌液离心收集菌体,PBS洗3次,平板计数,调整细菌浓度为107cfu/mL,并进行2倍连续稀释。选取不同的稀释度腹腔接种经MS-222麻醉的斑马鱼(10 μL/尾),每组接种20尾。对照组注射等量PBS。水温29℃~30℃分组饲养,观察斑马鱼的死亡情况,连续观察5 d,计算LD50值。
1.9 最小抑菌浓度(MI C)的测定 选用四环素、红霉素、链霉素、氯霉素、恩诺沙星和环丙沙星等6种药物,按照NCCLS(1999)《抗微生物药物敏感试验的执行标准》,采用96孔板二倍稀释法,测定其MIC值。
1.10 统计分析 生物被膜OD570nm值数据以X±SD表示,进行统计学分析t检验。
2 结 果
2.1 突变体的筛选与鉴定 对153个菌株进行PCR鉴定,结果显示有147个菌株扩增出约1.9 kb和750 bp的片段,表明这些菌株已发生转座突变。其中野生株 AH7与生物被膜突变株 AHΔ82和AHΔ148的PCR鉴定结果见图1。

图1 突变株染色体DNA中gusA与gfp基因的检测Fig.1 Detection ofgusAandgfpgene inserted in chromosomal DNA of mutants by PCR
2.2 突变株B F的测定 对已鉴定的147个突变株和野生株进行成膜能力测定,分别经过3次重复试验显示,与野生株AH7相比,大多数菌株成膜能力降低,少部分成膜能力增强。选取在BF测定试验中分别处于较高水平的AHΔ82和较低水平AHΔ148两株突变株作为进一步研究对象,这两株突变株的BF形成能力与野生株AH7均有极显著差异(p<0.01)(表 1)。
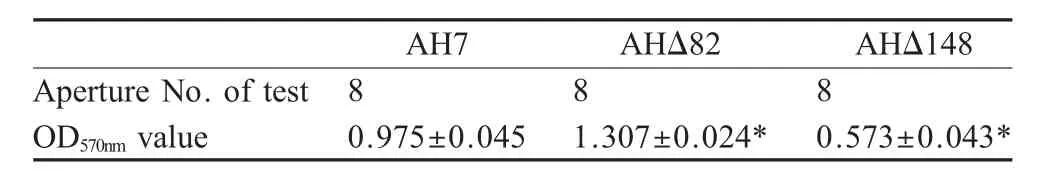
表1 野生株与突变株BF形成量的比较Table 1 Comparing biomass of the biofilm formation between wild type and mutant types(p<0.01)
2.3 B F的扫描电镜观察 分别将AH7及其突变株AHΔ82和AHΔ148进行不同时间培养后,用扫描电镜观察BF的结构特征和形成过程(图2)。培养6 h时显示,与AH7相比较,突变株AHΔ82形成的BF较为致密,而突变株AHΔ148形成的BF较稀疏;培养至24 h时,AH7及突变株BF中细菌数均减少,结构变疏松,细菌呈单层分布;当培养至72 h时,AH7生物被膜成片粘连,无明显的菌体,而突变株AHΔ82和AHΔ148菌体尚清晰。
2.4 S D S-P A G E检测 对野生株AH7及其突变株AHΔ82、AHΔ148的等量的全菌裂解物进行 SDSPAGE电泳检测。与野生株AH7相比,两个突变株在25 ku和35 ku之间均缺少一条带;在25 ku下方,AHΔ82比 AH7和 AHΔ148多 3条带,但在 100 ku处,AHΔ82缺少一条带(图3)。

图2 野生株AH7和突变株AHΔ82、AHΔ148生物被膜的电镜扫描Fig.2 Scanning electron micrographs of AH7,AHΔ82 and AHΔ148

图3 野生株AH7和突变株AHΔ82、AHΔ148的全细胞蛋白SDS-PAGEFig.3 SDS-PAGE of whole cell proteins of AH7,AHΔ82 and AHΔ148
2.5 L D50的测定 野生株AH7的LD50值为2.828×103cfu,突变株 AHΔ82 的 LD50值为 1.027×105cfu,突变株 AHΔ148的 LD50值为 1.47×104cfu,表明突变株毒力较野生株毒力降低。
2.6 MI C的测定 突变株对6种常用抗生素的MIC测定结果显示,四环素、红霉素、氯霉素和恩诺沙星对野生株和突变株的MIC相同,链霉素和环丙沙星对突变株AHΔ82的MIC较野生株降低(表2)。

表2 野生株与突变株对不同抗生素的MIC的比较Table 2 Comparision of the MIC between wild type and mutant types
3 讨 论
mTn5gusA-pgfp21转座子构建于自杀性质粒pUT,序列中有来自R6K质粒的π蛋白依赖性复制起点,因此质粒只能在表达π蛋白的菌株中复制,如 λpir 溶源性感染的E.coliS17-λpir(SmR)、SM10-λpir(KmR)和 CC118-λpir。质粒中有 RP4 质粒的转移起点oriT,因此可以接合性转移至受体菌。另外序列中还带有Tnp5基因,编码转座酶,是mini-Tn5转座所必需的。转座时该片段不进入受体菌的染色体,因此转座后染色体上的转座片段不会发生二次转移。当转座子随机插入到受体菌的染色体上某个基因后,可以引起该基因突变,导致受体菌表型发生改变。插入突变后,受体菌获得抗Km表型,也可以通过PCR扩增插入的gusA基因和gfp基因片段进行鉴定。本研究利用mTn5gusA-pgfp21转座子进行二亲本接合构建了AH7的突变体库,筛选BF形成量发生变化的突变株,并对两株典型突变株的一些生物学特性进行了分析。
通过对l47株嗜水气单胞菌突变株的BF进行测定筛选,挑选出成膜能力较强和较弱的两株突变株。两株突变株BF形成能力发生变化,可能是由于Tn5的插入影响了与BF形成相关的功能基因或调控基因,从而使BF的构成成分发生变化。SDS-PAGE结果显示,两株突变株与野生株的蛋白产生有差异,表明这些差异蛋白可能与BF的形成有关,而许多研究也证明蛋白质是BF的关键成分,如金黄色葡萄球菌发现有Bap(BF相关蛋白)和E.coli和部分沙门氏菌的菌毛蛋白和鞭毛蛋白等均参与BF的形成[7]。
本实验结果显示两株突变株除了成膜能力改变外,其毒力和对一些抗生素的敏感性也发生了变化。与野生株相比,两株突变株对斑马鱼的毒力均减弱,但减弱程度不同,提示转座子插入到了不同的与毒力相关的基因,因此引起的毒力变化程度不一,这也与嗜水气单胞菌有多种毒力因子的特征相符合。MICs测定结果显示,只有突变株AHΔ82对链霉素和环丙沙星的敏感性增强,表明BF的形成与细菌毒力和耐药性有一定的关系。本实验结果显示,BF形成量较大的突变株AHΔ82毒力反而较小,而BF较小的AHΔ148的毒力反而较大,这与一些研究结果不相符合[8]。但突变株AHΔ82毒力较弱,对一些抗生素的敏感性相应也强,这与文献报道相符[9-10]。
[1]张翠娟,于宙亮,赵宝华,等.嗜水气单胞菌研究进展[J].中国兽药杂志,2008,42(7):46-47.
[2]Costeron J W,Lewandowski Z,Caldwell D E,et al.Microbial biofilms[J].Anna Rev Microbial,1995,49:711-745.
[3]Elena V K,Vsevolod L P,Jian S,et al.Mutation in the S-ribosylhomocysteinas(luxS)gene involved in quorum sensing affects biofilm formation and virulence in a clinical isolate ofAeromonas hydrophila[J].Microb Patho,2008,45:343-354.
[4]申佩弘,晁红军.利用双标记mTn5构建甲基杆菌MB200突变体库[J].山西农业科学.2008,36(11):26-30.
[5]Stepanovic S,Vukovic D,Dakic I,et al.Modified microtiterplate test for quantification ofstaphylococcalbiofilm formation[J].J Microbiol Meth,2000,40:175-179.
[6]段韵涵,韩北忠,杨葆华,等.培养条件对金黄色葡萄球菌生物被膜生长的影响[J].中国酿造,2008,(1):18-20.
[7]Karatan E,Watnick P.Signals,regulatory networks,and materials that build and break bacterial biofilms[J].Microbiol Mol Biol R,2009,73:310-347.
[8]Chu Wei-lua,Jiang Yan.Role of the quorum-sensing system in biofilm formation and virulence ofAeromonas hydrophila[J].Afr J Microbiol Res,2011,5(32):5819-5825.
[9]Gong Jian-sen,Xu Ming,Zhu Chun-hong,et al.Antimicrobial resistance,presence ofintegronsand biofilm formation ofSalmonellaPullorum isolates from eastern China(1962-2010)[J].Avi Patho,2013,42(3):49-55.290-294.
[10]Vavala E,Colone M,Passariello C,et al.Characterization of biofilms in drug-sensitive and drug-resistant strains ofCandida albicans[J].J Chemoth,2013,25(2):87-95.
Construction and character of biofilm mutants ofAeromonas hydrophicaby the transposon of mTn5gusA-pgfp21
MA You-zhi1,YU Yuan-yuan1,SHU Miao-an1,HU Bin2,XU Hai-sheng1*
(1.College of Animal Science,Zhejiang University,Hangzhou 310058,China;2.Public Service Center of Agriculture of Yangjiabu in Huzhou,Huzhou 313005,China)
Characterization of the functional genes and related regulation elements is the basis to understand the mechanism of bacterial biofilm formation.In the present study,the suicide plasmid pFAJ1819,carrying a transposon mTn5gusA-pgfp21,was transferred to the recipientAeromona hydrophilaAH7 strain to generate an insertional mutant library by cell conjugation between the donorEscherichia coliS17-1λpir(pFAJ1819)and the recipientA.hydrophila.A total of 153 mutants were screened and two mutants named AHΔ148 and AHΔ82 stably exhibited differences in biofilm formation.The morphological differences of biofilms of AHΔ148,AHΔ82 and AH7 were observed by scanning electron microscopy,of which AH7 and AHΔ82 developed higher density biofilm than AHΔ148.In addition,SDS-PAGE analysis showed that the protein patterns had a slightly difference between the mutant and parental bacteria.However,the pathogenicity tests displayed a trend of attenuated virulence for the mutatedA.hydrophila,which the medial lethal dose were 2.828×103cfu for AH7,1.027×104 cfu for AHΔ148 and 1.027×105cfu for AHΔ82 tested in zebra fish.These results demonstrated that the insertion of Tn5-transposon affected the formation of bacterial biofilm and virulence.
Aeromonas hydrophica;biofilm;Tn5;mutant
S852.6
A
1008-0589(2014)04-0265-04
10.3969/j.issn.1008-0589.2014.04.03
*Correspondingauthor
2013-05-12
浙江省重点科技创新团队计划项目(2011R50029);湖州市科技计划项目(2011GN07、2012GN13)
马有智(1963-),陕西杨凌人,博士,副教授,主要从事动物微生物学基础理论与应用研究.
*通信作者:E-mail:hsxu@zju.edu.cn
(本文编辑:彭永刚)
