腹泻型肠易激综合征患者肠道目标菌群的分析
2014-09-08李小萍王巧民宋继中沈佐君
李小萍,王巧民,褚 源,宋继中,沈佐君
腹泻型肠易激综合征患者肠道目标菌群的分析
李小萍1,王巧民1,褚 源1,宋继中1,沈佐君2
目的 研究腹泻型肠易激综合征(IBS-D)患者与正常对照者的肠道菌群差异。方法 实时荧光定量PCR法检测50例IBS-D患者及25例正常对照者粪便中长双歧杆菌属、乳酸杆菌属、脆弱拟杆菌、产气荚膜梭菌、大肠杆菌和粪肠球菌属的数量,并对各组的目标菌群数量进行比较,计算肠道定值抗力,肠道定值抗力(CR)是指肠道内需氧的潜在致病菌群被肠道内源性厌氧菌抑制的能力,双歧杆菌数值与肠杆菌数值之比作为肠道微生物定值抗力的指标,即B/E值。结果 与正常对照者比较,IBS-D患者粪便中大肠埃希菌、产气荚膜梭菌的数量明显增多(P<0.05),而乳酸及双歧杆菌属的数量明显减少(P<0.05),粪肠球菌、脆弱拟杆菌在两组之间比较差异无统计学意义。IBS-D患者B/E值<1,与正常对照者比较明显降低(P<0.05)。结论 IBS-D患者肠道菌群平衡被打破,表现为B/E值降低,且粪便中肠杆菌及产气荚膜梭菌数量增加,双歧杆菌、乳酸杆菌的数量明显减少。
肠易激综合征;肠道菌群;实时荧光定量PCR
肠易激综合征(irritable bowel syndrome,IBS)是胃肠道功能紊乱的一种常见病,其特征是病因不明的腹痛伴随排便习惯及大便性状的改变。尽管IBS不会带来严重的疾病,但它却降低了患者的生活质量[1]。传统研究肠道菌群的分离培养方法对培养条件要求较高、费时费力,且大部分肠道共生菌为专性厌氧菌,在体外无法培养。近年来研究者开始应用分子生物学方法研究肠道菌群。该研究应用实时荧光定量PCR法对腹泻型(IBS-D)患者及正常对照者粪便内目标菌群进行分析,比较两组间粪便菌群的差异。
1 材料与方法
1.1 病例资料 根据罗马Ⅲ诊断标准[2],收集2013年1月~7月于安徽医科大学附属省立医院门诊就诊的IBS-D患者50例(男30例,女20例);年龄18~70(44.82±13.50)岁。有下列情况的IBS-D患者将被排除在外:①年龄<18岁;② 怀孕、哺乳期或无法合作者;③ 在过去的4周内使用过抗生素;④曾有重大的或复杂的腹部手术史者;⑤ 存在严重系统性疾病或子宫内膜异位症,或被诊断患有老年痴呆症。所有参与实验组的研究对象均有临床及内镜下胃肠检查或近1年内有钡剂灌肠检查。正常对照组的粪便标本选自年龄、性别与患者组匹配的25例正常对照者,男15例,女10例;年龄18~70(38.76±9.33)岁。要求两组留取粪便标本前4周内没有消化道不适症状,且没有使用过抗生素或微生态制剂。
1.2 试剂与仪器
1.2.1 主要试剂 血平板、营养琼脂平板、TPY琼脂平板及改良MRS(实验室自备);DNA提取试剂盒(德国Qiagen公司);DNA切胶回收试剂盒、2×Taq PCR Master Mix(美国Axygen公司);2×SYBR®PremixExTaqTM(北京康为世纪生物科技有限公司)。
1.2.2 主要仪器 YQX-Ⅱ手套式厌氧培养箱(上海新苗医疗器械制造有限公司);-80℃冰箱;7500型实时荧光定量PCR仪(美国ABI公司)。
1.2.3 6 种标准菌株 从广东环凯微生物科技有限公司购买大肠埃希菌(Escherichia coli,8379)、粪肠球菌(Enterococcus faecalis,29212)、嗜酸乳杆菌(Lactobacillus acidophilus,1.1878)、长 双 歧 杆 菌(Bifidobacteria longum,15701)、产气荚膜梭菌(Clostridium perfringens,13124)、脆弱拟杆菌(Bacaeroides fragilis,25285)的冻干粉4~8℃保存备用。
1.3 方法
1.3.1 6 种标准菌株的复苏、培养 取适量脑心浸液与标准菌株冻干粉充分混匀,长双歧杆菌(接种于TPY琼脂平板)、嗜酸乳杆菌(接种于改良MRS)、产气荚膜梭菌(接种于血平板)及脆弱拟杆菌(接种于血平板)置入YQX-Ⅱ手套式厌氧培养箱中,大肠埃希菌(接种于营养琼脂平板)及粪肠球菌(接种于营养琼脂平板)置于恒温培养箱,37℃恒温培养24~72 h后挑单一菌落,接种于相应的培养基中连续培养1代(条件同上),培养完成后放置4℃保存。
1.3.2 6 种标准菌株DNA的提取 挑取单一菌落的细菌菌落,用比浊法使浓度控制在2×1012cfu/L,再提取DNA,测其浓度后于-20℃保存。
1.3.3 粪便标本收集、DNA提取 排便后迅速收集粪便标本于无菌的培养皿中,并于2 h内置于-80℃保存。提取DNA,测其浓度后于-20℃保存。
1.3.4 6 种细菌 PCR 引物设计 参照文献[3-4],根据大肠埃希菌、粪肠球菌、脆弱拟杆菌、产气荚膜梭菌、乳酸杆菌及长双歧杆菌16S rDNA基因序列设计各菌种特异性PCR引物,见表1。

表1 靶基因PCR扩增引物序列
1.3.5 6 种引物的特异性检测 分别取6种标准菌株基因组DNA与1个正常对照者的粪便基因组DNA行普通PCR实验。20 μl的反应体系,反应条件:94℃预变性3 min;94℃变性30 s、T℃(大肠埃希菌53℃,粪链球菌51.8℃,嗜酸乳杆菌52℃,长双歧杆菌53.5℃,脆弱拟杆菌52℃,产气荚膜梭菌51.8℃)退火30 s,72℃延伸1 min,共35个循环,72℃复性5 min。以2 000 bp DNA Ladder为Marker,扩增产物在1.2%琼脂糖凝胶中电泳。
1.3.6 6 种细菌标准品的制备 取6种标准菌株的DNA进行普通PCR实验(反应体系和条件同上),接着在1.2%琼脂糖凝胶中电泳,然后在紫外分光光度计下尽量完全切下含目的基因产物的条带,按DNA切胶、回收试剂盒行标准菌株DNA扩增产物的纯化、回收,测其浓度后于-20℃保存。
1.3.7 6 种细菌标准曲线制作 用上述纯化、回收后的标准菌株DNA作为荧光定量PCR的标准品,按照测定的浓度,换算成各标准品1 μl的拷贝数(大肠埃希菌5.36×109、粪肠球菌1.27×1010、嗜酸乳杆菌5.34×109、长双歧杆菌 7.51×109、脆弱拟杆菌1.04×1010、产气荚膜梭菌7.02×109)用于制作标准曲线。将各菌株稀释成为1×1010~1×103copies/ml作为标准品,进行SYBR GreenⅠ实时荧光定量 PCR 反应,20 μl反应体系:2×SYBR®PremixExTaqTM10 μl,DNA 模板 2 μl,ddH2O 7 μl,20 μmol/L上下游引物各0.5 μl;反应步骤:95℃预变性3 min;95℃变性10 s,T℃ (大肠埃希菌61℃,粪肠球菌60℃,嗜酸乳杆菌属58℃,双歧杆菌属57.5℃,脆弱拟杆菌58℃,产气荚膜梭菌55℃),退火30 s,65℃延伸10 s,共40个循环。反应完毕后读取荧光定量PCR数据,分析溶解曲线。根据读取的荧光数据,由系统软件自动分析Ct值,同时生成标准曲线。
1.3.8 检测粪便标本 两组粪便提取的DNA分别进行6种细菌的16S rDNA荧光定量PCR反应,反应体系和条件与制备标准曲线时一致。所有标本实时荧光定量PCR反应均同时做3个平行复孔。将每个粪便标本检测得到的结果转换为靶细菌的基因组在1 g粪便中的平均估计值(湿重)。
1.4 统计学处理 采用SPSS 20.0统计软件进行分析,数据以±s表示,两独立样本比较采用t检验。
2 结果
2.1 PCR产物鉴定 用1.2%琼脂糖凝胶电泳,分别分析6种标准菌株、正常对照者及IBS-D患者粪便中的普通PCR产物,可见6种标准菌株PCR扩增产物均为单一的条带,与预期的DNA片段长度一致,能够用于定量PCR反应。见图1。
2.2 6 种细菌的扩增图谱分析 各标准品被10倍稀释后行实时荧光定量PCR反应,可得模板循环数(Ct值)与荧光强度的关系图,6种细菌的定量分析在指数扩增期进行。见图2。
2.3 6 种细菌的标准曲线分析 以实时荧光定量PCR反应过程中达到荧光阈值的初始循环数(Ct)作为横坐标,不同拷贝数的标准品的对数作为纵坐标,为待测样本的定量分析提供了参考标准,见图3。
2.4 6 种细菌的溶解曲线分析 溶解曲线分析是在PCR从95~60℃(0.3℃/循环)缓慢冷却过程中进行的,同时检测SYBR GreenⅠ信号强度,6种细菌的溶解曲线均为单一峰,说明与定量PCR荧光染料结合的为单一的目的片段DNA,见图4。

图1 6种细菌PCR产物凝胶电泳图
2.5 实验组与正常对照组粪便细菌的定量检测及定值抗力(B/E)值的比较 与正常对照组比较,实验组粪便中大肠埃希菌、产气荚膜梭菌的数量明显增多(P<0.05),而乳酸及双歧杆菌属的数量明显减少(P<0.05),肠道定值力B/E<1,与正常对照组比较明显减低(P<0.05),但粪肠球菌、脆弱拟杆菌在两组之间比较差异无统计学意义,见表2。
表2 粪便标本目标细菌定量结果(log10±s,log10对数平均目标基因组拷贝数/克湿便)
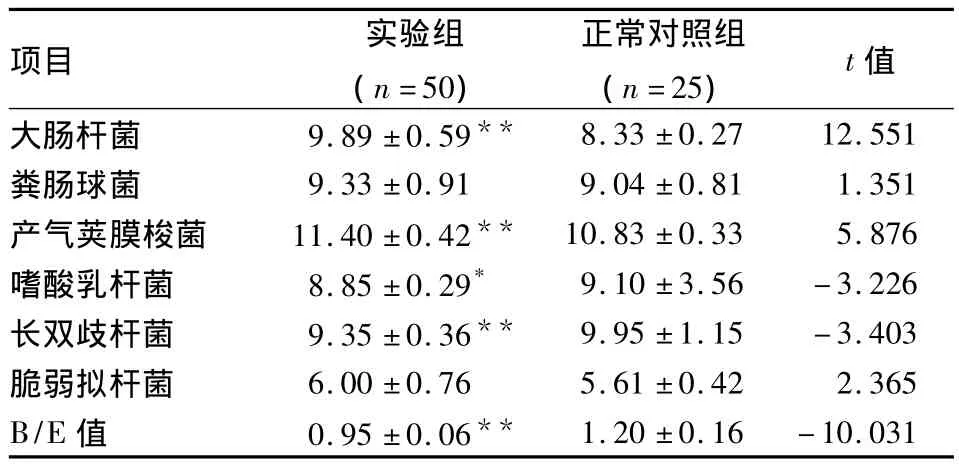
表2 粪便标本目标细菌定量结果(log10±s,log10对数平均目标基因组拷贝数/克湿便)
与正常对照组比较:*P <0.05,**P <0.01
项目 实验组(n=50)正常对照组(n=25) t值大肠杆菌 9.89 ±0.59**8.33 ±0.27 12.551粪肠球菌 9.33 ±0.91 9.04 ±0.81 1.351产气荚膜梭菌 11.40±0.42** 10.83±0.33 5.876嗜酸乳杆菌 8.85±0.29* 9.10±3.56-3.226长双歧杆菌 9.35±0.36** 9.95±1.15-3.403脆弱拟杆菌 6.00 ±0.76 5.61 ±0.42 2.365 B/E 值 0.95 ±0.06**1.20 ±0.16-10.031
3 讨论
肠道正常菌群对于宿主个体来说非常重要。然而,属于正常菌群的细菌似乎也能够在某些个体或情况下引起疾病。实验[5-7]表明肠道正常菌群的改变在IBS发生发展中起着主要作用。本研究与国内外部分报道[8-10]的菌群变化趋势一致,通过对IBSD患者肠道微生态菌群分析发现,相对于正常对照者腹泻型IBS患者粪便中的双歧杆菌、乳酸杆菌比例明显降低,肠杆菌、产气荚膜梭菌比例明显升高;双歧杆菌/肠杆菌(B/E)<1,这反映了微生物抗移植性降低,易使潜在性致病菌及外来致病菌生长[11]。结果显示IBS-D患者存在肠道菌群数量的增减和比例失调以及菌种性质的变化,表明IBS-D与肠道菌群失调有一定的相关性。

图2 6种标准品实时荧光定量PCR扩增图谱

图3 6种细菌的标准曲线
图4 6种细菌产物的溶解曲线
人体肠道菌群在肠腔内形成3个生物层:深层的紧贴黏膜表面并与黏膜上皮细胞粘连形成细菌生物膜,该菌群称为膜菌群,主要由双歧杆菌和乳酸杆菌组成,这两类菌是肠共生菌,是肠道菌中最具生理意义的两种细菌,对机体有益无害;中层为粪杆菌、消化链球菌、韦荣球菌和优杆菌等厌氧菌;表层的细菌可游动称为腔菌群,主要是大肠埃希菌、肠球菌等好氧和兼性好氧菌。IBS患者肠道菌群包括肠腔内菌群即粪便菌群和黏膜相关菌群,目前的研究主要集中于粪便菌群,但肠道膜菌群亦在维持肠道功能中发挥重要作用,菌群与肠黏膜黏附、嵌合形成膜菌是产生肠道微生物B/E的重要因素,构成肠黏膜生物屏障,防止肠道上皮与致病菌接触,维持肠道正常生理功能。Carroll et al[12]对10例IBS-D患者和10例健康自愿者的粪便和远端结肠黏膜细菌进行比较,结果表明结肠黏膜上皮和腔内微生态环境有所差异。Kerckhoffs et al[13]采用PCR和变性梯度凝胶电泳法(DGGE)分析37例IBS患者和20例健康受试者的十二指肠黏膜刷片和粪便标本,结果显示IBS患者的十二指肠黏膜刷片和粪便标本所含铜绿假单胞菌较健康受试者显著升高。
由于肠道细菌的组成复杂,且肠道黏膜层的细菌与肠腔内和肠道细胞表面的细菌有很大不同,所以粪便菌群是否能代表结肠菌群的状况以及肠道菌群改变与IBS的关系尚有待更深入的研究。
[1]Talley N J.Functional gastrointestinal disorders as a public health problem[J].Neurogastroenterol Motil,2008,20(Suppl1):121-9.
[2]陆再英,钟南山,谢 毅,等.内科学[M].7版.北京:人民卫生出版社,2008:426-7.
[3]Kanseng B,Kaldhusdal M,Rudi K.Comparison of chicken gut colonisation by the pathogensCampylobacter jejuniandClostridium perfringensby real-time quantitative PCR[J].Mol Cell Probes,2006,20(5):269-79.
[4]Rinttil T,Kassinen A,Malinen E,et al.Development of an extensive set of 16S rDNA-targeted primers for quantification of pathogenic and indigenous bacteria in faecal samples by real-time PCR[J].J Appli Microbiol,2004,97(6):1166-77.
[5]Parkes G C,Brostoff J,Whelan K,et al.Gastrointestinal microbiota in irritable bowel syndrome:their role in its pathogenesis and treatment[J].Am J Gastroenterol,2008,103(6):1557- 67.
[6]Gecse K,Róka R,Ferrier L,et al.Increased faecal serine protease activity in diarrhoeic IBS patients:a colonic lumenal factor impairing colonic permeability and sensitivity[J].Gut,2008,57(5):591-9.
[7]Tana C,Umesaki Y,Imaoka A,et al.Altered profiles of intestinal microbiota and organic acids may be the origin of symptoms in irritable bowel syndrome[J].Neurogastroenterol Motil,2010,22(5):512-9.
[8]崔舒晟,胡 颖.培菲康治疗前后肠易激综合征患者相关肠道益生菌群变化分析[J].徐州医学院学报,2010,30(1):45-8.
[9]Carroll I M,Ringel-kulka T,siddle J P,et al.Alterations in composition and diversity of the intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome[J].Neurogastroenterol Motil,2012,24(6):521-30,e248.
[10]Krogius-Kurikka L,Lyra A,Malinen E,et al.Microbial community analysis reveals high level phylogenetic alterations in the overall gastrointestinal microbiota of diarrhoea-predominant irritable bowel syndrome sufferers[J].BMC Gastroenterol,2009,9(1):1-11.
[11]吴仲文,李兰娟,马伟航,等.肠道微生物定值抗力的新指标B/E 值[J].浙江预防医学,2000,2(7):4-5.
[12]Carroll I M,Chang Y H,Park J,et al.Luminal and mucosal-associated intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome[J].Gut Pathogens,2010,2(1):19.
[13]Kerckhoffs A P,Ben-Amor K,Samsom M,et al.Molecular analysis of faecal and duodenal samples reveals significantly higher prevalence and numbers of Pseudomonas aeruginosa in irritable bowel syndrome[J].J Med Microbiol,2011,60(2):236-45.
Analysis of patients with intestinal target bacteria diarrhea type irritable bowel syndrome
Li Xiaoping,Wang Qiaomin,Chu Yuan,et al
(Dept of Gastroenterology,The Affiliated Provincial Hospital of Anhui Medical University,Hefei230001)
ObjectiveTo study on intestinal flora in diarrhea predominant irritable bowel syndrome(IBS-D)with differences between normal people.MethodsThe real-time fluorescence quantitative PCR assay was used in 50 patients with diarrhea predominant IBS and 25 normal control subjects in feces to detectBifidobacteria longum,Lactobacillus,Bacteroides,Clostridium perfringens,Escherichia coliandEnterococcus faecalisnumber.The target bacteria in the number in each group were compared,and calculated intestinal colonization resistance.Intestinal resistance value(coloniza-tion resistance,CR)was a potential aerobic intestine by intestinal pathogens in anaerobic inhibition ability of endogenous bifidobacteria value and the value as the ratio of intestinal Enterobacteriaceae micro-bial resistance value of the index,namely B/E values.ResultsCompared with the normal control group,feces of patients with diarrhea predominant IBS in numbers ofEscherichia coliand Clostridium perfringens increased significantly(P<0.05),while the number ofLactobacillusandBifidobacteriadecreased significantly(P<0.05),no statistically significant difference between the two groups inEnterococcus faecalisandBacteroides fragilis.Patients with intestinal diarrhea predominant IBS constant force B/E <1,compared with the control group decreased significantly(P<0.05).ConclusionDiarrhea predominant IBS patients of intestinal flora balance is broken,for gut setting value is reduced,and the feces ofEscherichia coliandClostridium perfringensincrease in number,number ofBifidobacterium,Lactobacillusdecreased.
irritable bowel syndrome;intestinal flora;real-time fluorescence quantitative PCR
R 574.4
A
1000-1492(2014)05-0653-06
2013-12-12接收
安徽省卫生厅医学科研课题(编号:13zc031)
安徽医科大学附属省立医院1消化内科、2检验科,合肥230001
李小萍,女,硕士研究生;
王巧民,女,教授,主任医师,硕士生导师,责任作者,E-mail:wqmin928@163.com
