苦参中lavandulyl侧链取代的黄酮抑制钠-葡萄糖协同转运蛋白2活性的研究
2014-09-07林亲雄梅之南杨光忠杨新洲
杨 静, 汪 超, 林亲雄, 梅之南, 杨光忠, 杨新洲
(中南民族大学 药学院, 武汉 430074)
苦参中lavandulyl侧链取代的黄酮抑制钠-葡萄糖协同转运蛋白2活性的研究
杨 静, 汪 超, 林亲雄, 梅之南, 杨光忠, 杨新洲*
(中南民族大学 药学院, 武汉 430074)
对1个含400种中草药和民族药的组分库进行活性筛选,结果显示苦参的乙酸乙酯萃取部位具有良好的抑制钠-葡萄糖协同转运蛋白2(SGLT2)的活性.在生物活性导向分离策略下,运用制备型高效液相色谱技术对活性的乙酸乙酯萃取部位的成分进行了分离纯化,基于理化性质和波谱数据鉴定了所分离的16个lavandulyl基取代黄酮的化学结构,并首次系统地报道了lavandulyl基取代黄酮的SGLT2抑制活性,活性部位中两个主要成分(-)-kurarinone和sophoraflavanone G显示出最强的SGLT2抑制活性,它们的IC50值分别为2.24 μmol/L和1.45 μmol/L.
苦参; 化学成分; Lavandulyl黄酮; SGLT2抑制剂
糖尿病(Diabetes mellitus,DM)是一种多病因的代谢性疾病,其特点是慢性高血糖,伴随因胰岛素(Insulin)分泌或作用缺陷所引起的糖、脂肪和蛋白质代谢紊乱[1].Ⅱ型糖尿病占患者群体的90%以上,目前全世界糖尿病例约2.9亿,成为继心血管和肿瘤疾病之后,威胁人类健康的第3大疾病[2].在我国,已有9 200万糖尿病患者,患病率达9.7%,另有15.5%的人处在患病边缘,给我国社会医疗保障体系带来极大负担[3].
苦参是使用历史悠久的传统中药,它是豆科槐属植物苦参(Sophoraflavescens)的根.苦参又名苦甘草、苦豆根、西豆根、野槐根、山槐根等.苦参性苦、寒,具清热燥湿、杀虫、利尿等功效;用于热痢、便血、黄疸尿闭、赤白带下、阴肿阴痒等.据文献报道,苦参主要含两种化学成分:生物碱和黄酮,它们显示多种生物活性和药理功效[4-5],一直受到各国药学与化学工作者的关注.笔者对含400种中草药和民族药的组分库的抑制钠-葡萄糖协同转运蛋白2(SGLT2)的活性筛选中发现,苦参的乙酸乙酯萃取部位显示潜在的SGLT2抑制活性.运用制备型高效液相技术对乙酸乙酯萃取部位进行活性导向的放大分离纯化得到16个lavandulyl基取代的黄酮,基于理化性质和波谱数据,分别鉴定为kushenol H(1)、kushenol K(2)、kurarinol(3)、kushenol Y(4)、kushenol P(5)、norkurarinone(6)、kushenol I(7)、kushenol N(8)、(-)-kurarinone(9)、kushenol X(10)、neokurarinol(11)、kushenol C(12)、sophoraflavanone G(13)、leachianone A(14)、kuraridine(15)、kushenol A(16).本文首次系统地报道了系列lavandulyl基取代黄酮具有明显的SGLT2抑制活性,并初步探讨其构效关系.所有的化合物均显示出良好的SGLT2抑制活性,对SGLT2的抑制活性的IC50范围在1.45 μmol/L和37.6 μmol/L之间,其中苦参乙酸乙酯部位的两个主要成分(-)-kurarinone和sophoraflavanone G显示出最强的SGLT2抑制活性,它们的IC50值分别为2.24 μmol/L和1.45 μmol/L.
1实验器材
1.1仪器与试剂
紫外光谱:Shimadzu UV-250型紫外光谱仪;质谱:Finnigan MAT-95型质谱仪,Q-TOF Micro LC-MS质谱仪;核磁共振波谱:Bruker DRX-500 MHz核磁共振仪;中压色谱制备系统:Alga公司;Waters 2535半制备制备型高效液相:2998二极管阵列检测器,2707自动进样器;Sunfire C18半制备柱(Waters,250 mm × 19 mm,5 μm);薄层色谱硅胶和柱色谱硅胶:青岛海洋化工厂;HPLC级甲醇和乙腈:Merck.
1.2植物材料
苦参(Sophoraflavescens)于2011年8月购买于广西南宁市水街中草药药材市场,经广西药用植物园袁经权副教授鉴定,药材标本(编号20110045SF)存放于中南民族大学药学院标本馆.
2实验方法
2.1SGLT2抑制活性筛选[6-7]
以人正常肾组织Human cDNA(Invitrogen, Carlsbad, CA)为模板进行PCR扩增获得Human SGLT2(hSGLT2)基因序列,将hSGLT2序列克隆到pCDNA3.1(+)载体得到质粒,然后将质粒稳定的转染到CHO细胞中.通过对G418抵抗及对14C-α-甲基-D-吡喃葡萄糖苷的吸收活性的测试筛选能稳定表达hSGLT2的CHO细胞.钠依赖的葡萄糖转运测试:将稳定表达hSGLT2的CHO细胞接种于96孔板中,采用含10%胎牛血清的RPMI1640培养基培养(接种密度为5×104个/孔),于37℃、5%CO2培养箱中培养;24 h后,细胞用预处理液(10 mmol/L HEPES,5 mmol/L Tris,140 mmol/L choline chloride,2 mmol/L KCl,1 mmol/L CaCl2,1 mmol/L MgCl2,pH 7.4)在37℃孵育10 min.然后用含有14C-α-甲基-D-吡喃葡萄糖苷(8.0 μmol/L)和抑制剂的吸收缓冲液(10 mmol/L HEPES,5 mmol/L Tris,140 mmol/L NaCl,2 mmol/L KCl,1 mmol/L CaCl2,1 mmol/L MgCl2,1 mmol/L AMG,pH 7.4)在37℃孵育细胞,2 h后用洗涤缓冲液(含有10 mmol/L的常温预处理液)冲洗细胞两次,然后用液体闪烁计数器测量放射强度,实验数据用Graph Pad PRISM.1软件进行非线性回归分析,计算IC50值.
2.2提取与分离
干燥的苦参根粉末30 g,倒入1根φ300 mm×40 mm的玻璃层析柱中,加入1 000 mL的分析纯石油醚连续渗滤,流速为5 mL/min,以除去油脂类成分;石油醚渗滤完成后,加入1 500 mL分析纯乙酸乙酯连续渗滤,流速为7 mL/min,渗滤完成后,渗滤液减压浓缩得2.4 g乙酸乙酯萃取部位. 2.0 g乙酸乙酯萃取部位溶解于8.0 mL甲醇中,运用制备型高效液相直接进样进行分离,每次进样1.0 mL,选用Sunfire C18半制备柱(Waters,250 mm × 19 mm,5 μm),采用混合流动相(85%水∶15%乙腈→20%水∶80%乙腈,50 min,流速9.0 mL/min,其中两相分别含0.1%甲酸)梯度洗脱,按照色谱峰洗脱顺序进行收集,重复上面的分离操作7次,合并保留时间相同的色谱峰,得到峰1(含化合物1和化合物2,Rt9.4 min),峰2(含3,Rt10.4 min),峰3(含4,Rt11.6 min),峰4(含5,Rt12.5 min),峰5(含6,Rt13.5 min),峰6(含7和8,Rt14.4 min),峰7(含9,Rt15.7 min),峰8(含10,Rt17.3 min),峰9(含11和12,Rt18.4 min),峰10(含13,Rt19.3 min),峰11(含14,Rt22.1 min),峰12(含15,Rt23.2 min),峰13(含16,Rt24.4 min).所有收集的色谱峰运用葡聚糖LH-20柱(φ450 mm×10 mm)进行再次纯化得到纯的化合物3(12.3 mg),4(4.8 mg),5(5.6 mg),6(9.7 mg),9(139 mg),10(7.7 mg),13(11.6 mg),14(6.9 mg),15(4.9 mg),16(3.8 mg).峰1采用制备薄层层析法以混合展开剂(二氯甲烷∶甲醇∶甲酸=100∶10∶0.3)展开分离得到纯的化合物1(7.1 mg)和化合物2(8.5 mg);峰6采用制备薄层层析法以混合展开剂(二氯甲烷∶甲醇∶甲酸=120∶10∶0.3)展开分离得到纯的化合物7(8.8 mg)和化合物8(5.7 mg);峰9采用制备薄层层析法以混合展开剂(二氯甲烷∶甲醇∶甲酸=140∶10∶0.3)展开分离得到纯的化合物11(6.2 mg)和化合物12(8.7 mg).
3实验方法与结果
3.1基于制备型高效液相色谱的快速分离纯化方法的建立
半制备和制备型高效液相色谱系统组成:Waters 2535液相系统、2998二级管阵列检测器和2707自动进样器(Waters, Milford, MA, USA),Sunfire C18半制备柱(Waters,250 mm × 19 mm,5 μmol/L).在室温下,用含0.1%甲酸的水和乙腈两相洗液以9.0 mL/min流速梯度洗脱,流动相中乙腈线性梯度为30 min内,从5%增加到100%(体积比),在100%乙腈时维持5 min,进样EtOAc部位溶液20 μL,紫外检测波长范围在200~400 nm之间,选择检测波长为254 nm,所得的色谱图见图1A.该色谱图和积分数据的记录使用Empower 3色谱处理软件.
基于进样少量乙酸乙酯萃取部位样品色谱图(图1A)中各个色谱峰的分离情况,考虑到放大制备样品的成本消耗,优化的制备色谱条件为:采用同一根Sunfire C18半制备柱(250 mm × 19 mm,5 μmol/L),在室温下,用含0.1%甲酸的水和乙腈两相洗液以9.0 mL/min流速梯度洗脱,流动相中乙腈线性梯度为50 min内,从15%增加到80%(体积比),在50~55 min维持100%乙腈,进样乙酸乙酯萃取部位溶液1.0 mL,紫外检测波长范围在200~400 nm之间,选择检测波长为254 nm,重复进样8次,所得的制备色谱图见图1B. 按照色谱峰洗脱顺序进行收集相应的峰,减压回收,采用葡聚糖LH-20柱层析和制备薄层层析方法继续纯化分离得到化合物1~化合物16.
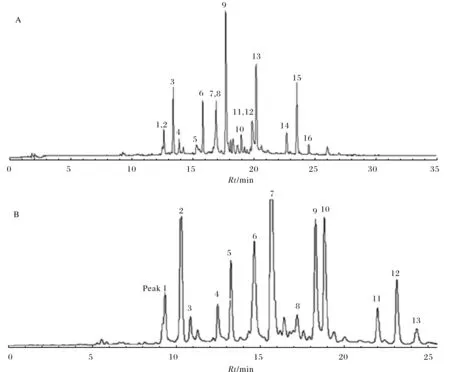
图1 (A) 苦参乙酸乙酯萃取部位在254 nm检测波长下的Prep-HPLC图谱(进样20 μL); (B) 苦参乙酸乙酯萃取部位在254 nm检测波长下的放大的Prep-HPLC图谱(进样1.0 mL)Fig.1 (A) The preparative HPLC chromatography detected at 254 nm with the injection of 20 μL of the active EtOAc fraction; (B) The preparative HPLC chromatography detected at 254 nm with the injection of 1.0 mL of the active EtOAc fraction
3.2化合物结构鉴定
通过将化合物1~化合物16的UV, LC-ESI-MS,1H 和13C NMR数据与相应的文献报道的进行对照,鉴定16个化合物分别为kushenol H(1)[8,12]、kushenol K(2)[9]、kurarinol(3)[9]、kushenol Y(4)[10]、kushenol P(5)[11]、norkurarinone(6)[8]、(2R,3R)-8-1avandulyl-2'-methoxy-5,7,4'-trihydroxyflavanonol(7)[12]、kushenol N(8)[8]、(-)-kurarinone(9)[13]、kushenol X(10)[11]、neokurarinol(11)[13]、kushenol C(12)[14]、sophoraflavanone G(13)[13]、leachianone A(14)[15]、kuraridine(15)[8-9]、kushenol A(16)[13],它们的化学结构见图2.
3.3SGLT2抑制活性
采用钠-糖转运筛选方法[6-7]来评价从苦参乙酸乙酯萃取部位分离到的16个单体化合物抑制SGLT2的活性,选择SGLT2抑制剂达格列静(Dapagliflozin)作为阳性对照.活性测试结果显示,16个lavandulyl黄酮化合物均对SGLT2显示一定的抑制活性(表1),它们的IC50值在1.45和37.6 μmol/L之间,而苦参乙酸乙酯萃取部位的两个主要成分(-)-kurarinone和sophoraflavanone G显示出最强的SGLT2抑制活性,它们的IC50值分别为2.24 μmol/L和1.45 μmol/L. Lavandulyl黄酮化合物对SGLT2的抑制活性数据与这些化合物结构之间显示出初步的构效关系,作为对照的两个黄酮醇骨架的化合物quercetin和kaempferol不显示任何活性,而所有具有lavandulyl侧链取代的黄酮1~16均显示一定的SGLT2抑制活性,初步显示8位上取代的lavandulyl侧链是这些黄酮类成分SGLT2抑制活性的重要药效团;另外,lavandulyl侧链上C-5"位有羟基取代的黄酮1~6对SGLT2抑制活性的IC50值范围在14.6和37.6 μmol/L之间,而lavandulyl侧链上C-5"位无羟基取代的黄酮7~16对SGLT2抑制活性的IC50值范围在1.45和14.9 μmol/L之间,且其中大部分lavandulyl侧链上C-5"位无羟基取代的黄酮对SGLT2抑制活性的IC50值都小于10 μmol/L,说明黄酮lavandulyl侧链上C-5"羟基的取代与其SGLT2抑制活性相关联,lavandulyl黄酮侧链上C-5"羟基的取代将减弱其SGLT2抑制活性.

图2 苦参乙酸乙酯萃取部位中分离的化合物结构Fig.2 The chemical structures of 16 compounds from the EtOAc fraction of S. flavescens表1 16个化合物对SGLT2的抑制活性 结果(IC50, μmol/L; mean ±SD, n=3)Tab.1 Inhibitory activity against SGLT2 of sixteen compounds from S. flavescens
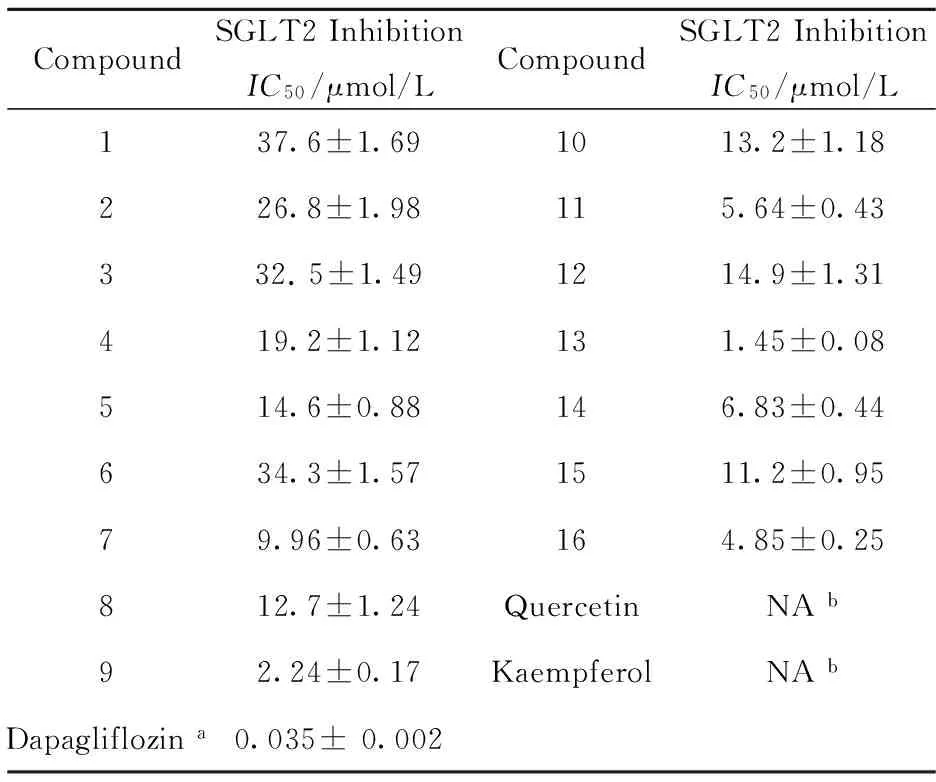
CompoundSGLT2InhibitionIC50/μmol/LCompoundSGLT2InhibitionIC50/μmol/L137.6±1.691013.2±1.18226.8±1.98115.64±0.43332.5±1.491214.9±1.31419.2±1.12131.45±0.08514.6±0.88146.83±0.44634.3±1.571511.2±0.9579.96±0.63164.85±0.25812.7±1.24QuercetinNAb92.24±0.17KaempferolNAbDapagliflozina0.035±0.002
a:Dapagliflozin作为阳性对照; b:NA表示“无活性”.
4结论
本文直接运用制备型高效液相色谱法对苦参的活性乙酸乙酯萃取部位的化学成分进行了分离和纯化,结合其他分离技术,快速得到16个lavandulyl黄酮类化合物,表明制备型高效液相技术对于包括苦参在内的中草药成分的分离和纯化是一个非常强有力的工具.采用钠-糖转运筛选方法测试了苦参乙酸乙酯萃取部位中分离的16个单体化合物的SGLT2抑制活性,这些lavandulyl黄酮化合物均显示良好的SGLT2抑制活性,它们的IC50值范围在1.45 μmol/L和37.6 μmol/L之间.对这些化合物的SGLT2抑制活性和化学结构之间的初步构效关系进行了探讨,建议lavandulyl侧链也许是这些黄酮类成分的SGLT2抑制活性的重要药效团,lavandulyl侧链上羟基的取代将减弱其SGLT2抑制活性.进一步的体内抗糖尿病活性研究正在进行中.
[1] Zimmet P, Alberti K G, Shaw J. Global and societal implications of the diabetes epidemic [J]. Nature, 2001, 414: 782-787.
[2] Wild S, Roglic G, Green A, et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030 [J]. Diabetes Care, 2004, 27: 1047-1053.
[3] Yang W Y, Lu J M, Weng J P, et al. Prevalence of diabetes among men and women in China [J]. New Engl J Med, 2010, 362: 1090-1101.
[4] 张鸣杰, 黄 建. 苦参碱类抗肿瘤作用机制研究的新进展[J].中国中药杂志, 2004, 29: 115-118.
[5] 赵 平, 张颖君, 山本浩文, 等. 苦参异戊烯基黄酮类化合物的化学活性及其生物合成研究进展[J].天然产物研究与开发, 2004, 16: 172-178.
[6] Kim M J, Lee S H, Park S O, et al. Novel macrocyclic C-aryl glucoside SGLT2 inhibitors as potential antidiabetic agents [J]. Bioorg & Med Chem, 2011, 19: 5468-5479.
[7] Katsuno K, Fujimori Y, Takemura Y, et al. Sergliflozin, a novel selective inhibitor of low-affinity sodium glucose cotransporter (SGLT2), validates the critical role of SGLT2 in renal glucose reabsorption and modulates plasma glucose level[J]. J Pharmacol Exp Ther, 2007, 320: 323-330.
[8] Son J K, Park J S, Kim J A, et al. Prenylated flavonoids from the roots ofSophoraflavescenswith tyrosinase inhibitory activity[J]. Planta Med, 2003, 69 (6): 559-561.
[9] Shin H J, Kim H J, Kwak J H, et al. A prenylated flavonol, sophoflavescenol: a potent and selective inhibitor of cGMP phosphodiesterase 5[J]. Bioorg Med Chem Lett, 2003, 12 (17): 2313-2316.
[10] Yang X Z, Baburin I, Plitzko I, et al. HPLC-based activity profiling for GABAA receptor modulators from the traditional Chinese herbal drug Kushen (Sophoraflavescensroot)[J]. Mol Divers, 2011, 15: 361-372.
[11] Kuroyanagi M, Arakawa T, Hirayama Y, et al. Antibacterial and antiandrogen flavonoids fromSophoraflavescens[J]. J Nat Prod, 1999, 62: 1595-1599.
[12] Cao M I, Sun X B, Zhao P H, et al. Two new antibacterial flavanones fromSophoraflavescens[J]. Chin Chem Lett, 2006, 17: 1048-1050.
[13] Kim J H, Ryu Y B, Kang N S, et al. Glycosidase inhibitory flavonoids fromSophoraflavescens[J]. Biol Pharm Bull, 2006, 29(2): 302-305.
[14] Hillerns P I, Wink M. Binding of flavonoids fromSophoraflavescensto the rat uterine estrogen receptor[J]. Planta Med, 2005, 71(11): 1065-1068.
[15] Kyogoku K, Hatayama K, Komatsu M. Constituents of Chinese crude drug “Kushen” (the root ofSophoraflavescensAit.). Isolation of five new flavonoids and formononetin[J]. Chem Pharm Bull, 1973, 21(12): 2733-2738.
Lavandulyl flavonoids with sodium-dependent glucose cotransporter 2 inhibitory activity fromSophoraflavescens
YANG Jing, WANG Chao, LIN Qinxiong, MEI Zhinan, YANG Guangzhong, YANG Xinzhou
(College of Pharmacy, South-Central University for Nationalities, Wuhan 430074)
To discover new bioactive Sodium-dependent glucose cotransporter 2 (SGLT2) inhibitors from the traditional Chinese medicine “Ku Shen” (roots ofSophoraflavescens), the bioassay-guided purification of an active ethyl acetate fraction was performed. Sixteen lavandulyl flavonoids were isolated and their structures were elucidated as kushenol H (1), kushenol K (2), kurarinol (3), kushenol Y (4), kushenol P (5), norkurarinone (6), kushenol I (7), kushenol N (8), (-)-kurarinone (9), kushenol X (10), neokurarinol (11), kushenol C (12), sophoraflavanone G (13), leachianone A (14), kuraridine (15) and kushenol A (16). All isolated compounds exhibited inhibitory activity against SGLT2. Among them, the two main constituents of the active EtOAc fraction,(-)-kurarinone (9) and sophoraflavanone G (13) showed the most potential inhibitory activity against SGLT2 with theIC50values of 2.24 μmol/L and 1.45 μmol/L, respectively.
Sophoraflavescens; chemical constituents; lavandulyl flavonoids; SGLT2 inhibitors
2014-01-22.
武汉市青年科技晨光计划(2013070104010028); 国家自然科学基金项目(81102798); 人事部留学人员科技活动项目择优资助项目(BZY12006).
1000-1190(2014)04-0520-05
R284.1
A
*通讯联系人. E-mail: yxzyxz01@163.com.
