microRNAs在脂多糖诱导的结肠癌细胞炎性反应模型中的表达
2014-09-07吴海波才志刚张绍明张珩汪雷徐小平
吴海波 才志刚 张绍明 张珩 汪雷 徐小平
(中国人民解放军第四五五医院心胸外科,上海 200052)
结肠癌的发生、发展与结肠细胞的炎性反应密切相关。长期慢性炎性反应能够促使结肠细胞过度增殖,引起DNA的不可逆损伤,进而启动并促进细胞的恶性转化,最终导致肿瘤的发生、发展及免疫抑制[1]。结肠癌细胞炎性反应的发生与Toll样受体、C反应蛋白(CRP)、白介素-6 (IL-6)等多种分子的表达异常密切相关[2-3]。最近有研究[4]表明,肿瘤局部炎性反应的发生与微小核糖核酸microRNAs(miRNAs)的异常表达有关。miRNAs是一类具有转录后调节活性的单链小分子RNA,能够与其他分子组装成沉默复合体 (RISC)。RISC通过作用于mRNA的3′端非编码区,可抑制翻译或直接促使mRNA降解,从而在转录或转录后水平负性调节蛋白的表达,调控细胞活动,进而参与机体的生理病理过程[5-7]。本研究探讨了miRNAs在脂多糖(LPS)诱导的结肠癌细胞HT-29细胞炎性反应模型中的表达。
1 资料与方法
1.1 试剂 实时荧光定量PCR反应混合液购自日本TOYOBO 公司,Trizol购自美国Invitrogen公司,三氯甲烷、异丙醇、乙醇购自中国国药集团化学试剂有限公司,高糖型DMEM购自美国Gibco公司,LPS购自美国Sigma公司。
1.2 实验方法
1.2.1 细胞培养及炎性反应诱导 HT-29细胞培养于含10%胎牛血清和100 U/mL青链霉素混合液的DMEM培养基中,待细胞增殖达培养皿底的80%时,弃培养液,用磷酸盐缓冲液(PBS)清洗,0.25% EDTA-胰酶消化细胞;加入培养基,调整细胞密度至1×105个/mL,按每孔2 mL接种于6孔细胞培养板中继续培养,12 h后,加入终浓度为400 ng/mL的LPS,孵育48 h后收获细胞(LPS组)。将未经LPS处理的细胞作为对照组。
1.2.2 细胞总RNA抽提 将6孔细胞培养板中的HT-29细胞用预冷的PBS漂洗后,加入1 mL Trizol室温裂解5 min;将裂解后的细胞移至离心管中,加入200 μL氯仿,剧烈混匀,室温放置2 min;12 000 r/min 4 ℃离心15 min,上层水相转移至新的无RNA酶的1.5 mL离心管中;向离心管中加入1 mL的异丙醇,-20 ℃沉淀过夜;12 000 r/min 4 ℃离心15 min,可见白色的沉淀,弃上清液,以75%乙醇清洗RNA斑块,7500 r/min于4 ℃离心5 min,弃上清,自然晾干,以无RNA酶的水溶解。
1.2.3 实时荧光定量PCR检测miRNA的表达 先应用反转录引物(颈环结构)将miRNAs反转录成cDNA,然后采用实时荧光(SYBR染料)定量PCR检测miRNAs的表达量。PCR结束后,以GAPDH作为内参,采用2-△△Ct方法,计算各样本的miRNAs的相对浓度。miRNAs反转录及定量PCR引物序列见表1~2。

表1 miRNAs反转录引物序列

表2 miRNAs定量PCR引物序列
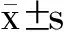
2 结 果
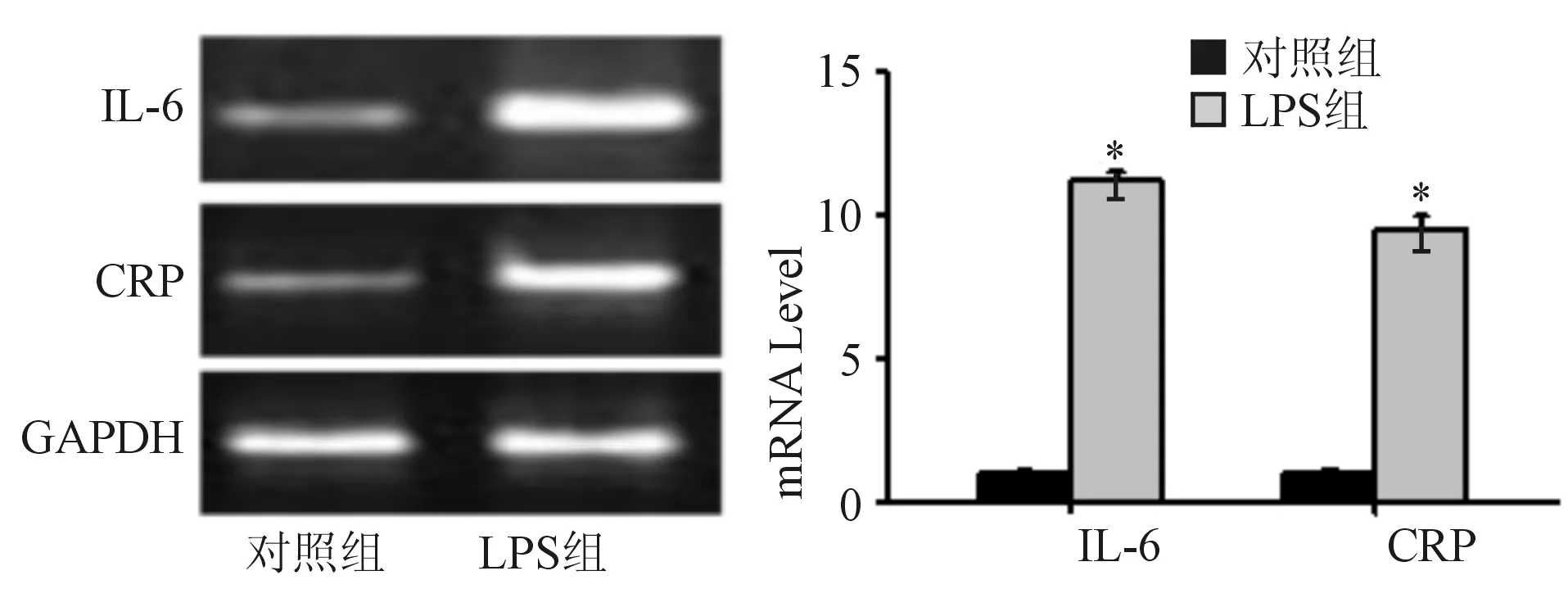
图1 LPS组与对照组IL-6和CRP的表达水平比较
与对照组比较,*P<0.01
2.1 HT-29细胞炎性反应模型的建立 实时荧光定量PCR结果表明,LPS组细胞中IL-6和CRP的表达水平较对照组高,差异有显著统计学意义(P<0.01),表明LPS诱导的HT-29细胞炎性反应模型建立成功。见图1。
2.2 miRNAs在两组细胞中的表达水平 通过文献[8-10]分析,我们初步筛选了在肿瘤发生中发挥重要作用的miRNAs,在本实验中,我们将miR-22、miR-23、miR-24、miR-26、miR-30、miR-181和miR-214作为检测对象。实时荧光定量PCR检测发现,LPS组细胞中miR-22、miR-26、miR-214的表达水平较对照组低,而miR-23的表达较对照组高(P<0.05);两组miR-24、miR-30、miR-181的表达水平差异无统计学意义,见图2。
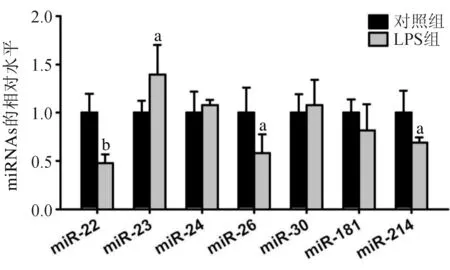
与对照组比较,aP<0.05, bP<0.01
3 讨 论
miRNAs参与结肠癌发生的各个环节,miR-21的表达从癌前病变到晚期癌组织逐渐增加[11];miR-135a和miR-135b通过调控Wnt信号通路在结直肠癌发病机制中发挥重要作用[12];miR-21和miR-196a参与结直肠癌的转移调控[13-14]。
由于结肠癌是一种炎性反应相关性肿瘤,本实验研究了结肠癌细胞受到LPS诱导的炎性反应刺激后,miRNA表达的改变,结果发现,LPS组细胞中miR-22、miR-26、miR-214的表达较对照组下降(P<0.05),miR-23的表达则升高,提示miRNAs参与结肠癌的局部炎性反应。虽然本研究中miR-24、miR-30、miR-181在LPS诱导的HT-29细胞炎性反应模型中表达未发生改变,但这并不代表这些miRNAs在结肠癌细胞炎性反应中不发挥作用。因此,miRNAs在不同类型的结肠癌细胞炎性反应模型中的表达和功能仍有待于进一步探讨。
目前,临床上已经开始将多种抗炎药物,如糖皮质激素、维生素D3受体激动剂、趋化因子拮抗剂、非类固醇类抗炎药等试验性应用于肿瘤的预防和癌症的辅助治疗[9-10],而在肿瘤炎性反应起到关键作用的细胞、细胞因子和酶等都有潜力作为肿瘤治疗的靶点。随着在肿瘤炎性反应中miRNA研究的深入,其有望成为控制结肠癌炎性反应的新靶点,以miRNA为靶点的新型抗癌药也将在抑制肿瘤的炎性反应中发挥重要作用。
[1]Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature,2008,454(7203): 436-444.
[2]Machida K, Tsukamoto H, Mkrtchyan H, et al. Toll-like receptor 4 mediates synergism between alcohol and HCV in hepatic oncogenesis involving stem cell marker Nanog [J]. Proc Nat l Acad Sci USA,2009,106(5):1548-1553.
[3]Sun Q, Liu Q, Zheng Y, et al. Rapamycin suppresses TLR4-triggered IL-6 and PGE(2) production of colon cancer cells by inhibiting TLR4 expression and NF-kappaB activation [J]. Mol Immunol,2008, 45(10):2929-2936.
[4]马一杰,陈贝贝,尚艺曼,等. microRNA在大肠癌诊治中的研究进展[J].中国医药导报,2012,9(15):8-23.
[5]Nie J, Liu L,Zheng W, et al. microRNA-365, down-regulated in colon cancer, inhibits cell cycle progression and promotes apoptosis of colon cancer cells by probably targeting Cyclin D1 and Bcl-2 [J]. Carcinogenesis,2012, 33(1): 220-225.
[6]Zhang L, Volinia S, Bonome T,et al. Genomic and epigenetic alterations deregulate microRNA expression in human epithelial ovarian cancer [J]. Proc Natl Acad Sci USA,2008, 105(19): 7004-7009.
[7]Frankel LB, Christoffersen NR,Jacobsen A, et al.Programmed cell death 4 (PDCD4) is an important functional target of the microRNA miR-21 in breast cancer cells [J]. J Biol Chem,2008, 283(2): 1026-1033.
[8]Nesaretnam K, Meganathan P. Tocotrienols: inflammation and cancer [J]. Ann N Y Acad Sci,2011, 1229(1):18-22.
[9]Mbeunkui F, Johannn DJ Jr. Cancer and the tumor microenvironment: a review Of an essential relationship [J]. Cancer Chemother pharmacol, 2009, 63(4):571-582.
[10]Umezawa K. Possible role of peritoneal NF-K B in peripheral inflammation and cancer: Lessons from the inhibitor DHMEQ [J]. Biomed Pharmacother, 2011, 65(4):252-259.
[11]Yamamichi N, Shimomura R, Inada K, et al. Locked nucleic acid in situ hybridization analysis of miR-21 expression during colorectal cancer development [J]. Clin Cancer Res, 2009, 15(12):4009-4016.
[12]Nagel R, le Sage C, Diosdado B, et al. Regulation of the adenomatous polyposis coli gene by the miR-135 family in colorectal cancer [J]. Cancer Res, 2008, 68(14):5795-5802.
[13]Schimanski CC, Frerichs K, Rahman F, et al. High miR-196a levels promote the oncogenic phenotype of colorectal cancer cells[J].World J Gastroenterol, 2009,15(17):2089-2096.
[14]Asangani IA, Rasheed SA, Nikolova DA, et al. MicroRNA-21 (miR-21) post transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion, intravasation and metastasis in colorectal cancer[J].Oncogene, 2008, 27(15):2128-2136.
