氧化锆(ZrO2)的电、光性质与应用
2014-09-01欧阳静李晓玉杨华明
欧阳静,金 娇,李晓玉,周 正,杨华明
(中南大学资源加工与生物工程学院 无机材料系,湖南 长沙 410083)
1 前 言
二氧化锆(ZrO2)作为典型的结构材料和功能材料,在国民经济各行业中都有关键的应用。有关ZrO2光学性质和应用是最近20年内兴起的研究领域,以前对于ZrO2的光学性质的研究都局限于其大块单晶的光学吸收和透射谱等。随着纳米材料、薄膜等研究的兴起,以及第一原理计算,吸收、荧光发射光谱仪等的大规模应用,有关ZrO2纳米粉体、纤维、薄膜、多晶体以及(稀土)离子掺杂ZrO2的光学性质越来越受重视,这与ZrO2在光学领域的特点有关,而最近几年来很少有关于ZrO2的电学、光学性质的综述性论文发表。
2 ZrO2电学性质与应用
理解ZrO2的电学性能首先要了解它的电子结构与能级结构,Dash L K等[1]以第一原理法详细计算了立方(Cubic)、四方(Tetragonal)、单斜(Monoclinic)、金红石型(Rutile)4种晶系的ZrO2能带结构和电子能量状态密度图(DOS),其中四方系ZrO2的价带和导带能级结构图如图1和图2所示,其它3种晶系的能级结构图与之类似,只是立方系的电子状态更少一些,而立方和金红石系的状态更密集,图1中还示出了4种晶系在价带和导带附近的电子DOS图。从图1b中可看出,所有结构的ZrO2在费米能级附近均出现很宽的禁带,且价带(VB)和导带(CB)间的禁带宽度很大,均大于4 eV,故ZrO2一般属于绝缘体的范畴。导带中,由于配位场的空间对称作用,产生了电子能级的劈裂,出现了Eg和T2g的新能级。由于ZrO2的禁带宽度很大,在光吸收谱上吸收峰将主要出现在高能量区域,这一区域的带间跃迁区别不太明显,Dash L K等[1]在计算能级结构的基础上,还计算了不同晶系的ZrO2在禁带附近可能的电子跃迁机理及其相应的能量,并与前人的结果进行了对比,其结果见表1。French R H等[2]则以OLCAO方法计算了Y2O3掺杂ZrO2晶体的能带结构和光学性质,并且其结果与X射线光电子能谱(XPS)相结合,从原子轨道理论出发,列出了YSZ晶体中可能的能级跃迁方式,其结果见表2。
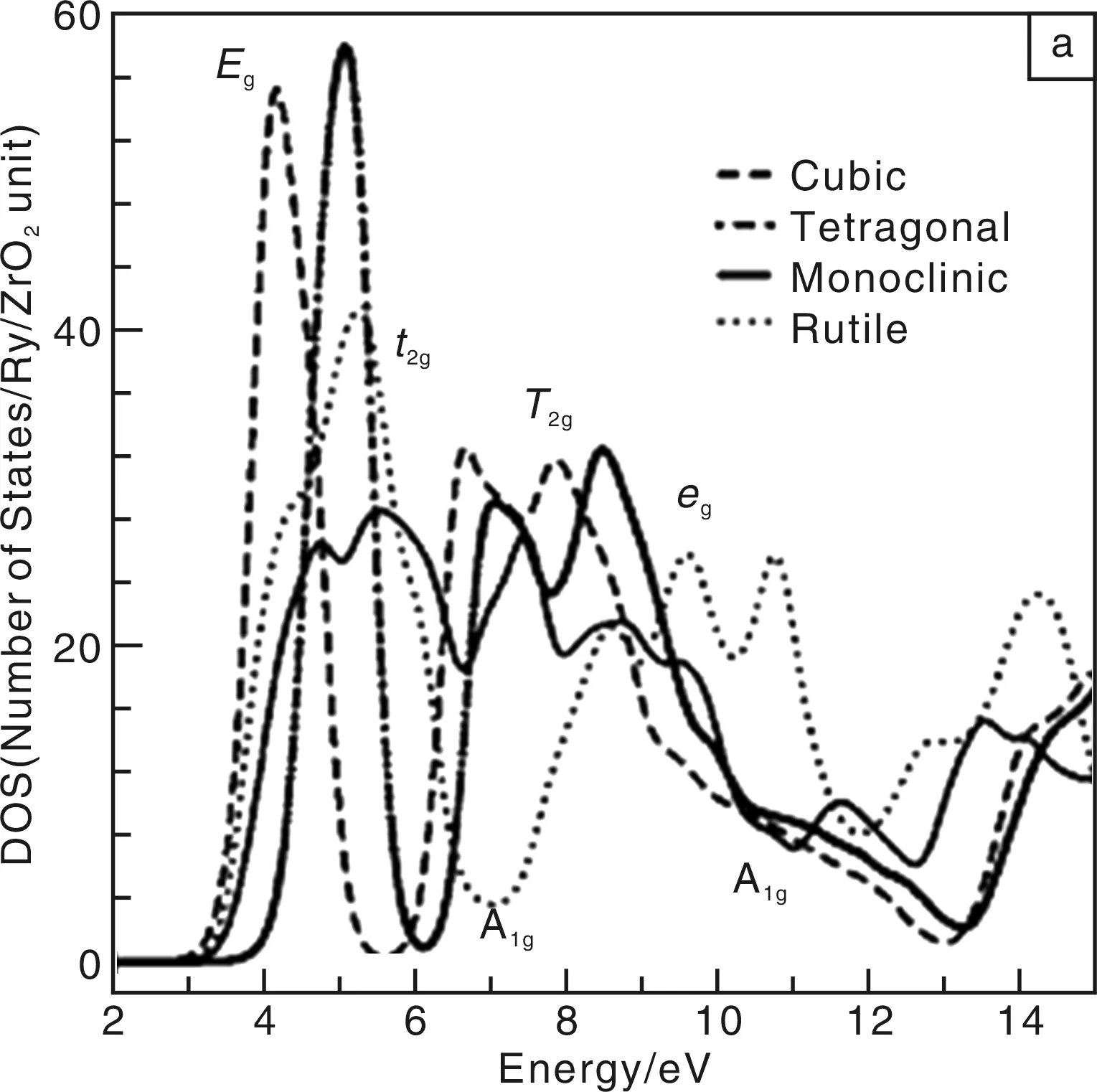

图1 4种晶系的导带的状态密度(DOS)图(a)和理论计算的四方相ZrO2的导带能级图(b)Fig.1 Density of states (DOS) curves in conduction band (CB) of four crystal system(a) and the theoretically calculated band structure of CB in tetragonal ZrO2(b)


图2 理论计算的四方相ZrO2的价带能级图(a)和4种晶系的价带的状态密度(DOS)图(b)Fig.2 The theoretically calculated band structure of valence band(VB) in tetragonal ZrO2(a) and the density of states (DOS) curves in VB of four crystal system(b)

表1 不同方法计算的立方、单斜、六方晶系、四方系ZrO2的最小禁带宽度和直接跃迁禁带宽度及其跃迁位置在布里渊区的分布
无论是纯ZrO2还是掺杂ZrO2,它们在室温下均是绝缘体,电阻率大于1 010 Ω·cm,但高温导电性良好,具有负的电阻温度系数[3],1 000 ℃时电阻率为104 Ω·cm,1 700 ℃时只有6~7 Ω·cm。根据第一原理的计算,在ZrO2的电子结构中,价带与导带的电子
轨道能级状态是随晶体结构不同而有电子轨道数的不同。由图1,2可知:ZrO2的价带为满带,而导带也填充有一定的电子,而造成ZrO2的室温绝缘性能主要是由于价带与导带之间的带宽过大所致,在室温下不可能有导电性能。而在掺杂以后,可以在禁带中形成新的能级(施主能级或受主能级),使得禁带宽度减小,但在室温下仍然没有导电能力,主要是由于ZrO2在室温下的电子迁移率太低所致。因此,无论是高纯ZrO2还是掺杂ZrO2,在室温下均表现出高的绝缘性能。
最近有关ZrO2的电性质的研究主要集中在以第一原理计算模拟不同晶型ZrO2和掺杂对电子结构、能带的影响。如周春根课题组[4]计算了Y掺杂稳定ZrO2(YSZ)的能带结构和键性能,其结果认为14%的Y元素掺杂可得到完全稳定的立方ZrO2,掺杂后的晶体键性主要以共价键性质为主,含有少量离子键的性质,计算所得YSZ的禁带宽度高达4.0 eV。Liu等[5]则计算了单斜相ZrO2的能带结构和光、键性质等信息,他们计算的单斜ZrO2的直接带隙为4.05 eV,而其间接带隙为3.65 eV,内部的键性主要为共价键,计算结果表明单斜ZrO2的延展性或晶格变形能力较强,且晶体在{100}晶面族的3个方向上有明显不同的光学常数,表现出光学各向异性。
而在温度高于约800 ℃的环境中,ZrO2的导电能力大大提高,ZrO2的导电能力随温度变化的趋势如图3所示。由图3可知:ZrO2的电导率随温度变化呈直线关系,即温度越高,ZrO2的导电能力越强。在高温下,ZrO2的导电能力来源于掺杂离子引入后,由于电荷补偿的需要和空间构架效应而形成的大量带两个正电荷的氧空位。在室温下,由于基质(ZrO2)晶格的键能很高(Zr-O键键能高达760.8 kJ·mol-1),造成对氧空位的束缚很强,且氧空位的迁移活化能高。故在低温下由于氧空位引起的电荷迁移率非常低。综合前述的ZrO2中的电子能级结构特点,ZrO2的禁带宽度很大,且电子从价带跃迁至导带的几率很低,即使掺杂形成了多余的能级,也不足以使电子的迁移率发生质的变化,故在低温下由于氧空位、掺杂离子以及导带电子的迁移产生的电荷迁移率都非常低。而在高温下,电子的跃迁几率升高,但同时回迁的几率也升高,高温并不能使得材料中的电子能级结构发生本质的差别。故由电子迁移而引起的导电性并不会增强。高温下,离子的迁移率将升高,离子的迁移将按易位扩散、空位扩散、环形扩散、间隙扩散、准间隙扩散以及空位扩散等方式进行[6]。这几种迁移机制中,除空位扩散外,其它方式的迁移由于没有电荷迁移本质变化,即使在电场中的扩散也是非定向的,且晶格的束缚能仍然很高,只有热运动涨落很明显的离子,能够克服晶格的束缚发生定向迁移,故而掺杂离子的迁移仍然不会产生很明显的电流变化。
表2理论计算和实验测量的Y2O3掺杂ZrO2中电子轨道跃迁类型和所需能量
Table2OtbitaltransitiontypesandenergiesinY2O3doppedZrO2determinedfromexperimentalmeasurementsandtheoreticalcalculations

Transition typeTransition sourceTransition energy/eVCubicTestTheorySquairTestTheoryMonoclinicTestTheoryE'1O 2p(VB) →Zr 4d(CB)6.55.26.05.26.55.1E1O 2p(VB) →Zr 4d(CB)7.97.38.07.88.28.3 E″1O 2p(VB) →Zr 4d(CB)――――9.89.7E2O 2p(VB) →Y(CB)16.7―16.8―――E3O 2p(VB) →Zr 5s(CB) orO 2s(VB)→Zr 4d(CB)21.122.521.7~2421.822 E″3O 2p(VB) →Zr 5s(CB) orO 2s(VB) →Zr 4d(CB)――――24.5―E4O 2s(VB) →Zr 4d(CB) orZr 4p(VB) →Zr 4d(CB)33―34―33.3―
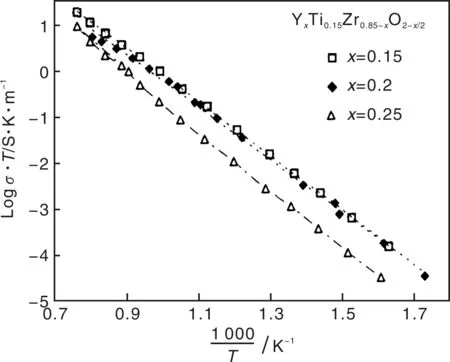
图3 不同成分掺杂ZrO2的电导率随温度变化的关系Fig.3 Conductivity vs temperature for different kinds of ZrO2
上述的扩散迁移机制中,间隙扩散所需的活化能最大,空位扩散所需的活化能最小,且空位与离子间的位置交换(特别是离子与空位带异号电荷时)将产生电荷的实质迁移,故ZrO2材料在电场中,高温下将发生氧空位的定向迁移,其迁移方式主要是带正电的氧空位与附近的氧离子发生易位,造成空位的定向迁移,而引起的是带负电荷的氧离子的反向迁移。这一迁移也可发生在材料两端有氧浓度差异的环境中,在这种情况下,发生的是高压氧一端产生氧的吸附,随后发生键合产生氧离子,由于氧浓度的差异,高氧浓度的一端发生氧离子向低氧浓度一端的移动,其移动本质就是氧空位与氧离子的易位扩散迁移。这一迁移在高温下随温度升高而增强,随两端氧分压的差值增大而增强,且变化特点很敏感,故而在高温下,ZrO2的主要导电机理来自于氧空位的定向迁移,且电导率随温度的升高和氧分压差值的增大而增大。Colomer等[7]对Ti掺杂8YSZ后形成的双成分固溶体的测试发现,这一材料的导电同样是来源于离子电导,且在氧分压(PO2)为10-2~2.1×104Pa的环境中的电导率基本平衡,为0.01 S/cm,而在1 000 ℃、10-7Pa的氧分压下,电导率增加一倍,达0.02 S/cm,同时在这种材料中,由于有Ti3+和Ti4+的变价状态,电导率机理分析还发现了两者间的电荷转移产生的电子电导。
德国学者Guo X在一篇综述中指出[8],ZrO2的导电性质与电子导电的性质不同,以离子导电的ZrO2材料在一个合适的空位浓度条件下,才能达到最大的离子电导率,而高于最佳空位浓度的基础上再增加空位就将导致离子电导率的降低。因此,ZrO2在高温下的电导率不可能无限制的提高。如纳米结构ZrO2的离子电导下降主要是因为内部界面的影响太大,导致离子迁移降低而引起。由于在稳定化的ZrO2中的空间电荷层为2.5 nm左右,则只有当纳米颗粒的尺寸小于5 nm时才会出现直接的量子尺寸效应引起的电子迁移,很显然这种情况很难大规模实现。而以取向生长为代表的ZrO2的电导率则出现了大幅的提升,如在MgO表面生长的ZrO2薄膜的电导率大幅升高,但其原因不明,且由于MgO与ZrO2的晶格失配率太大,其可行性尚有可疑之处。而在钛酸锶-YSZ-钛酸锶形成的异质结中的电导率提升则被认为是电子导电而形成。利用ZrO2的这一独特的氧离子迁移电导特点,可以将ZrO2应用于以下两个方面。
氧传感器主要应用于高温环境中(600~1 100 ℃)的氧气浓度的检测,其原理即利用了ZrO2在高温下的电导率随氧分压有非常敏感变化的特点,主要应用于钢水中氧含量的检测。氧传感器的一侧充有固定氧气浓度的气体,并涂有Pt电极,另一侧直接接触所需检测的环境,由于两侧有较大的氧分压差,高浓度侧(空气)的氧分子被吸附在Pt电极上与电子结合形成氧离子O2-,使该电极带正电,O2-离子通过陶瓷中的氧空位迁移到低氧浓度侧的Pt电极上放出电子,转化成氧分子,使该电极带负电。氧离子在高浓度端的吸附、电离、成键并发生易位迁移,从而产生固定的电势差,根据能斯特方程计算电势差的大小即可检测氧分压的大小。
燃料电池中的电极隔膜材料燃料电池是新兴的清洁能源和有可能替代石化能源的一种能量发生单元。其本质是利用氢离子与氧离子发生反应产生水的过程中发生的电荷转移而产生能量。在这一过程中,不能使氢气与氧气直接接触燃烧,而要将氢和氧先转变成离子,再发生离子间的化合。这其中两大关键的因素就是如何将作为氢源的氢气、甲烷等转化成氢离子,这需要一定的催化剂。另一个关键因素就是如何将产生的氢离子(H+,即质子)和氧离子充分利用起来而不使其在电离的同时发生重新化合,这就需要高效的离子导体和质子导体将产生的H+和O2-快速转移至相互的对侧进行化合,产生稳定的电流。这种高效的离子和质子导体即可利用掺杂ZrO2陶瓷薄片。这种ZrO2陶瓷薄片之所以能使质子和O2-转移,主要原因是:电离放出一个最外层电子的氢原子成为质子后,其半径很小(约0.01 pm),这样小的质子足以在ZrO2内部进行迁移,其迁移机理一般被认为是遵循“旋转-跳跃机理”,即吸收到陶瓷内部的质子与氧离子之间形成微弱的O-H键,在外加电场的作用下,O-H键断裂,质子旋转的同时顺电场方向前进,同时还将与邻近的氧离子形成新的微弱的O-H键,质子以这种方式不断的结合、跳跃,最终大量的质子迁移,在电场方向上形成电流。以上的质子导电过程需在高温的氢气气氛中形成。Anselmi-Tamburini U等[9]以交流阻抗谱法测量了以Y2O3掺杂完全稳定后的立方ZrO2陶瓷的质子电导率,发现陶瓷的块体电导率约为4.8×10-6S/m,而相同的陶瓷片在饱和水蒸汽环境中处理400 h后,其体积电导率为10-4S/m级,再在200 ℃烘干10 min后,其电导率下降到1.4×10-5S/m。
但是,需要指出的是,虽然ZrO2是具有质子导电特点的材料,但其高温下的质子迁移率远小于氧离子在其内部的迁移率。因此在SOFC中,使用ZrO2主要是利用其在高温下的氧离子迁移电导能力。ZrO2的氧离子电导来源于内部掺杂而形成的大量氧空位,这些氧空位将以上述空位扩散机制的方式不断与邻近的氧离子进行换位迁移,使得在表面电离后形成的带负电氧离子沿电场反方向定向迁移,而氧空位则顺电场方向不断迁移,在高温下,这种迁移的速度较快,从而可形成较强的氧离子迁移能力,达到10-1S/m数量级。Ramamoorthy R等[10]应用交流阻抗谱方法测量的掺杂3.5%Y2O3后的ZrO2晶界电导率在500 ℃时可达8×10-3S/m,而相应的晶粒内部电导率可达4×10-1S/m。
3 ZrO2的光学性质与应用
3.1 ZrO2的吸收光谱
早在1982年,Wood D L等人[11]就详细测试了Y2O3掺杂ZrO2晶体的光学性能,如图4所示,从图4来看,400 nm~5μm的波长范围内,ZrO2的吸收光谱上基本没有任何吸收,说明掺杂后的ZrO2晶体的透光性能非常好;在紫外光区有强烈的吸收,说明ZrO2的紫外线吸收能力同样出色。而在200 nm~5 μm的波长范围内,晶体的折射率基本是随波长增大而减小的,但在200 nm~1 μm范围内下降非常明显,波长更大的范围下降较慢。在501 nm处的折射率为2.178 35,而在1 002 nm处其折射率下降到2.124 76。这与Savoini B等人[12]在1997年测量的Pr3+离子掺杂的ZrO2单晶体在500 nm处的折射率为2.17基本相同。从图4c中可知,YSZ单晶体的折射率是随温度的升高而直线上升的,也就是说,在较高温度的环境中,如果不发生晶体结构转变或失透等,则温度对提高晶体的折射率具有积极作用。

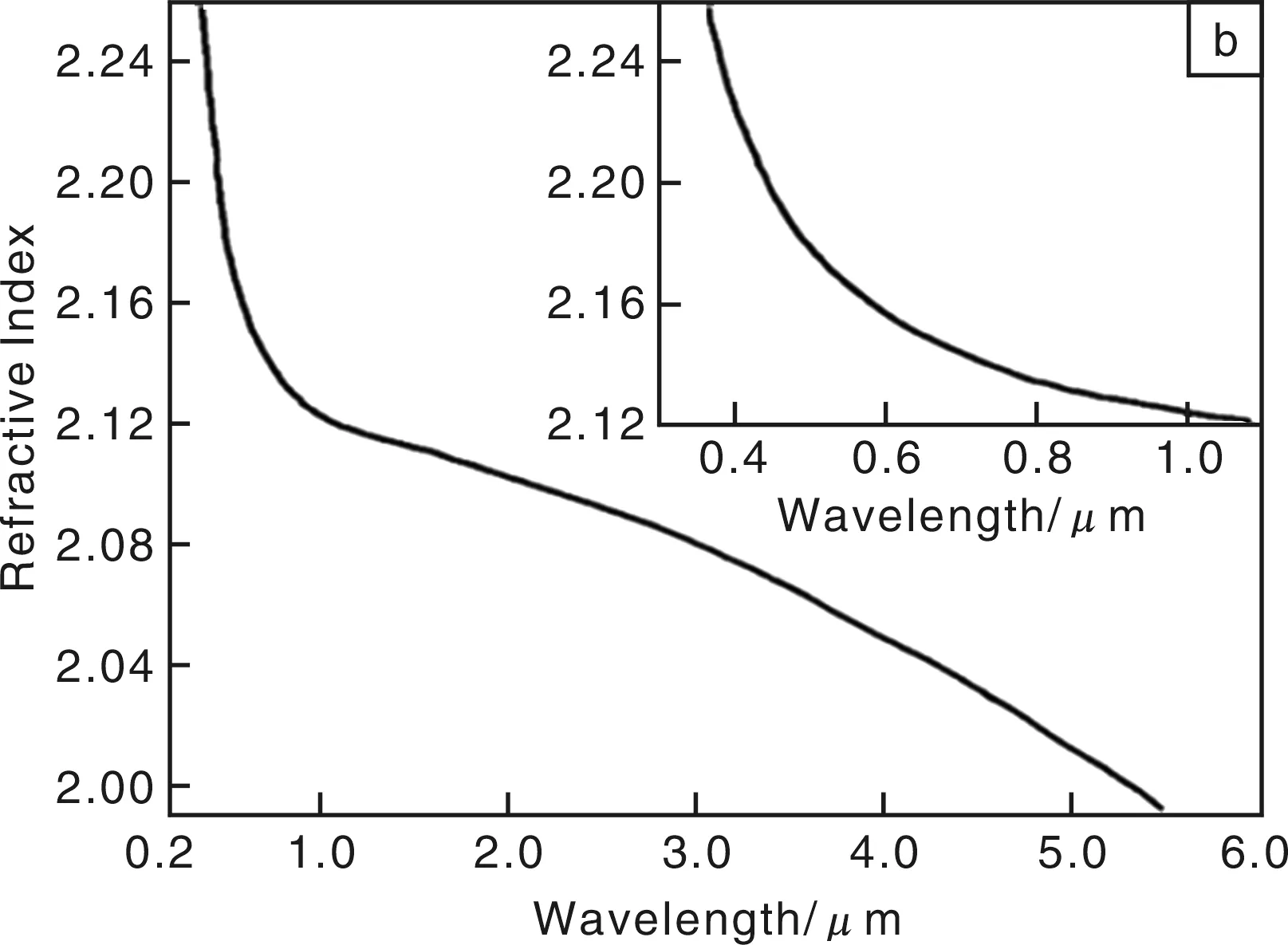

图4 ZrO2晶体的光吸收谱(a),折射率随波长的变化曲线(b),折射率随温度的变化趋势(c)Fig.4 Optical absorption spectrum of ZrO2 crystal (a), the refractive index vs wavelength (b), and the refractive index vs temperature (c)
ZrO2粉体的吸收光谱较相应晶体有所差别,表现在可见光区也存在一定的吸收,这主要来源于粉体的表面对可见光的散射以及晶体内部的大量缺陷(氧空位、晶界、晶格失配、畸变、电荷中心等)对光的散射作用,造成ZrO2粉体的白色而不是透明外观的现象。而且由于粉体与晶体的状态不同,大多数情况下,ZrO2的粉体在400~500 nm波长内还有另一个稍弱的吸收峰,主要来源于靠近Zr4+的氧离子空穴捕获的电子对光子的吸收[13]。
3.2 ZrO2的发光性能
ZrO2本身即具有发光的性能,近年已有大量文献报道了ZrO2粉体、薄膜、纳米晶、纳米线、介孔材料在紫外光照射下的发光性能[14-27]。所有的报道均显示了在240~330 nm的波长激发后,上述各种ZrO2材料在385 nm和445 nm位置有1个或2个甚至更多的呈蓝紫色的光致发光峰,各种材料的发光位置相似,只是随制备方法或掺杂杂质不同有少量的偏移。对于这2个发光峰的来源解释主要有以下两个方面:最初认为是由于ZrO2中存在少量的Ti4+,因为Ti,Zr,Hf同属于第IV副族元素,一般含Zr矿物中均含有一定的Ti,Hf元素,且分离提纯时可能并不完全,造成ZrO2中含少量的Ti4+,蓝绿色发光可能来源于Ti 3d→O 2p电子能级间的跃迁。随着现代分离技术的提高,发现上述解释并不成立。现在广为接受的一个解释是结构缺陷模型,即发光是来源于捕获了电子的氧空位形成的新能级与基态能级间的跃迁。前已述及,氧空位是由于在不等价掺杂形成固溶体时为保持电中性而形成的点缺陷。这种缺陷带2个正电荷,它可以吸引电子来平衡局部电荷,这种吸收了电子的负离子空位即是F-色心,色心上被捕获的电子也具有分离的允许能级,这些允许能级也相当于在可见光谱区域的光子能级。当F-色心捕获的电子被紫外光激发后,处于激发态,这种激发态是不稳定的,需要回到原来的基态,即要发生从激发态回迁到基态的能级间跃迁,跃迁过程可能先经过一定的能量驰豫再回迁,并放出两个能级间的能量差的光子(有的时候并不放出光子而直接发热),这种放出的光子即为ZrO2的蓝紫色发光。由于氧空位带2个正电荷,F-色心上最多可以捕获两个负电子,而且两个相邻的F-色心还可以形成缔合中心(F-F),此时缔合中心将带4个正电荷,如果中心捕获3个负电子,则整个区域仍然只带1个正电荷。Wang Z等人[28]把纯ZrO2中的2个发光带归属于2个不同的发光中心中的电子跃迁:位于385 nm附近的紫外-紫色发光带归属于带单一正电荷的F-色心中的电子能级跃迁,而位于445 nm的发光带归属于两个F-色心的缔合中心捕获3个负电子后呈单一正电荷的中心的电子能级跃迁。
根据上述的归属,Cao H等[15]以多孔阳极氧化铝为模板制备的ZrO2纳米线的PL发光谱上只出现了在385 nm处的发光峰,即在这一材料中,单一的F-色心的发光基本不出现或被淬灭。日本的Ito T等[29]以分子束外延分别生长了ZrO1.77、ZrO2.13和Y0.2Zr0.8O1.68的薄膜,发现氧空位的多少对ZrO2基薄膜的发光性能有较大影响,不论氧空位的浓度有多少,在445 nm处的发光峰一直存在,且位置不变。而在氧空位很多的ZrO1.77中,在385 nm的发光峰较强;在氧过量的ZrO2.13中,紫外光发光峰非常小;而在Y0.2Zr0.8O1.68薄膜中,紫外光发光峰基本消失。经过热处理后,两种发光峰的位置基本没有变化,但是ZrO1.77中的蓝色发光峰基本消失,而ZrO2.13的紫外发光峰增强,甚至比蓝色发光峰强度更高,但Y0.2Zr0.8O1.68薄膜的紫外发光峰仍然不明显。说明385 nm处的发光与氧空位浓度直接相关,但Y的加入使得385 nm的发光峰被淬灭。385 nm的发光峰的激发谱图(PLE)说明其最佳激发波长为230 nm左右,而445 nm发光的最佳激发波长为243 nm左右。但是Lai L等[17]通过同步辐射方法测量的四方ZrO2薄膜的发光峰最大波长处于390 nm,而大约在420 nm处有一个小的肩峰。同时发现390 nm的激发谱上有2个主要的峰,分别位于164 nm和242 nm处。而单斜ZrO2薄膜的发光峰最大波长处于475 nm,其相应激发谱峰值位于235 nm。而四方+单斜相的ZrO2薄膜的发光性质与四方相相似,只是激发峰的相对强度有变化。Emeline A等[13]研究了ZrO2纳米粉体和ZrO2胶体浆的PL和PLE谱,发现两者之间相差并不大,但粒径对发光强度有一定影响。
对于多孔ZrO2的发光性质也有相关的报道,其中的发光中心归属也不外乎是F-色心以及由色心缔合中心产生的发光。有趣的是,Chen H等[30]将他们制备的介孔ZrO2位于367.3 nm附近的发光峰归属于样品中大量的表面Zr-O-P基团的光致发光,作者课题组由于实验结果的差异,对相关结果进行了仔细分析并充分认证,认为Chen的归属可能并不适合于所有情况,通过光谱对比和分峰拟合,并分析PL谱的归属,以位形坐标图解释了多孔ZrO2的发光性质机理,如图5所示[31]。在多孔ZrO2中有大量的氧空位,且这些氧空位处于各自分立的状态,只有少量的相互结合形成了缔合中心,这些F-色心捕获1个负电子,但仍带1个正电荷,这其中的电子处于图5中的氧空位能级中,且位于较高的分立能量位置,因此发生辐射弛豫时产生的荧光能量稍高,主要为蓝紫色光。在含P或其它杂质的多孔ZrO2中虽然仍有大量的氧空位,但其中的氧空位由于焙烧等处理导致的结构坍塌、颗粒粘结以及界面移动等原因相互聚合形成了缔合中心,且再捕获1个电子形成了(F-F)+发光峰,由于缔合中心的正电荷较多,对电子的束缚能较单一氧空位中心的高,导致这一类电子的能量位置位于图5中的氧空位能级中较低的位置,发生辐射弛豫时产生能量稍低的绿色主发光峰。

图5 ZrO2及掺杂ZrO2中的发光主要来源于氧空位形成的宽能级对电子的简并作用[31]Fig.5 Photoluminescence from (dopped) ZrO2 should be originated from the electron merging of energy band constructed by oxygen vacancies
3.3 ZrO2作为发光离子基质
ZrO2的晶格振动的声子能量较低,刘晃清等[32]测得的声子能量小于640 cm-1,而Zhao X等[33]以从头计算的方法详细分析了不同晶型的声子能量数据,立方结构的声子能量为258 cm-1,四方晶相的声子能量不高于437 cm-1,而单斜晶型的声子能量更高。与一般的氧化物相比,ZrO2声子能量更高,说明其有作为发光基质的潜力。有人已利用ZrO2的高折射率和可见光区的高透光性制备以ZrO2为基质的发光材料,其中最主要的是以Eu3+,Tb3+,Sm3+,Yb3+等稀土离子作为发光中心,将其掺入到ZrO2晶格中或晶格的间隙位置中[34-37]。利用稀土离子的本征电子跃迁,在一定的激发光源(一般是汞蒸气在电场下发出的紫外光,其99%以上的能量集中在λ=254 nm处紫外光)的照射下,稀土离子发生本征电子跃迁至激发态,这一激发态在回到基态的过程中需要放出能量相应于激发态至基态的能量差的光子,从而获得稳定波长的发光。在这一过程中,发光中心的作用是作为光源的来源,是关键因素之一,而作为容纳发光中心的基质的性质也非常重要。
作为发光材料的基质,一般要求是宽禁带的半导体或绝缘体;不能与发光中心竞争吸收激发光子;对发光中心有较强的分立作用,即不能让发光中心有偏析、缔合等现象出现;内部不能有很多缺陷,否则会对发光有淬灭作用;基质的电子能级结构尽量不与发光中心的能级发生交叉,这样就不会出现发光颜色的转变和不稳定。作为宽禁带的ZrO2的声子能量较低,可为发光中心的稳定发光提供较好的场所[34, 38]。除内部缺陷随制备方法有较大变化、在紫外光区有较强吸收外,其它条件是基本符合以上要求的,其中缺陷可采用制备成薄膜、热处理等方法消除影响,故有人也以ZrO2为基质制备了多种发光材料,主要是光致发光材料[39-42]。如Hipolito M G等[43]制备了以Tb3+为发光中心的ZrO2基发光材料薄膜,检测了产物的PL和阴极发光(Cathodoluminescence, CL)性质,发现在250 nm的激发光源下可获得强烈的绿色PL荧光,而在4~12 kV的加速电压下,发射出的电子轰击所制备的薄膜也有明显的绿色CL荧光出现。Nakajima H等[35]制备的Tb3+掺杂YSZ基粉体材料中,在376 nm和381 nm光源的激发下却只有ZrO2的本征发射峰,即并没有属于Tb3+的绿光出现,说明在这一条件下获得的材料的发光中心的荧光被淬灭,但文中并没有分析出现这一现象的原因。Assefa Z等[34]制备了以Sm3+为发光中心的ZrO2薄膜,发现在330 nm的光源激发下,薄膜样品在77 K和室温下均出现了Sm3+离子的特征发光峰,但是还在505 nm处有一半峰宽达60 nm的发光峰,这一峰主要是来源于ZrO2中的氧空位捕获的电子的跃迁产生的荧光。Bucella S等人[44]以ZrO2为基质组装了Eu3+-邻二氮杂菲配合物,检测产物在488 nm的激发光源下可获得强烈的红光发光。Er3+和Dy3+离子是常见的上转换发光材料的中心离子。其他文献也报道了Eu3+离子掺杂ZrO2晶体、粉体、纳米晶中的红色荧光发光性质[36-37]。Savoini B等[45]报道了Er3+离子掺杂的YSZ单晶,如果在近红外的780 nm和801 nm(相应于Er3+的4I9/2能级与基态间的能量差)的激发下,可出现明显的绿色和红色上转换荧光发射,究其来源是由于Er3+离子的上转换效应促成了其4S3/2→4I15/2跃迁的绿光发射和4F9/2→4I15/2跃迁的红光发射。Hsieh W C等[46]还观察到了Er3+离子掺杂的ZrO2在90 ℃和210 ℃下的热发光,并认为这与所获材料中的氧空位和杂质Ti4+离子有关。特别是Gao等在使用ZrS3为原料焙烧后获得的含有痕量Sm3+的单斜和四方ZrO2纳米带中,发现了位于785 nm的属于Sm3+离子的发光峰,他们认为如此少量的稀土离子仍能出现发光峰与ZrO2基质的本征特性有关。
4 结 语
在电学性能方面,ZrO2的本征性质决定了其不可能在低于500 ℃的温度下提供导电能力。因此在提高其导流浓度、超薄化与提高抗浸透能力等方向,这一方面的技术研究和开发还有较大的空间。ZrO2为基材料的电导率提升还可以通过材料结构的设计(薄膜、异质结)和尺寸的减小来实现,而前者可能是较有实用价值的技术。
ZrO2的光学性质、结构与制备工艺有必然的联系,对其光学性质的研究仍是一个具有挑战的课题,在以下方面有较大研究空间:①新型ZrO2基发光材料的研制与发光机理分析;②以ZrO2基质进行敏化有关稀土离子,并提供刚性的ZrO2晶格还有待研究;③如何减少以氧空位为代表的缺陷对ZrO2基发光材料的光淬灭、消除晶格在形态转变过程中产生的体积松散和晶格失配对发光性能的影响是另一个重大的课题。
参考文献 References
[1] Dash L K, Vast N, Baranek P,etal. Electronic Structure and Electron Energy-Loss Spectroscopy of ZrO2Zirconia[J].PhysRevB, 2004, 70: 245 116.
[2] French R H, Glass S J, Ohuchi F S,etal. Experimental and Theoretical Determination of the Electronic Structure and Optical Properties of Three Phases of ZrO2[J].PhysRevB, 1994, 49(8): 5 133-5 142.
[3] Baidu Encyclopedia, Zirconia. [EB/OL].(2013-08-29)[2013-09-26]. http://baike.baidu.com/view/595299.htm.
[4] Jin L, Yu Q H, Rauf A,etal. Elastic, Electronic and Thermal Properties of YSZ from First Principles[J].SolidStateSci, 2012, 14(1): 106-110.
[5] Liu Q J, Liu Z T, Feng L P. Elasticity, Electronic Structure, Chemical Bonding and Optical Properties of Monoclinic ZrO2from First-Principles[J].PhysicaB-CondensedMatter, 2011, 406(3): 345-350.
[6] Song Xiaolan(宋晓岚), Huang Xuehui(黄学辉).InorganicMaterialsScienceBase(无机材料科学基础)[M]. Beijing: Chemical Industry Press, 2005.
[7] Colomer M T, Maczka M. Mixed Conductivity, Structural and Microstructural Characterization of Titania-Doped Yttria Tetragonal Zirconia Polycrystalline/Titania-Doped Yttria Stabilized Zirconia Composite Anode Matrices[J].JSolidStateChem, 2011, 184(2): 365-372.
[8] Guo X. Can We Achieve Significantly Higher Ionic Conductivity in Nanostructured Zirconia?[J].ScriptaMater, 2011, 65(2): 96-101.
[9] Anselmi-Tamburini U, Maglia F, Chiodelli G,etal. Enhanced Low-Temperature Protonic Conductivity in Fully Dense Nanometric Cubic Zirconia[J].ApplPhysLett, 2006, 89(16): 163 116-163 116-3.
[10] Ramamoorthy R, Sundararaman D, Ramasamy S. Ionic Conductivity Studies of Ultrafine-Grained Yttria Stabilized Zirconia Polymorphs[J].SolidStateIonics, 1999, 123(1-4): 271-278.
[11] Wood D L, Nassau K. Refractive Index of Cubic Zirconia Stabilized with Yttria[J].ApplOpt, 1982, 21(16): 2 978-2 981.
[12] Savoini B, Santiuste J E M, Gonzalez R. Optical Characterization of Pr3+-Doped Yttria-Stabilized Zirconia Single Crystals[J].PhysRevB, 1997, 56(10): 5 856-5 865.
[13] Emeline A, Kataeva G V, Litke A S,etal. Spectroscopic and Photoluminescence Studies of a Wide Band Gap Insulating Material: Powdered and Colloidal ZrO2Sols[J].Langmuir, 1998, 14: 5 011-5 022.
[14] Liang J, Deng Z, Jiang X,etal. Photoluminescence of Tetragonal ZrO2Nanoparticles Synthesized by Microwave Irradiation[J].InorgChem, 2002, 41: 3 602-3 604.
[15] Cao H, Qiu X, Luo B,etal. Synthesis and Room-Temperature Ultraviolet Photoluminescence Properties of Zirconia Nanowires[J].AdvFunctMater, 2004, 3(14): 243-246.
[16] Petrik N G, Taylor D P, Orlando T M. Laser-Stimulated Luminescence of Yttria-Stabilized Cubic Zirconia Crystals[J].JApplPhys, 1999, 85(9): 6 770-6 776.
[17] Lai L J, Lu H C, Chen H K,etal. Photoluminescence of Zirconia Films with VUV Excitation[J].JElectronSpectroscRelatPhenom, 2005, 144-147: 865-868.
[18] Lin C, Zhang C, Lin J. Phase Transformation and Photoluminescence Properties of Nanocrystalline ZrO2Powders Prepared via the Pechini-Type Sol-Gel Process[J].JPhysChemC, 2007(111): 3 300-3 307.
[19] Balakrishnan G, Thanigaiarul K, Sudhakara P,etal. Microstructural and Optical Properties of Nanocrystalline Undoped Zirconia Thin Films Prepared by Pulsed Laser Deposition[J].ApplPhysA-MaterSciProcess, 2013, 110(2): 427-432.
[20] Korkmaz S, Pat S, Ekem N,etal. Thermal Treatment Effect on the Optical Properties of ZrO2Thin Films Deposited by Thermionic Vacuum Arc[J].Vacuum, 2012, 86(12): 1 930-1 933.
[21] Joy K, Maneeshya L V, Thomas J K,etal. Effect of Sol Concentration on the Structural, Morphological, Optical and Photoluminescence Properties of Zirconia Thin Films[J].ThinSolidFilms, 2012, 520(7): 2 683-2 688.
[22] Goharshadi E K, Hadadian M. Effect of Calcination Temperature on Structural, Vibrational, Optical, and Rheological Properties of Zirconia Nanoparticles[J].CeramInt, 2012, 38(3): 1 771-1 777.
[23] Berlin I J, Anitha V S, Thomas P V,etal. Influence of Oxygen Atmosphere on the Photoluminescence Properties of Sol-Gel Derived ZrO2Thin Films[J].JSol-GelSciTechnol, 2012, 64(2): 289-296.
[24] Andrieux M, Ribot P, Gasqueres C,etal. Effect of the Oxygen Partial Pressure on the Toughness of Tetragonal Zirconia Thin Films for Optical Applications[J].ApplSurfSci, 2012, 263: 284-290.
[25] Lakshmi J S, Berlin I J, Daniel G P,etal. Effect of Calcination Atmosphere on Photoluminescence Properties of Nanocrystalline ZrO2Thin Films Prepared by Sol-Gel Dip Coating Method[J].PhysicaB-CondensedMatter, 2011, 406(15-16): 3 050-3 055.
[26] Kumar M, Reddy G B. Effect of Sol-Age on the Surface and Optical Properties of Sol-Gel Derived Mesoporous Zirconia Thin Films[J].AIPAdv, 2011, 1(2): 15-22.
[27] Berlin I J, Lakshmi J S, Lekshmy S S,etal. Effect of Sol Temperature on the Structure, Morphology, Optical and Photoluminescence Properties of Nanocrystalline Zirconia Thin Films[J].JSol-GelSciTechnol, 2011, 58(3): 669-676.
[28] Wang Z, Yang B, Fu Z,etal. UV-Blue Photoluminescence from ZrO2Nanopowders Prepared via Glycine Nitrate Process[J].ApplPhysA, 2005, 81(4): 691-694.
[29] Ito T, Maeda M, Nakamura K. Similarities in Photoluminescence in Hafnia and Zirconia Induced by Ultraviolet Photons[J].JApplPhys, 2005, 97: 054 104.
[30] Chen H R, Shi J L, Yan Y,etal. Violet-Blue Photoluminescent Properties of Mesoporous Zirconia Modied with Phosphoric Acid[J].ApplPhysLett, 2002, 81(15): 2 761-2 763.
[31] Ouyang Jing(欧阳静), Song Xingling(宋幸泠), Lin Mingyue(林明跃),etal. 氧空位对多孔氧化锆光学性质的影响[J].ChineseJournalofChemicalPhysics(物理化学学报), 2011, 27(12): 2 900-2 906.
[32] Liu Huangqing(刘晃清), Qin Guanshi(秦冠仕), Lin Haiyan(林海燕),etal. 二氧化锆纳米材料中三价铒离子的上转换发光[J].ChineseJournalofRareEarths(中国稀土学报), 2002, 20(S1): 266-269.
[33] Zhao X, Vanderbilt D. Phonons and Lattice Dielectric Proper-ties of Zirconia[J].PhysRevB, 2002, 65(7): 075 105.
[34] Assefa Z, Haire R G, Raison P E. Photoluminescence and Raman Studies of Sm3+and Nd3+Ions in Zirconia Matrices: Example of Energy Transfer and Host-Guest Interactions[J].SpectrochimActa,PartA, 2004, 60: 89-95.
[35] Nakajima H, Mori T. Correlation between Y2O3Concentration and Photoluminescence Excitation Spectra of Tb3+Impurity in Y2O3-Stabilized ZrO2[J].JAppl:Phys, 2005, 97: 023 503.
[36] Ghosh P, Priolkar K R, Patra A. Understanding the Local Structures of Eu and Zr in Eu2O3Doped and Coated ZrO2Nanocrystals by EXAFS Study[J].JPhysChemC, 2007, 111(2): 571-578.
[37] Ghosh P, Patra A. Role of Surface Coating in ZrO2/Eu3+Nanocrystals[J].Langmuir, 2006, 22(14): 6 321-6 327.
[38] Reisfeld R, Zelner M, Patra A. Fluorescence Study of Zirconia Films Doped by Eu, Tb and Sm and Their Comparison with Silica Films[J].JAlloysCompd, 2000, 300-301: 147-151.
[39] Zhao Z Y, Wang Y H. The Synthesis and Afterglow Luminescence Properties of a Novel Red Afterglow Phosphor: ZrO2:Sm3+,Sn4+[J].JLumin, 2012, 132(11): 2 842-2 846.
[40] Soares M R N, Nico C, Oliveira D,etal. Red Light from ZrO2:Eu3+Nanostructures[J].MaterSciEngB-AdvFunctSolid-StateMater, 2012, 177(10): 712-716.
[41] Gao Q X, Wang X F, Tao Y R,etal. Photoluminescence Properties of Zirconia Nanobelts with Trace Sm3+Ions[J].SciAdvMater, 2012, 4(2): 327-331.
[42] Tang H, Liu Y S, Luo W Q,etal. Optical Spectroscopy of Eu3+Ions in Tetragonal ZrO2Nanocrystals[J].JNanosciNanotechnol, 2011, 11(11): 9 445-9 450.
[43] Hipolito M G, Mart1 Nez R, Fregoso O A,etal. Cathodoluminescent and Photoluminescent Properties of Terbium Doped ZrO2Films Prepared by Pneumatic Spray Pyrolysis Technique[J].JLumin, 2001, 93: 9-15.
[44] Bucella S, Riello P, Scremin B F,etal. Synthesis and Luminescence Properties of ZrO2and ZrO2/SiO2Composites Incorporating Eu(III)-Phenanthroline Complex Prepared by a Catalyst-Free Sol-Gel Process[J].OptMater, 2004, 27: 249-255.
[45] Savoini B, Caceres D, Vergara I,etal. Radiation Damage in Neutron-Irradiated Yttria-Stabilized-Zirconia Single Crystals[J].JNuclMater, 2000, 277(2-3): 199-203.
[46] Hsieh W C, Su C S. UV Induced Thermoluminescence in ZrO2Doped by Er2O3[J].JPhysD:ApplPhys, 1994, 27(8): 1 763-1 768.
