Bmi-1、P16蛋白在乳腺癌组织中的表达及相关性研究
2014-08-31胡继卫孙志国张景华张顺礼李文建
胡继卫, 孙志国, 马 杰, 张景华, 张顺礼, 李文建
(河北省唐山市人民医院 乳腺科, 河北 唐山, 063001)
乳腺癌是女性最常见的恶性肿瘤之一,死亡率仅次于肺癌,对女性健康构成了极大威胁[1-2]。乳腺癌的发生是一个复杂、多因素、多步骤的病理生理过程,主要涉及癌基因的激活和抑癌基因的失活。本研究通过免疫组织化学SP法检测原癌基因Bmi-1与抑癌基因P16蛋白的表达情况,并进一步研究二者与临床生物学指标ER、PR、HER-2的关系,探讨Bmi-1与P16蛋白在乳腺癌发生发展中可能的作用及临床意义,为乳腺癌靶向基因提供一定的理论依据。
1 资料与方法
1.1 临床资料
选择本院2009年1月—2011年7月病例资料齐全的女性乳腺癌患者标本80例,年龄22~85岁,中位年龄48岁。其中,年龄<45岁38例,≥45岁42例;肿瘤直径≤2 cm 26例,2~5 cm 28例,>5 cm 26例;对癌组织进行组织学分级:Ⅰ级38例,Ⅱ级26例,Ⅲ级16例;根据国际抗癌协会乳腺癌TNM分期:Ⅰ~Ⅱ期42例,Ⅲ期38例。80例乳腺癌中,有淋巴结转移者42例, ER阳性者47例, PR阳性者44例,HER-2阳性者42例。另取癌旁组织(距癌组织≥5 cm、组织学结构正常)20例为对照组。所有患者术前均未接受化疗、放疗及内分泌治疗。
1.2 方法
1.2.1 Bmi-1表达检测: ① 试剂:兔抗人Bmi-1单克隆抗体(Bmil:D2087XpTM Rabbit mAb)辣根过氧化物酶HRP标记的山羊抗兔二抗分别由美国Cell signaling公司和北京中杉金桥生物技术有限公司提供;DAB显色试剂盒和抗小鼠/兔SABC免疫组化试剂盒分别购自福州迈新生物技术开发有限公司和武汉博士德生物工程有限公司; ② 免疫组织化学染色步骤:所有5 μm石蜡组织标本切片后,采用二甲苯常规脱蜡和梯度酒精水化,使用3%过氧化氢封闭10 min, 灭活内源性过氧化物酶后,应用0.01 mol/L枸橼酸钠缓冲液在pH6.0行15 min微波抗原修复。5%BSA封闭20 min, 滴加一抗Bmi-1(1∶100)4 ℃, 过夜培养。第2天,分别滴加山羊抗兔二抗和SABC, 在室温下培养20 min, PBS充分洗涤, DAB显色。苏木精复染、脱水、使透明、封片镜检。用PBS缓冲液代替一抗做空白对照。
1.2.2 p16蛋白表达检测: 免疫组织化学染色步骤:将5 μm石蜡切片置于65 ℃烤箱中,过夜孵育,二甲苯脱蜡。梯度乙醇脱水,自来水冲洗5 min, 蒸馏水冲洗2遍。采用pH6.0的柠檬酸溶液进行抗原修复。加入100 μL一抗,室温下孵育1 h, PBS缓冲液冲洗3次。去掉PBS液后,每张切片再加入100 μL二抗(即用型MaxVision),在室温下孵育15 min,PBS缓冲液冲洗3次。二氨基联苯胺显色,苏木素复染,梯度乙醇脱水、干燥、烘干,用树胶封片,在显微镜下读片。
1.3 判断标准
采用半定量计分法判定[4],随机观察10个高倍视野(×400)后评价结果,肿瘤细胞按染色强度分为4等: 0分为无染色; 1分为浅黄色; 2分为棕黄色; 3分为棕褐色。按照肿瘤阳性细胞所占的百分数分为5组: 0分,无着色; 1分,≤10%; 2分, 11%~50%; 3分, 51%~75%; 4分≥75%。ER、PR、HER-2为本院病理科常规检测方法与判断标准。
1.4 统计学方法
采用SPSS 17.0统计学软件进行所有数据统计分析。计数资料采用t检验。P<0.05为差异有显著统计学意义。
2 结 果
2.1 Bmi-1、p16在乳腺癌组织中的表达
Bmi-1、p16主要位于细胞核或胞浆内,阳性表达者可见棕黄色或棕褐色颗粒(见图1中B、C)。本研究还显示: Bmi-1在乳腺癌组织中的阳性表达率为68.75%(55/80), 而p16蛋白在乳腺癌组织中阳性表达率仅为55.00%(44/80),结果显示, Bmi-1蛋白在乳腺癌组织中的阳性表达率显著高于正常乳腺组织, p16的阳性表达显著低于正常对照组,差异均具有统计学意义(P<0.05)。
2.2 Bmi-1、p16 蛋白阳性表达与临床病理特征之间的关系
Bmi-1蛋白在乳腺癌组织学分级Ⅰ级、Ⅱ级、Ⅲ级中的表达率分别为52.63%、73.08%、100.00%, 在临床Ⅰ~Ⅱ期及Ⅲ期中,表达率分别为45.23%、94.74%, 在无淋巴结转移和有淋巴结转移组织中,表达率分别为47.62%和92.11%, 差异均具有统计学意义(P<0.01); 但Bmi-1与患者年龄、肿瘤大小、ER、PR、HER-2均无相关性(P>0.05)。而p16蛋白在组织学分级Ⅰ级、Ⅱ级、Ⅲ级中的表达率分别为73.68%、53.85%、12.50%, 在临床Ⅰ~Ⅱ期及Ⅲ期中,表达率分别为78.57%、28.95%, 在无淋巴结转移和有淋巴结转移组织中表达率为26.32%和80.95%, 差异均具有统计学意义(P<0.01); p16的表达与HER-2显著相关(P<0.05),但与患者年龄、肿瘤大小、ER、PR无相关性(P>0.05), 见表1。
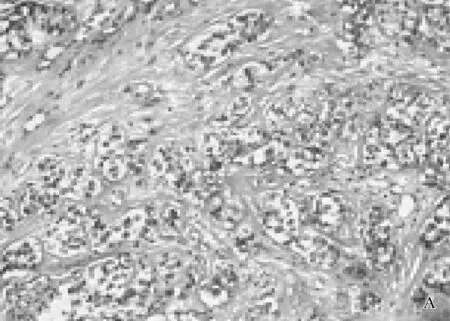
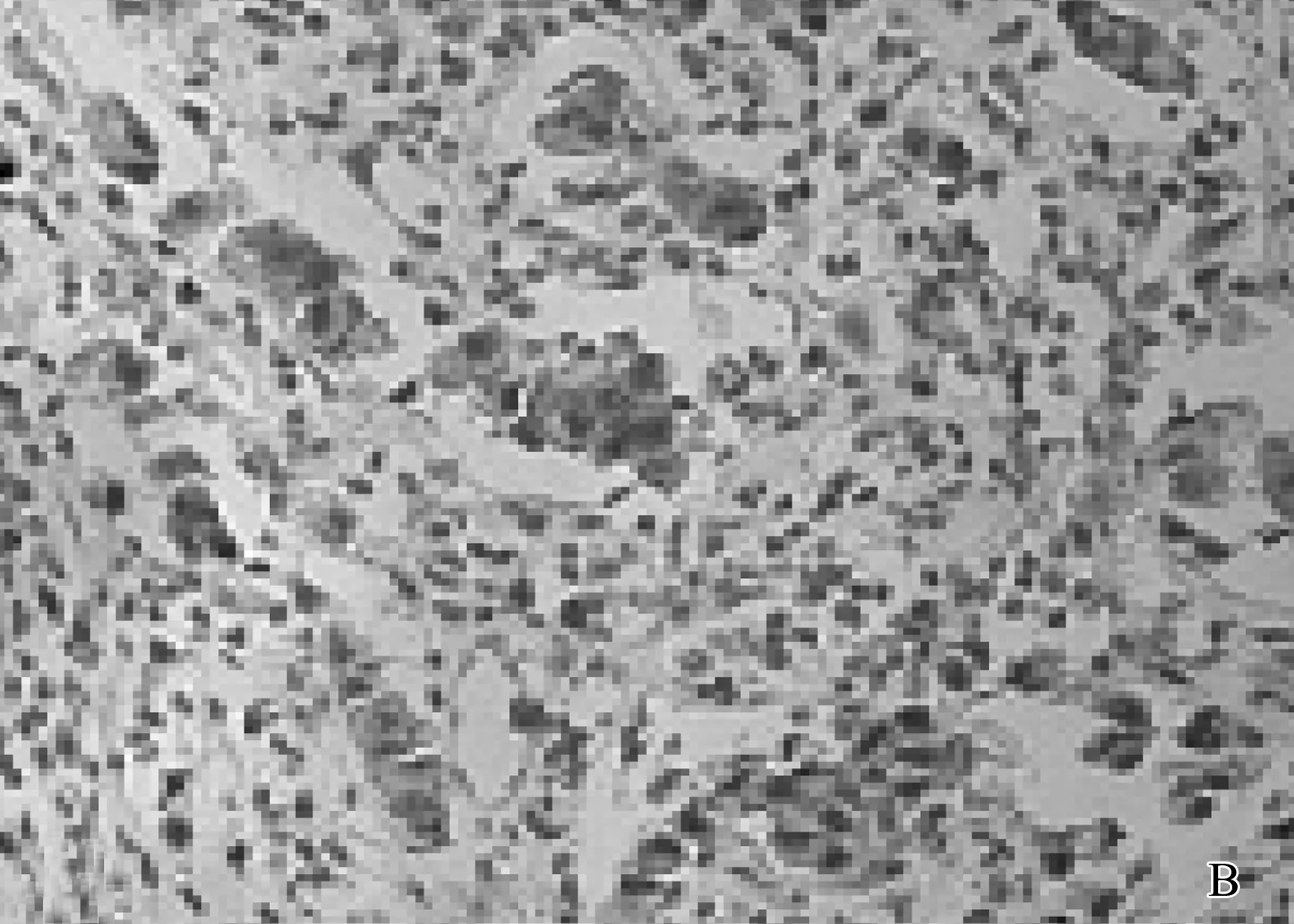
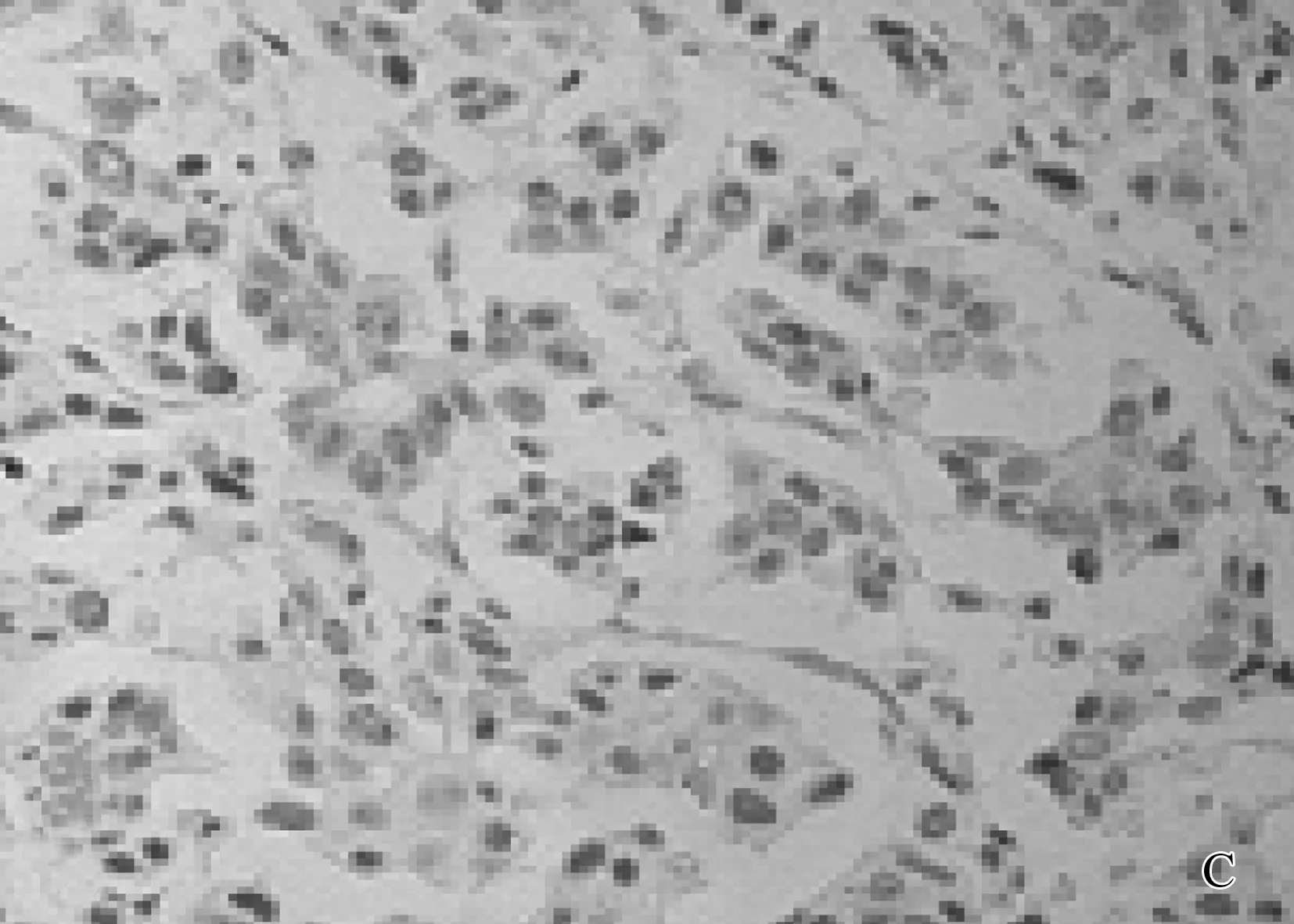
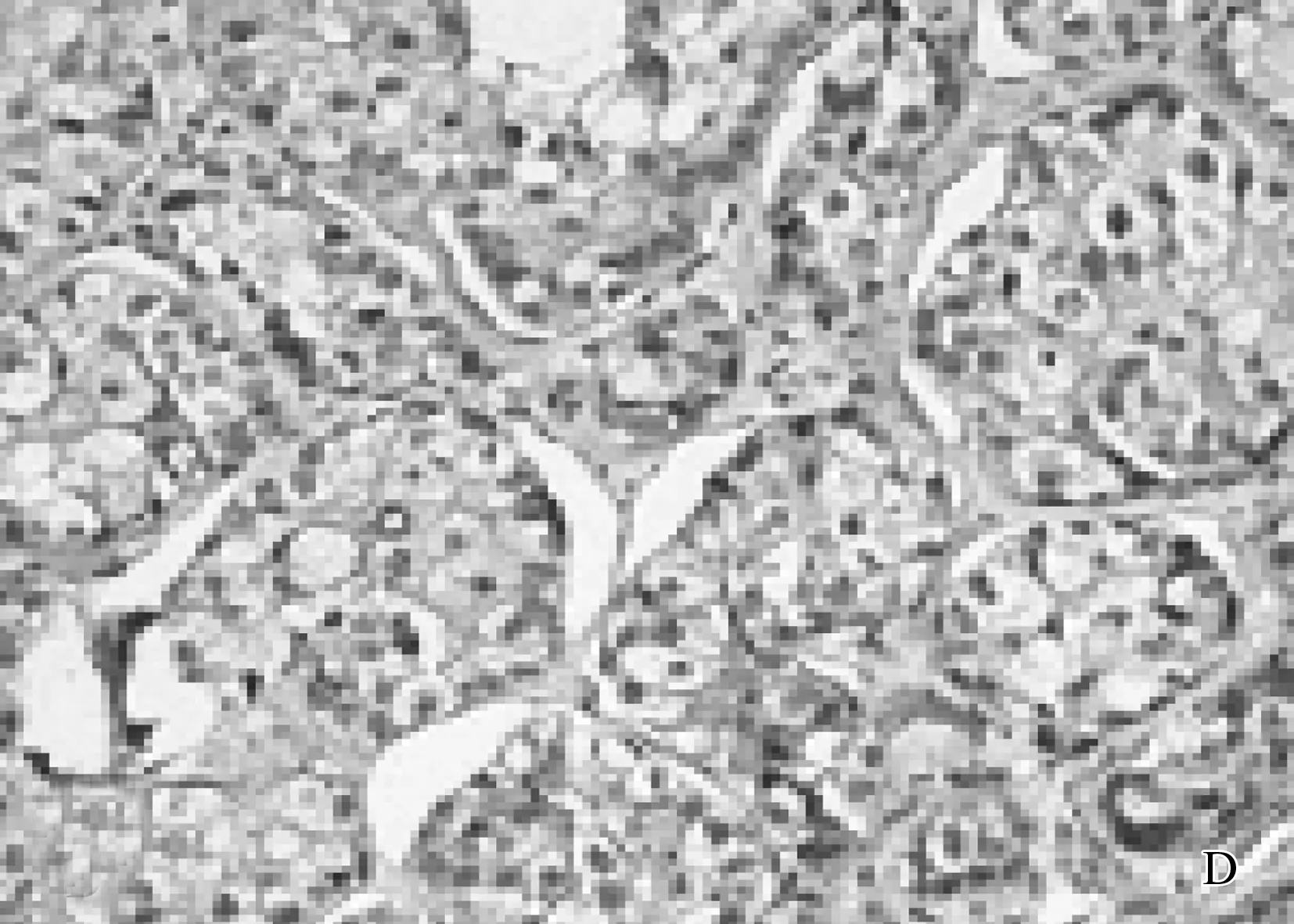
A: 乳腺癌组织HE染色; B: Bmi-1在乳腺癌组织中的阳性表达; C: P16在乳腺癌组织中的弱阳性表达; D: HER-2阳性在乳腺癌组织中的表达。
表1 乳腺癌组织中Bmi-1蛋白阳性表达与临床病理特征之间的关系[n(%)]
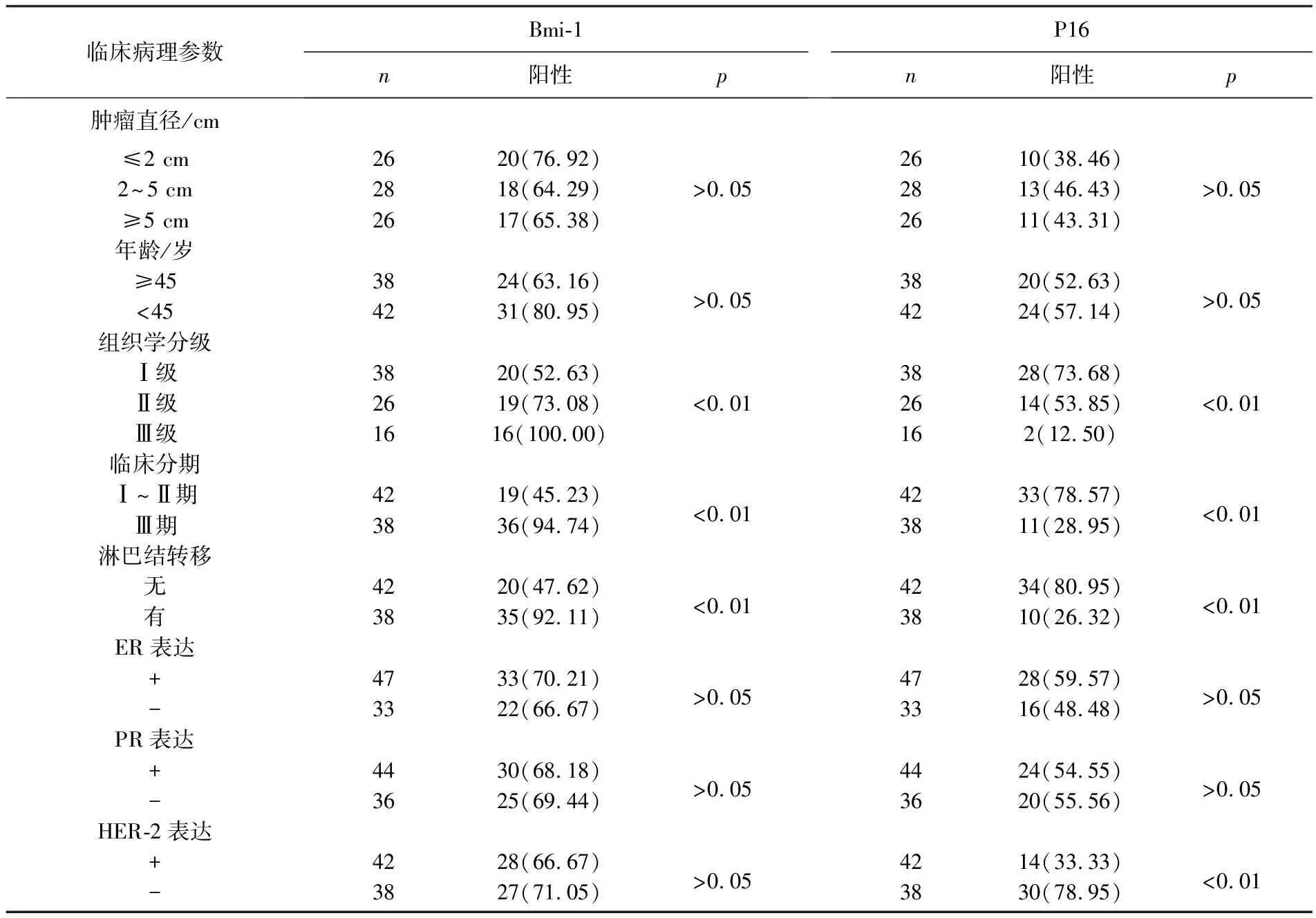
临床病理参数Bmi-1n阳性pP16n阳性p肿瘤直径/cm≤2 cm2620(76.92)2610(38.46)2~5 cm2818(64.29)>0.052813(46.43)>0.05≥5 cm2617(65.38)2611(43.31)年龄/岁≥453824(63.16)>0.053820(52.63)>0.05<454231(80.95)4224(57.14)组织学分级Ⅰ级3820(52.63)3828(73.68)Ⅱ级2619(73.08)<0.012614(53.85)<0.01Ⅲ级1616(100.00)162(12.50)临床分期Ⅰ~Ⅱ期4219(45.23)<0.014233(78.57)<0.01Ⅲ期3836(94.74)3811(28.95)淋巴结转移无4220(47.62)<0.014234(80.95)<0.01有3835(92.11)3810(26.32)ER表达+4733(70.21)>0.054728(59.57)>0.05-3322(66.67)3316(48.48)PR表达+4430(68.18)>0.054424(54.55)>0.05-3625(69.44)3620(55.56)HER-2表达+4228(66.67)>0.054214(33.33)<0.01-3827(71.05)3830(78.95)
3 讨 论
乳腺癌是女性最常见的恶性肿瘤之一,全世界每年约有57万例乳腺癌患者发生远处转移[2]。乳腺癌的治疗主要以手术、化疗、放疗、内分泌治疗、分子靶向治疗为主的综合治疗。部分早期乳腺癌患者,也会发生隐匿性转移[4]。乳腺癌的发生是一个复杂、多因素、多步骤的病理生理过程,主要涉及癌基因的激活与抑癌基因的失活。乳腺癌标志物雌激素受体(ER)、孕激素受体(PR)、癌基因(HER-2)一定程度上可反映其生物学行为[5-6]。本研究通过免疫组织化学SP法检测乳腺癌组织中Bmi-1与P16蛋白的表达情况,并探讨二者与上述标志物的关系,以阐明Bmi-1与P16蛋白在乳腺癌发生发展中可能的作用及临床意义,为后续研究奠定理论基础。
Bmi-1基因是Polycomb基因(PcG)家族的重要成员,可以作为一种原癌基因,参与肿瘤的发生发展[7]。研究[8]发现, Bmi-1在多种恶性肿瘤中呈现高表达,其促进肿瘤发生的可能机制为:Bmi-1蛋白进入细胞核与染色质结合,通过抑制其下游INK4a,减少INK4a-p16对cyclinD-CDK4的抑制,诱导细胞从G1期进入S期,促进肿瘤增殖;同时通过抑制p19-ARF,增加MDM-2的活性,减少细胞的凋亡[9]。目前,国内外关于Bmi-1与乳腺癌ER、PR、HER-2关系的研究鲜有报道。本实验通过免疫组织化学SP法检测80例乳腺癌组织和20例正常乳腺组织中Bmi-1蛋白的表达及其与临床生物学指标的关系[10-12], 结果表明, Bmi-1蛋白在乳腺癌组织中高表达,且与其组织学分级、临床分期及淋巴结转移呈正相关;但Bmi-1与患者年龄、肿瘤大小、ER、PR、HER-2均无关[13-14]。因此本研究认为, Bmi-1蛋白促进了乳腺癌增殖,并在乳腺癌晚期发生、浸润、转移的过程中可能起重要作用[15-16]。p16基因是细胞周期依赖激酶家族抑制蛋白(CKIs)成员之一,可编码一个由148个氨基酸组成的蛋白质,在限制点(R点)与D型细胞周期蛋白(cyclinD1)竞争性结合CDK4/CDK6,抑制CDK4/CDK6的作用,降低Rb蛋白磷酸化水平,从而阻止细胞通过限制点R点由G1期进入S期。因此,当p16蛋白不能正常表达时,会导致细胞无限增殖,进一步引起肿瘤的发生[17-18]。
本研究结果提示:与正常乳腺组织相比, p16蛋白在乳腺癌组织中低表达,说明p16蛋白的缺失表达在乳腺癌的发生发展中起重要作用。本研究还发现, p16蛋白在乳腺癌组织中的表达与肿瘤的组织学分级、临床分期及淋巴结转移呈负相关;与HER-2显著相关(P<0.05), 但与患者年龄、肿瘤大小、ER、PR无关。本实验通过联合检测Bmi-1、p16在乳腺癌中的表达情况,结果证实:此2种蛋白在乳腺癌中的表达与组织学分级、临床分期及淋巴结转移相关,且p16表达与靶基因HER-2表达显著相关。因此,Bmi-1、p16及HER-2的联合靶向治疗,有望成为乳腺癌治疗的新方法。然而,Bmi-1、p16是否能够作为新的肿瘤标志物应用于临床,还需要进一步的深入研究。
[1] Gaynor K U, Grigorieva I V, Allen M D, et al. GATA3 mutations found in breast cancers may be associated with aberrant nuclear localization, reduced transactivation and cell invasiveness[J]. Horm Cancer, 2013, 4(3): 123.
[2] Cappellani A, Di Vita M, Zanghì A, et al. Prognostic factors in elderly patients with breast cancer[J]. BMC Surg, 2013, Suppl 2: S2.
[3] 吕萍, 凌志强, 余江流, 等. 胃癌组织中p16基因甲基化状态及临床意义[J]. 肿瘤学杂志, 2013, 19(5): 332.
[4] Jhaveri K, Esteva F J. Pertuzumab in the Treatment of HER2+ Breast Cancer[J]. J Natl Compr Canc Netw. 2014, 12(4): 591.
[5] 刘卫红, 孟秀香, 刘丹丹, 等. 反义Bmi-1对Jurkat细胞的抑制作用[J]. 中华血液学杂志, 2005, 26(9): 554.
[6] Choi E J, Yun J A, Jeon E K, et al. Prognostic significance of RSPO1, WNT1, P16, WT1, and SDC1 expressions in invasive ductal carcinoma of the breast[J]. World J Surg Oncol, 2013, 11: 314.
[7] Sugianto J, Sarode V, Peng Y. et al. Ki-67 expression is increased in p16-expressing triple-negative breast carcinoma and correlates withp16 only in p53-negative tumors[J]. Hum Pathol, 2014, 45(4): 802.
[8] Panousis D, Xepapadakis G, Lagoudianakis E, et al. Prognostic value of EZH2, paxillin expression and DNA ploidy of breast adenocarcinoma: correlation to pathologic[J]. predictors. J BUON, 2013, 18(4): 879.
[9] Tateishi K, Ohta M, Kanai F, et al. Dysregulated expression of stem cell factor Bmi-1 in precancerous lesions of the gastrointestinal tract[J]. Clin Cancer Res, 2006, 12(23): 6960.
[10] 李嗣杰, 贾泓瑶, 吴迪. 肿瘤翻译调控蛋白在人乳腺癌组织中的表达及临床意义[J]. 南方医科大学学报, 2011, 31(9): 1560.
[11] 马吉光, 王宁菊, 于文洁. 三阴”型与非“三阴”型乳腺癌患者的生物学行为差异性分析[J]. 南方医科大学学报, 2011, 31(10): 1729.
[12] 喻大军, 张珂, 吕永超, 等. 放射性粒子植入治疗中晚期胰腺癌临床疗效观察[J]. 中华全科医学, 2009, 7(5): 460.
[13] 郑文博, 潘凌霄, 唐炜, 等. 乳腺癌干细胞的培养及鉴定[J]. 南方医科大学学报, 2011, 31(12): 2021.
[14] 郭启帅, 黄曦, 李少林. 沉默PeroxiredoxinⅠ基因对乳腺癌裸鼠移植瘤放射敏感性的影响[J]. 南方医科大学学报, 2011, 31(7): 1119.
[15] 肖钟迪, 张玉成, 梁春林, 等. 放射性125I粒子植入对裸鼠人乳腺癌细胞移植瘤的抗肿瘤作用[J]. 吉林大学学报: 医学版, 2011, 37(2): 275.
[16] 王玲, 单保恩, 桑梅香. 靶向沉默p65基因对人乳腺癌细胞MDA-MB-231增殖及凋亡的影响[J]. 南方医科大学学报, 2011, 31(10): 1742.
[17] Wang J, Mao X, Zhang Y, et al. Genome-wide screening of CpG island methylation changes induced by low-dose X-ray radiation in mice[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2014, 34(2): 228.
[18] Dalley A J, Pitty L P, Major A G, et al. Expression of ABCG2 and Bmi-1 in oral potentially malignant lesions and oral squamous cell carcinoma[J]. Cancer Med, 2014, 3(2): 273.
