建鲤IL–1β和IL–8基因实时荧光定量RT–PCR检测方法的建立
2014-08-31曾东肖拉倪学勤
曾东,肖拉,2,倪学勤*
(1.四川农业大学动物医学院动物微生态研究中心,四川 雅安 625014;2.乐山市市中区动物疫病预防控制中心,四川 乐山 614000)
建鲤IL–1β和IL–8基因实时荧光定量RT–PCR检测方法的建立
曾东1,肖拉1,2,倪学勤1*
(1.四川农业大学动物医学院动物微生态研究中心,四川 雅安 625014;2.乐山市市中区动物疫病预防控制中心,四川 乐山 614000)
根据GenBank上的基因序列,在保守区设定并合成特异性引物,选择β–actin作为内参基因,采用SYBR Green I染料法,进行熔解曲线分析和标准曲线的制作。熔解曲线表明,β–actin、IL–1β、IL–8的基因产物均为特异性产物,其Tm值分别为86、82.5和84 ℃;标准曲线表明,各基因Ct值的检测范围为12~32,扩增效率分别为96.3%,103.2%和102.6%,具有良好的线性关系,且r2均大于0.990;组内变异系数分别为0.14%~0.86%,0.18%~0.93%和0.13%~0.86%;用建立的方法检测健康建鲤头、肾组织中IL–1β、IL–8的表达情况,相对表达量分别为1.09和1.71。综合分析,建立的建鲤IL–1β、IL–8基因实时荧光定量PCR方法具有检测范围广,扩增效率高,特异性强,重复性高的特点,可用于建鲤IL–1β、IL–8基因的表达测定。
建鲤;IL–1β;IL–8;实时荧光定量RT–PCR
白细胞介素1β(interleukin–1β,IL–1β)和白细胞介素8(IL–8)分别作为重要的促炎因子和趋化因子,在硬骨鱼类(Osteichthyes)免疫系统中起着重要的作用[1]。在一般状况下,细胞因子的分泌量很低,或处于失活状态,但在机体的免疫细胞或组织受到刺激发生新的基因转录后,其含量将会大幅度上升,通过与特殊细胞表面受体的高亲和性结合,以协同形式结合其他细胞因子或抗病毒分子发挥免疫调节作用[2]。
IL–1β和IL–8的基因表达水平在家畜、禽类及鱼类上经常用作机体免疫力的指示器,对其活化程度进行评价,可以了解疾病的发病机制[1,3–5]。目前国外对鱼类基因表达的研究较多,如 I. E. Mulder等[3]研究感染沙门氏菌(Salmonella)的虹鳟(Oncorhynchus mykiss)肠道的IL–1β、IL–8基因时,发现它们的相对表达量均有所降低;S. F. Gonzalez 等[4]对感染寄生虫的鲤鱼(Cyprinus carpio L.)皮肤的IL–1β基因及D. H. Kim等[5]分别对益生菌共培养条件下虹鳟头、肾细胞中的IL–1β、IL–8等基因进行研究时,发现它们的表达量均升高,说明细胞因子的表达量会因为不同刺激出现不同程度的升高或降低,调节鱼体免疫功能。虽然鱼类 IL–1β、IL–8的免疫功能已有部分报道[6–8],但还没有系统研究它们的表达情况。为了更好地评价鱼类白细胞介素的免疫功能,准确测定IL–1β和IL–8在组织中的表达量极其重要,有必要在分子水平上建立一种实时、快速、有效的检测方法。
本试验以健康建鲤(Cyprinus carpio var. Jian)为材料,选取β–actin为参考基因,以建立一种快速方便有效的实时定量PCR检测方法。
1 材料与方法
1.1 材 料
1.1.1 试验鱼
体质量约为(50.4±3.8) g的健康建鲤,购自四川雅安鱼苗站。
1.1.2 主要仪器和试剂
CFX96实时荧光定量 PCR仪、MyCyclerTMThermal Cycler PCR仪、凝胶成像系统Gel DocXR,均为美国Bio–Rad公司产品;冷冻高速离心机,为德国Thermo fisher公司产品。
天根 DP421 TRNzol A+总 RNA提取试剂;WM5–2302830 Phase Lock Gel Heavy;KR103–04 Quant cDNA第一链合成试剂盒;free–DNase/RNase水;2 000 bp DNA Maker;SYBR Premix Ex TaqTMⅡ(Perfect Real Time)为TaKaRa公司产品。
1.1.3 引物的设计与合成
根据GenBank上建鲤的β–actin、IL–1β、IL–8基因序列,在各自的保守区设计特异引物。引物由上海生工生物工程有限公司合成。引物序列及产物大小见表1。

表1 建鲤β–actin、IL–1β和IL–8基因RT–qPCR扩增的引物序列及其产物大小Table 1 Primers used for the RT–qPCR for detection of β–actin, IL–1β, IL–8 of Jian carp
1.2 RNA的提取与反转录
取健康建鲤头、肾,用生理盐水冲洗后,在研钵中加入液氮研磨。采用天根DP421 TRNzol A+总RNA提取试剂和 WM5–2302830 Phase Lock Gel Heavy组合提取总RNA。提取的RNA用1%的琼脂糖凝胶电泳鉴定其完整性。提取到完整的RNA后,用天根KR103–04 Quant cDNA第一链合成试剂盒进行RNA反转录。所有操作均按照试剂盒说明书进行。反转录的cDNA于–20 ℃保存,备用。
1.3 标准品的制备
以cDNA为模板,PCR扩增β–actin、IL–1β、IL–8基因。反应体系为25 μL:SYBR Premix Ex TaqTM12.5 Ⅱ μL,上游引物1 μL(25 μmol/L),下游引物1 μL (25 μmol/L),cDNA 2 μL,RNase–free 水 8.5 μL。反应条件:95 ℃预变性 30 s;95 ℃ 变性5 s、62 ℃ 退火30 s、72 ℃延伸 15 s, 40个循环;最后4 ℃结束反应。
1.4 实时荧光定量PCR反应条件的优化
采用SYBR Green Ⅰ染料法,在CFX96实时荧光定量PCR仪进行扩增和数据分析,并对每个基因实时荧光定量 PCR的反应条件的退火温度和引物浓度进行优化。采用SYBR Premix Ex TaqTMⅡ试剂盒推荐的25 μL反应体系:SYBR Premix Ex TaqTMⅡ 12.5μL,上、下游引物各1 μL,cDNA 2 μL,RNase– free 水8.5 μL)。采用二步法(95 ℃预变性30 s;95 ℃变性5 s,Tm下处理30 s,40个循环),60 30 s℃ 上升到95 ℃,71个循环,获得熔解曲线。退火温度的优化在引物的(Tm±5) ℃进行。引物浓度在0.2~1.0 μmol/L调整。比较每个基因在不同温度和引物浓度下的Ct值、荧光强度及熔解曲线。
1.5 标准曲线的绘制
将标准品10倍系列稀释,取10–4~10–10梯度为模板,采用以上优化好的条件进行SYBR Green Ⅰ荧光定量PCR,每个稀释度设3个平行,建立标准曲线。
1.6 重复性检测
用建立好的实时荧光定量PCR方法,对6尾健康建鲤的头肾样品进行重复性检验,检测样品中β–actin、IL–1β和IL–8基因的Ct值。每个样品设3个重复。算出Ct平均值,并计算其变异系数(CV)。
1.7 健康建鲤头、肾中IL–1β和IL–8基因的相对表达量测定
用已建立的方法对 3个健康建鲤头肾样品中IL–1β和IL–8基因的相对表达量进行测定。每个样品设3个重复。采用CFX96实时荧光定量PCR仪自带分析系统(Pfaffl法)进行相对表达量分析。
2 结果与分析
2.1 RNA的提取效果
提取建鲤头、肾的总RNA进行1%琼脂糖凝胶电泳。结果(图1)显示,条带(28S、18S)清晰可见,条带间无明显的拖尾现象,这表明RNA降解少,完整性良好。采用核酸紫外分析仪进行检测,其OD260 nm/OD280 nm为1.91,说明RNA纯度较好,符合RT–PCR的要求。

图1 建鲤头和肾组织的总RNAFig.1 Total RNA from head kidney of Jian carp
2.2 特异性分析结果
实时荧光定量RT–PCR产物经琼脂糖凝胶电泳分析(图 2)表明,目的条带长度符合预期大小,β–actin为152 bp,IL–1β为114 bp,IL–8为150 bp,且实时荧光定量熔解曲线(图 3)分析结果均为特异性单峰,无引物二聚体等非特异性扩增产物,表明扩增的特异性好,产物为目的产物。β–actin、IL–1β 和IL–8等基因的目的产物的Tm值分别为86、82.5 和84 ℃。

图2 建鲤β–actin、IL–1β、IL–8基因目的产物的RT–PCR结果Fig.2 Electrophoresis of RT–PCR–amplified products forβ–actin, IL–1β, IL–8 of Jian carp

图3 建鲤β–actin、IL–1β和IL–8目的产物的熔解曲线Fig.3 Melting curve of PCR–amplified products for β–actin, IL–1β, IL–8 of Jian carp
2.3 荧光定量PCR的优化结果
如图4和图5所示:采用二步法,退火温度为62 ℃,引物浓度为0.6 μmol/L时具有最小Ct值和最强的荧光吸收值。

图4 不同退火温度下β–actin、IL–1β和IL–8目的产物的Ct值和荧光吸收值Fig.4 Ct and fluorescence value of PCR–amplified products forβ–actin, IL–1β, IL–8 of Jian carp at different temperatures

图5 不同引物浓度下β–actin、IL–1β和IL–8目的产物的Ct值和荧光吸收值Fig.5 Ct and fluorescence value of PCR–amplified products for β–actin, IL–1β, IL–8 of Jian carp at different primer concentrations
2.4 标准曲线的绘制
将标准品进行 10倍系列稀释,得到了均匀间距的扩增曲线,每个10倍稀释的Ct值相差大约3.3,用7个稀释度绘制相对定量标准曲线(图6)。标准曲线结果表明:β–actin、IL–1β和IL–8基因的Ct值的检测范围约为 12~32,扩增效率分别为 96.3%、 103.2%和102.6%,且相关系数r2均大于0.990。

图6 建鲤β–actin、IL–1β和IL–8 SYBR Green I实时荧光定量PCR的标准曲线Fig.6 Standard curve of SYBR Green I RT–qPCR amplified products for β–actin, IL–1β, IL–8 of Jian carp
2.5 稳定性
采用已建立的方法,测定6个样品的β–actin、IL–1β和IL–8基因的稳定性结果分别见表2、表3和表 4。结果表明,此方法的稳定性高,β–actin、IL–1β和 IL–8变异系数分别为 0.14%~0.86%、0.18%~0.93%和0.13%~0.86%。

表2 SYBR Green RT–qPCR 方法检测β–actin基因表达的重复性Table 2 Repeatability of SYBR Green RT–qPCR for detection of β–actin expression

表3 SYBR Green RT–qPCR 方法检测IL–1β基因表达量的重复性Table 3 Repeatability of SYBR Green RT–qPCR for detection of IL–1β expression
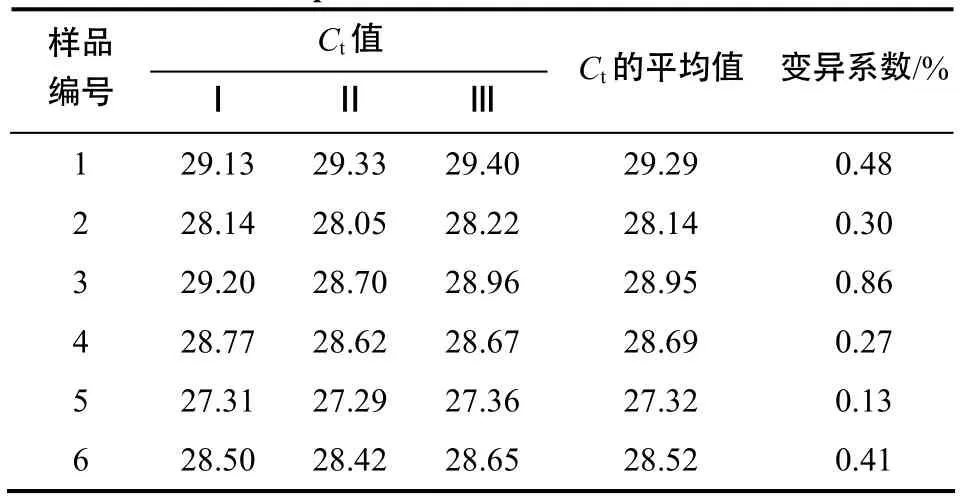
表4 SYBR Green RT–qPCR 方法检测IL–8基因表达量的重复性Table 4 Repeatability of SYBR Green RT–qPCR for detection of IL–8 expression
2.6 IL–1β和IL–8的相对表达结果
采用已建立的方法,分析得到3个健康建鲤头肾、样品中IL–1β和IL–8基因的相对表达量分别为1.09和1.71。
3 讨 论
IL–1β和IL–8是2种重要的细胞因子,广泛表达于鱼类的肾脏、脾脏、肝脏、肠道、皮肤等组织和器官中,其中作为重要免疫器官的头肾和脾脏中的表达量较多,因此,众多学者也将它们在头肾和脾脏中的表达水平作为衡量鱼类免疫功能的重要指标之一[5,9–12]。
相对于蛋白质检测水平的 ELISA及分子检测水平的Northern杂交、RNA酶保护试验等检测方法,RT–qPCR技术具有特异性强、灵敏度高、自动化和重复性好、定量准确、污染少等优点,还能通过熔解曲线对产物的真伪和纯度进行分析鉴定。本试验选用 SYBR Green Ⅰ法,通用性好,能与所有双链DNA结合产生荧光信号;灵敏度高,但容易产生非特异信号,所以对引物设计要求很高。在本试验中,每一对引物都扩增得到了单一产物,说明引物符合试验要求。在相对定量中,为了去除不同标本在 RNA产量、质量以及逆转录效率上可能存在的差别,选择了表达相对恒定的内参基因β–actin对测试样本进行数据标准化,以校正作为模板的cDNA所存在的数据差异[13–14]。但是,由于β–actin基因的表达量也会受到外来刺激的影响,因此有学者建议采用2种或2种以上的参考基因[15–16]。为弥补本试验只选取1个参考基因β–actin的不足,结合目的基因的扩增效率(E)来计算最后的结果,这样能对目的基因真实的相对表达量起到较好的校正作用[17]。
本试验在建立荧光定量PCR方法的过程中有2个优势(特点),即进行了反应体系的退火温度和引物浓度的优化,最后选择了具有最小Ct值和最强荧光吸收值的反应条件。评价标准曲线的优劣有2个指标,即相关系数r2和扩增效率E。r2表示标准曲线的线性度,理想值应大于 0.98,越接近 1, 说明其线性程度越好,定量越准确;扩增效率E的理想值通常要在105%~95%,越接近 100%,说明其扩增效率越高[18]。在本试验中,β–actin、IL–1β和IL–8 的r2分别为0.999,0.999和0.997,表明标准曲线线性程度好,误差小;E分别为96.3%、103.2%和102.6%,在理想范围内,大大降低了因扩增效率过低而造成的相对定量差异;所制作的3条标准曲线的 Ct值分别在 10.74~31.08、12.09~31.48和11.71~31.05 ℃,说明检测范围广。Pfaffl认为,当实时荧光定量PCR 扩增目的产物时,如果Ct值变异系数小于 2.5%,则定量反应结果可靠[17]。在本试验中,β–actin、IL–1β和IL–8荧光定量PCR 扩增Ct值变异系数均小于1.0%,表明所建立的实时荧光定量PCR检测这3个基因的表达重复性好,定量的结果可靠。因为mRNA转录的高动态性和样品操作及下游处理步骤的多变性[19],本试验的所有操作和注意事项均按照实时荧光定量 PCR国际化标准—MIQE指南进行[20],保证了建立检测建鲤IL–1β 和IL–8基因表达方法的真实性和可靠性。
本试验建立的检测建鲤 IL–1β和 IL–8基因RT–qPCR的方法具有检测范围广、扩增效率高、特异性强、重复性高的特点,可用于检测建鲤IL–1β、IL–8基因的相对表达量。
[1] 陈旭衍,侯亚义.鱼类细胞因子研究进展[J].水生生物学报,2004,28(6):668–673.
[2] Secombes C J,Hardie L J,Daniels G.Cytokines in fish:An update[J].Fish Shellfish Immunol,1996,6(4):291–304.
[3] Mulder I E,Wadsworth S,Secombes C J.Cytokine expression in the intestine of rainbow trout (Oncorhynchus mykiss) during infection with Aeromonas salmonicida [J].Fish Shellfish Immunol,2007,23(4):749–759.
[4] Gonzalez S F,Buchmann K,Nielsen M E.Real-time gene expression analysis in carp (Cyprinus carpio L.) skin:Inflammatory responses caused by the ectoparasite Ichthyophthirius multifiliis[J].Fish Shellfish Immunol,2007,22(6):641–650.
[5] Kim D H,Austin B.Cytokine expression in leucocytes and gut cells of rainbow trout,Oncorhynchus mykiss Walbaum,induced by probiotics[J].Fish Shellfish Immunol,2006,114(3/4):297–304.
[6] Castillo J,Teles M,Mackenzie S,et al.Stress-related hormones modulate cytokine expression in the head kidney of gilthead seabream (Sparus aurata)[J].Fish Shellfish Immunol,2009,27(3):493–499.
[7] Sigel M M,Hamby B A,Huggins E M.Phylogenetic studies on lymphokines:Fish lymphocytes respond to human IL–1 and epithelial cells produce an IL–1 like factor[J].Vet Immunol Immunopathol,1986,12(1/4):47–58.
[8] Kemenade B M L,Weyts F A A,Debets R,et al.Carp macrophage and neutrophilic granulocytes secrete an interleukin-1-like factor[J].Dev Comp Immunol,1995,19(1):59–70.
[9] Tanekhy M,Matsuda S,Itano T,et al.Expression of cytokine genes in head kidney and spleen cells of Japanese flounder (Paralichthys olivaceus) infected with Nocardia seriolae[J].Vet Immunol Immunopathol,2010,134(3/4):178–183.
[10] Covello J M,Bird S,Morrison R N,et al.Cloning and expression analysis of three striped trumpeter (Latris lineata) pro-inflammatory cytokines,TNF–alpha,IL–1β and IL–8,in response to infection by the ectoparasitic,Chondracanthus goldsmidi[J].Fish Shellfish Immunol,2009,26(5):773–786.
[11] Fast M,Johnson S C,Jones S R M.Differential expression of the pro-inflammatory cytokines IL–1β–1,TNFα–1 and IL–8 in vaccinated pink (Oncorhynchus gorbuscha) and chum (Oncorhynchus keta) salmon juveniles[J].Fish Shellfish Immunol,2007,22(4):403–407.
[12] Sigh J,Lindenstrøm T,Buchmann K.Expression of proinflammatory cytokines in rainbow trout (Oncorhynchus mykiss) during an infection with Ichthyophthirius multifiliis [J].Fish Shellfish Immunol,2004,17(1):75–86.
[13] Gutierrez L,Mauriat M,Guénin S,et al.The lack of a systematic validation of reference genes:A serious pitfall undervalued in reverse transcription-polymerase chain reaction (RT–PCR) analysis in plants[J].Plant Biotechnol J,2008,6(6):609–618.
[14] Huggett J,Dheda K,Bustin S.Real-Time RT–PCR normalization,strategies and considerations[J].Genes Immun,2005,6(4):279–284.
[15] Schmid H,Cohen C,Henger A,et al.Validation of endogenous controls for gene expression analysis in micro dissected human renal biopsies[J].Kidney Int,2003,64(1):356–360.
[16] Vandesompele J,Preter K D,Pattyn F,et al.Accurate normalization of real-time quantitative RT–PCR data by geometric averaging of multiple internal control genes[J].Genome Biol,2002,3 (7):research 0034.1–0034.11.
[17] Pfaffl M.A new mathematical model for relative quantification in real-time RT–PCR[J].Nucleic Acids Res,2001,29(9):2002–2007.
[18] Wong M L,Medrano J F.Real-time PCR for mRNA quantitation[J].BioTechniques,2005,39:75–85.
[19] Garson J,Huggett J,Bustin S,et al.Unreliable real-time PCR analysis of human endogenous retrovirus-W (HERV–W) RNA expression and DNA copy number in multiple sclerosis[J].AIDS Res Hum Retroviruses,2009,25(3):377–378.
[20] Bustin S,Benes V,Garson J,et al.The MIQE guidelines:Minimum information for publication of quantitative real-time PCR experiments[J].Clin Chem,2009,55(6):611–622.
责任编辑:苏爱华
英文编辑:罗 维
Establishment of a real-time fluorescent quantitative RT–PCR for detection of IL–1β and IL–8 genes of Cyprinus carpio var. Jian
ZENG Dong1, XIAO La1,2, NI Xue-qin1*
(1.Animal Microecology Institute, College of Veterinary, Sichuan Agricultural University, Ya’an, Sichuan 625014, China; 2.Animal Disease Prevention and Control Center of Leshan City, Leshan, Sichuan 614000, China)
To establish a real-time fluorescent quantitative PCR assay for detection of IL–1β and IL–8 genes of Cyprinus carpio var. Jian, specific primers were designed according to the gene sequences available in GenBank, and the β–actin gene was used as a reference gene. The standard curve and the melting curve were analyzed through SYBR Green I method. Melting curve showed specific PCR products of β–actin, IL–1β and IL–8 gene were obtained with Tm86, 82.5 and 84 ℃ , respectively.Standard curve there were good linear relationship for β–actin, IL–1β and IL–8 (r2> 0. 990) under detecting Ctrange of 12 to 32. The amplification efficiency were 96.3%, 103.2%, and 102.6%, respectively, and the coefficients of variation (CV) of using this developed assay to detect these genes are 0.14%-0.86%, 0.18%-0.93% and 0.13%-0.86%, respectively. Relative expression value of IL–1β and IL–8 in healthy Cyprinus carpio var. Jian was 1.07 and 1.71, respectively. Conclusion: The developed real-time fluorescent quantitative PCR assay for IL–1β and IL–8 of Cyprinus carpio var. Jian, which showed broad range, high efficiency, specificity and reliability, could be used to detect IL–1β and IL–8 expression at mRNA level.
Cyprinus carpio var. Jian; IL–1β; IL–8; real-time fluorescent quantitative PCR (RT–qPCR)
10.13331/j.cnki.jhau.2014.06.013
投稿网址:http://www.hunau.net/qks
S941
A
1007−1032(2014)06−0627−06
2013–08–30
四川省科学技术厅国际合作项目(2013HH0055);四川省学术带头人培养基金
曾东(1961—),男,四川丹棱人,博士,教授,从事水产动物微生态研究,zend@sicau.edu.cn;*通信作者,xueqinni@foxmail.com
