芒(Miscanthus sinensis)再生体系的建立和优化
2014-08-31黄丽芳殷绪明陈智勇肖亮易自力
黄丽芳,殷绪明,陈智勇,肖亮,易自力*
(1.中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,湖南 长沙 410125;2.湖南农业大学生物科学技术学院,湖南 长沙 410128)
芒(Miscanthus sinensis)再生体系的建立和优化
黄丽芳1,殷绪明1,陈智勇2,肖亮2,易自力2*
(1.中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,湖南 长沙 410125;2.湖南农业大学生物科学技术学院,湖南 长沙 410128)
以芒(Miscanthus sinensis)的幼穗为材料,通过外植体消毒灭菌、愈伤组织诱导、不定芽分化增殖、生根和驯化移栽,建立芒组织培养的快速繁殖体系。结果表明:芒愈伤组织诱导的最佳培养基是MS+4.0 mg/L 2,4–D + 1.0 mg/L 6–BA + 0.5 mg/L CuSO4,愈伤组织诱导频率达99.33%;不定芽分化和增殖的最佳培养基分别为MS+1.0 mg/L 6–BA + 0.4 mg/L NAA + 0.4 mg/L IAA和MS+ 3.0 mg/L 6–BA +1.5 mg/L PP333+1.0 mg/L CCC,分化率为96%,增殖系数为9.1;生根培养基选用MS+0.5 mg/L IAA + 0.5 mg/L NAA + 0.5 mg/L CCC + 0.5 mg/L PP333,生根率达100%;将再生苗移栽至用黄土和营养土配制的基质上,其成活率高达95%,且生长势良好。
芒;能源植物;离体培养;正交设计;方差分析
笔者以多年生芒的幼穗为材料,通过愈伤组织诱导、不定芽分化增殖、生根和驯化移栽,拟建立芒组织培养的快速繁殖体系。
1 材料与方法
1.1 供试材料
供试材料为多年生芒(M. sinensis),编号为B0634,采集于长沙,种植在湖南农业大学芒属能源植物资源圃。该芒草是从1 000多份野生资源中筛选出的优良株系,其植株高大,根状茎发达,抗逆性强,生物质产量高。
1.2 方 法
1.2.1 外植体的消毒
在孕穗期,选取颖花花原基形成期和花粉母细胞形成期的幼穗(旗叶刚抽出不久),剪取幼穗的茎秆上端,剥去叶鞘和外层苞叶,保留最后一层苞叶,用70%乙醇彻底擦拭叶鞘和茎秆,然后在超净工作台上用0.1%氯化汞消毒15 min,无菌水清洗5次,放置在无菌滤纸上,吸干外植体表面水分,剥出幼穗后备用。
1.2.2 愈伤组织的诱导培养
用无菌剪刀将幼穗剪成长约1 cm小段接入MS培养基中,分别添加2,4–D(2.0、4.0、6.0 mg/L)、6–BA(0.5、0.8、1.0 mg/L)和CuSO4(0.0、0.5、1.0 mg/L),并用镊子将其拨散,使其与培养基充分接触,放置培养室中暗培养,温度控制在(24±2) ℃。3种植物生长调节剂(2,4–D、6–BA和CuSO4) 采用L9(33)正交设计,配合使用。每个处理接种5皿。每皿30个穗段。重复3次。每7 d观察1次。培养30 d后统计出愈率。
1.2.3 不定芽的分化培养
挑取新鲜、颗粒状、直径2~5 mm的黄绿色或乳白色胚性愈伤接入 MS培养基中,分别添加6–BA(0.5、1.0、2.0 mg/L)、NAA(0.2、0.4、0.6 mg/L) 和IAA(0.2、0.4、0.6 mg/L)。3种植物生长调节剂(6–BA、NAA和IAA)采用L9(33) 正交设计,配合使用。每个处理接种5皿。每皿25块愈伤。重复3次。每5 d观察1 次。培养30 d后统计分化率。
1.2.4 不定芽的增殖培养
待幼苗长至1~3 cm时,分成小芽丛转至增殖培养基中。增殖培养基在 MS培养基中分别添加6–BA (1.0、2.0、3.0 mg/L)、PP333(0.5、1.0、1.5 mg/L) 和CCC (0.5、1.0、1.5 mg/L)。培养室温度控制在(24±2) ℃,光照12 h/d,光强约为2 000 lx。3种植物生长调节剂采用L9(33) 正交设计,配合使用。每个处理接种15瓶。3芽一丛,每瓶15芽。重复3次。每7 d观察1次新芽的生长情况。新增殖的不定芽长度达到 0.5 cm以上才计数,30 d后统计不定芽增殖倍数(增殖倍数=增殖芽数/接种芽数)。
1.2.5 试管苗的生根诱导
待不定芽长至3.0~5.0 cm时,接种到MS+IAA 0.5 mg/L+NAA 0.5 mg/L+CCC 0.5 mg/L+PP3330.5 mg/L生根培养基上。培养室温度控制在(24±2) ℃,光照12 h/d,光强约为2 000 lx。每个处理接种50个芽。重复3次。每7 d观察1次。30 d后统计生根率。
1.2.6 试管苗的驯化移栽
挑选具有4~5片叶的生根试管苗,置室温下培养7 d左右,打开瓶盖后炼苗3~4 d,从培养瓶中取出,分成单株,用自来水清洗黏附在根部的培养基(以防止烂根),然后移入装有消毒基质 (黄土与营养土的体积比为3∶1) 的盆钵中。移栽后,前15 d使用有顶玻璃罩盖好,之后每隔7 d喷水1次。温室栽培成活后的试管苗,移栽到大田。移栽时,为保证高的移栽成活率,避免在正午烈日下种植。容器苗由于是带基质移栽,根系不会受到伤害,种植后立即浇定根水。每个处理移栽100株苗,重复3次。每3 d观察1次,30 d后统计移栽成活率。
采用正交设计助手进行方差分析。
2 结果与分析
2.1 愈伤组织的诱导效果
接种后约 7 d,幼穗两端切口处开始伸长、膨大;接种后15 d左右,切口处陆续出现乳白色的愈伤组织小团;接种后25 d转入光照培养后,愈伤组织加速增大,并向四周扩展,局部出现绿点,随即有少量绿色芽点在诱导培养基上分化成小芽(图1–B)。

图1 芒幼穗离体培养及植株再生Fig.1 In vitro culture and plant regeneration from immature inflorescences of Miscanthus sinensis
试验中发现不同浓度2,4–D处理形成的愈伤组织形态结构各不相同。根据Armstrong等[17]的标准可将愈伤组织分为3类:Ⅰ类呈乳白色或浅黄色,颗粒状,结构致密,容易分化出再生植株,2,4–D质量浓度为 2.0 mg/L时形成的愈伤组织多为该类型;Ⅱ类呈黄绿色,外植体细胞旺盛增生并完全愈伤化,颗粒状,质地松软,长期继代仍有胚性,能通过胚状体途径再生,2,4–D质量浓度为4.0 mg/L时的愈伤组织多为该类型;Ⅲ类呈黄褐色,质地较硬,复杂多样,产生的胚状体较少,不易长期继代,且难以分化成再生植株,2,4–D质量浓度为6.0 mg/L时形成的愈伤组织与此相似。

表1 芒幼穗愈伤组织诱导的正交试验结果Table 1 The result of callus induction from immature inflorescences of Miscanthus sinensis through orthogonal experiment
由表1可以看出,不同质量浓度2,4–D处理诱导率的极差最大(R=48.67);其次为 6–BA 的(R=11.33);CuSO4的最小(R=8.77),说明在参试的3种植物生长调节剂中,2,4–D对芒幼穗愈伤组织诱导的影响最大,其次为6– BA,CuSO4的影响较小。方差分析结果和极差判断结果相一致,即2,4–D不同浓度水平之间诱导率的差异均达到极显著水平(P<0.01)。

续 表
多重比较结果(表 1)表明,A2B3C2、A2B1C3、及A2B2C1等3种培养基的诱导率均在87%以上,对幼穗愈伤组织的诱导率显著高于其他6种培养基的诱导率,差异达到极显著水平(P<0.01),因此,诱导愈伤组织的最佳2,4–D质量浓度为4.0 mg/L。同时附加的6–BA质量浓度应介于0.5~1.0 mg/L,愈伤组织诱导率随着 6–BA质量浓度的增加而升高,愈伤组织表面绿色芽点越多,质量浓度为 1.0 mg/L时达到最高,为99.33%,极显著高于其他处理(Y4除外)。另外,附加CuSO4能明显促进芒幼穗愈伤组织的形成,在添加0.5 mg /L CuSO4的培养基上表现最好,10 d左右开始形成胚性愈伤组织,并且愈伤组织的质量比较高,呈紧密的白色颗粒状,生长迅速。由此可见,芒愈伤组织诱导添加的激素及最佳配比为4.0 mg/L 2,4–D+1.0 mg/L 6–BA+ 0.5 mg/L CuSO4。
2.2 不同植物生长调节剂对芒芽分化的影响
对影响芒植株再生的因子,通过正交试验方法优化组合(表2)。乳白色胚性愈伤在分化培养基上培养10 d后出现绿色小芽点,15 d左右芽开始伸长,并再生出丛生状的绿色植株的茎叶,随后大多数培养基中的丛生芽不断增加,且生长健壮(图 1–C),有部分芽的根部逐渐形成发达的根系,长成完整的小植株。
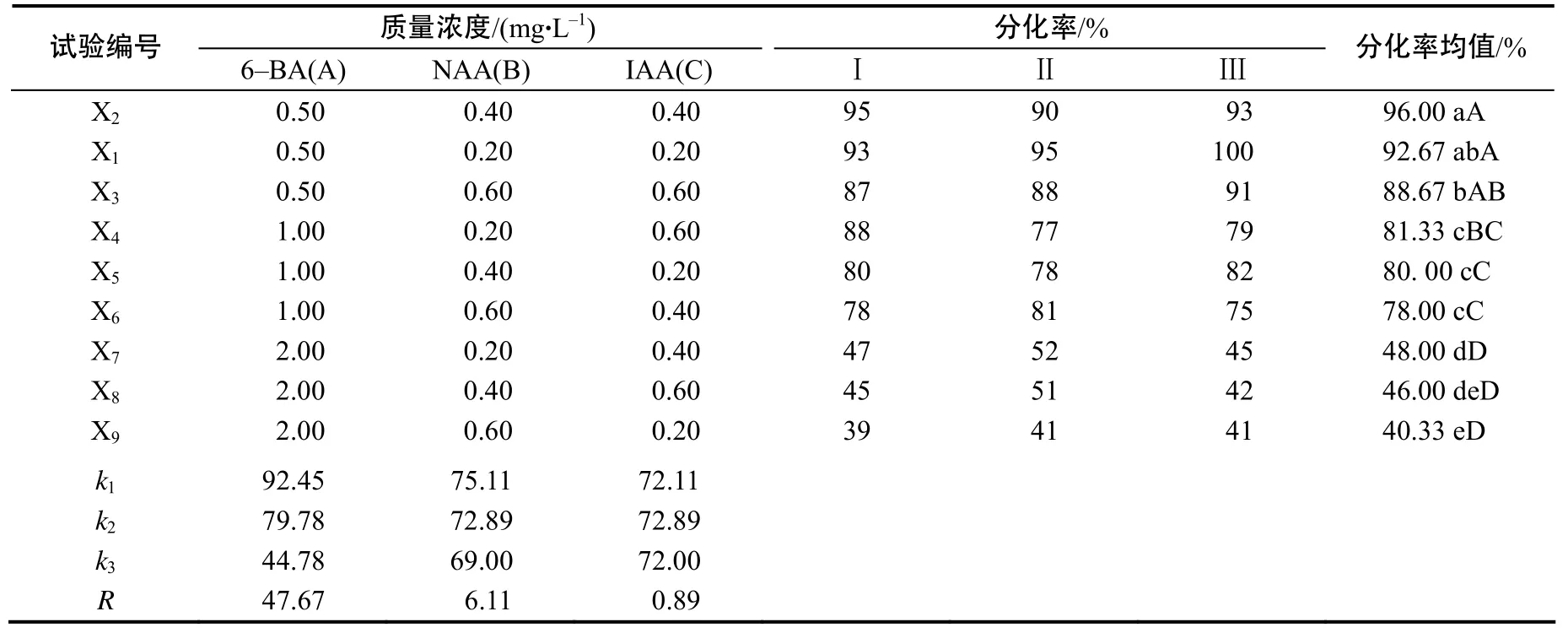
表2 芒幼穗愈伤组织分化的正交试验结果Table 2 The result of callus differentiation from spike of Miscanthus sinensis through orthogonal experiment
由接种 30 d后的分化率(表 2)可知,6–BA、NAA、IAA的极差分别为47.67、6.11、0.89,说明6–BA对丛生芽分化诱导产生的效应最大,其次为NAA ,IAA产生的效应最小。方差分析结果表明,6–BA不同浓度水平分别对芒再生体系的影响达到极显著水平(P<0.01),NAA各水平对芒不定芽分化的影响达到显著水平( P<0.05),而IAA 各水平对芒不定芽分化的影响较小。说明不同浓度水平的6–BA对芒不定芽分化诱导的影响最大,NAA则次之,这与直观分析的结果相一致。由于IAA对芒丛生芽分化和增殖诱导的影响较小,可以不考虑其影响。综合考虑,各因子的最佳组合为 A1B2C2,即1.0 mg/L 6–BA、0.4 mg/L NAA 和0.4 mg/L IAA。
2.3 不同植物生长调节剂对芒芽增殖的影响
培养7 d左右,基部开始长出绿色的小芽点,15 d左右逐渐生长出不定芽。在W1、W2、W3试验培养基上不定芽伸长快,试管苗平均高度达8.5 cm,叶色绿,生长健壮;在W4、W5、W6试验培养基上幼芽均匀一致,平均高度达5.5 cm,生长良好;在W7、W8、W9试验培养基上新生芽矮化,平均高度仅为3.8 cm,节间短,叶色绿,生长健壮。
由表3可以看出,不同质量浓度6–BA处理诱导率的极差最大(R=5.19);其次为PP333的(R=1.41);CCC的最小(R=0.79),对芒不定芽增殖影响的主次因素依次为 6–BA、PP333、CCC。这说明对于芒不定芽增殖起主要作用的是6–BA,其次是PP333,CCC对增殖的影响较小。方差分析结果和极差判断结果相一致,即6–BA不同浓度之间诱导率的差异均达到极显著水平(P<0.01)。从试验中可见,矮壮素和多效唑抑制芒试管苗的茎生长,高浓度(1.0~1.5 mg/L)多效唑和矮壮素,能显著提高芒增殖系数,缩短节间长度,降低茎高,而且使用效果十分显著(图1–D)。低浓度(0.5 mg/L)多效唑和矮壮素处理的培养基中虽然也有芽的分化,但芽的质量较差,成苗质量不高,苗高而弱。
综上所述,芒不定芽增殖培养的最佳处理为A3B3C2,即4.0 mg/L 6–BA、1.5 mg/L PP333和1.0 mg/L CCC。芒不定芽在此配方上的增殖倍数达到9.1。

表3 不同诱导培养基对丛生芽增殖影响的正交试验结果Table 3 Effects of medium compositions on the production of shoot clumps
2.4 生根诱导培养
芒试管苗在生根培养基上培养20 d左右,长出3~5条、长3~4 cm粗壮的根系,生根率达100%。
2.5 移栽与定植结果
将移栽后的芒试管苗在温室培养30 d左右,待新叶长出、新根形成时视为已成活,成活率高达95%以上,且生长旺盛(图1–E)。移栽大田后,根系从原来容器狭小的空间中解脱出来,有利于对养分的吸收。植株生长迅速,顶端优势十分明显。经过2年的生长观察,试管苗长势整齐一致,株形美观挺拔,植株高大,平均生长高度达 1.5 m以上(图1–F)。
3 结论与讨论
1) 芒幼穗再生体系的建立和优化是可行和高效的。本试验对影响芒幼穗愈伤组织诱导、愈伤组织分化及增殖培养的因子进行优化,初步探明了愈伤诱导、植株再生、丛生芽增殖的主要影响因子,从而使芒愈伤组织诱导率和丛生芽分化率都明显高于已有的研究:如愈伤组织诱导率高于 K. Głowacka等[18]报道的结果(76.7% );丛生芽分化率高于E.S. Seong等[19]报道的最高分化率。另外,本试验摸索出的组织培养体系的优势还体现在丛生芽长期继代而增殖系数基本不下降。此技术体系短期内可获得大量的丛生芽。
2) 生长调节剂对芒幼穗再生体系的影响。植物生长调节剂的种类和浓度对芒的诱导和分化有较大的影响[18–19]。在愈伤组织诱导方面,2,4–D是最有效激素之一,最佳质量浓度为2.0~4.0 mg/L,高浓度不仅降低诱导率,而且大幅度降低植株再生率。在本试验中,当2,4 –D质量浓度超过4.0 mg/L,愈伤组织的诱导率明显下降;6–BA是丛生芽分化和增殖的主要生长调节剂,1.0 mg/L 6–BA最利于芒再生芽的形成,并且与其他水平达到极显著差异;3.0 mg/L 6–BA最利于丛生芽的增殖,而且丛生芽增殖表现出很强的群体效应,不仅培养时间缩短,而且增殖系数高。
3) 其他试验因子对芒再生体系的影响。多效唑能抑制植物体内赤霉素的生物合成;矮壮素是赤霉素的拮抗剂,因而二者都能起到增强光合作用、促进作物茎秆粗壮、缩短节间距、调节株型、防止倒伏的作用。从试验中可见,矮壮素抑制芒试管苗的茎生长,随着矮壮素质量浓度的增加,其茎长受抑制程度逐渐增大,试管苗茎秆变粗,叶面积增大。Chi等[20]证明在草地早熟禾品种Kenblue的诱导培养基中添加0.01 mg/L CuSO4能显著提高诱导率、生长速率和胚性愈伤率,而0.5 mg/L CuSO4能提高再生率。本研究中也获得了初步的成果,在培养基中添加0.5 mg/L CuSO4时,愈伤组织从含水量高、水渍状转为表面干燥、具有颗粒状结构,并且出现了紧密的白色胚性愈伤组织,胚性愈伤组织的诱导率较高,且易分化出苗。
[1] Lewandowskia J C,Clifton–Brownb J C,JScurlockc J M O, et al.Miscanthus:European experience with a novel energy crop[J].Biomass and Bioenergy,2000,19:209–227.
[2] Rowe R L,Street N R,Taylor g G.Identifying potential environmental impacts of large-scale deployment of dedicated bioenergy crops in the UK[J]. Renewable& Sustainable Energy Reviews,2009,13:260–279.
[3] Sang T,Zhu W.China’s bioenergy potential[J].Global Change Bioenergy,2011,3:79–90.
[4] 范希峰,左海涛,侯新村,等.芒和荻作为草本能源植物的潜力分析[J].中国农学通报,2010,26(14):381–387.
[5] 谢光辉.能源植物分类及其转化利用[J].中国农业大学学报,2011,16(2):1– 7.
[6] 易自力.芒属能源植物资源的开发与利用[J].湖南农业大学学报:自然科学版,2012,38(5):455–463.
[7] Inger B H,Karen K P .Callus induction and plant regeneration from different explant types of Miscanthus × Ogiformis honda ‘Giganteus’ [J].Plant Cell Tissue and Organ Culture,1996,45:43–52.
[8] Marcela Gubisová,Jozef Gubis,Alzbeta Zofajová et al. Enhanced in vitro propagation of Miscanthus ×Giganteus [J]. Industrial Crops and Products,2013,(41):279–282.
[9] 钟智林,蒋建雄,杨璐,等.玉米 SSR引物在芒属植物遗传多样性分析的应用研究[J].现代生物医学进展,2009,9(11):2076–2079,2119.
[10] 肖亮,薛德,蒋建雄,等.中国芒( Miscanthus sinensis)种质资源 SSR 标记遗传多样性分析[J].植物遗传资源学报,2013,14(1):37–42.
[11] Sun Q,Lin Q,Yi Z ,et al.A taxonomic revision of Miscanthus sinensis L.(Poaceae) from China[J].Botan J Linnean Soci,2010,164:178–220.
[12] 宗俊勤,陈静波,聂东阳,等.我国不同地区芒和荻种质资源抗盐性的初步评价[J].草地学报,2011,19(5) :803–807.
[13] 焦树英,徐家林,李红利,等.芒草对 NaCl 和 PEG胁迫的生理响应及相关性分析[J].中国草地学报,2010,32(5):21 –26.
[14] 胡小虎,刁英,郑兴飞,等.芒AFLP 反应体系的建立[J].氨基酸和生物资源,2010,32(3):10–14.
[15] 杜凤,蒋建雄,卢玉飞,易自力.芒属植物核型分析技术体系的建立[J].现代生物医学进展,2009,9(10):1878–1880.
[16] 易自力,肖亮,蒋建雄,等.芒的快速繁殖方法:中国,ZL201010259544.1[P].2010–08–23.
[17] Armstrong C L,Green C E.Establishment and maintenance of friable,embryogenic maize callu s and the involvement of L–pro–line[J].Planta,1985,164:207–2l4.
[18] Głowacka K,Jeżowski S,Kaczmarek Z.The effects of genotype,inflorescence developmental stage and induction medium on callus induction and plant regeneration in two Miscanthus species[J].Tissue and Organ Culture,102 (1):79–86.
[19] Seong ES,Yoo J H,Kil H Y,et al.Estab–lishment of a regeneration system by callus induction from explants of Miscanthus sinensis[J].Korean Soc Appl Biol Chem ,2010,53:661–667.
[20] Chi D H,Peggy G,Lemaux,et al.Stable transformation of a recalcitrant kentuckybluegrass(Poa pratensis L.) cultivar using mature seed–derived highly regenerative tissues[J].Vitro Biology,2001,37(1):6–17.
责任编辑:苏爱华
英文编辑:罗 维
Establishment and optimization of a regeneration system for Miscanthus sinensis
HUANG Li-fang1, YIN Xu-ming1, CHEN Zhi-yong2, XIAO Liang2, YI Zi-li2*
(1.Key Laboratory of Agro-ecological Processes in Subtropical Region, Institute of Subtropical Agriculture Chinese Academy of Sciences, Changsha 410125, China; 2.College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha 410128, China)
The rapid propagation system was established using the spike of Miscanthus sinensis as material through explants sterilization, adventitious bud differentiation and multiplication, rooting and transplanting acclimation. The results showed that the optimal medium for callus induction was MS+ 4.0 mg/L 2,4–D + 1.0 mg/L 6–BA + 0.5 mg/L CuSO4, with which the induction frequency reached 99.33%. Best adventitious bud differentiation and multiplying medium was MS+ 1.0 mg/L 6–BA + 0.4 mg/L NAA + 0.4 mg/L IAA and MS+ 3.0 mg/L 6–BA + 1.5 mg/L PP333+ 1.0 mg/L CCC, with which the differentiation rate was 96% and the multiplying coefficient was 9.1. The best medium for rooting induction was MS+ 0.5 mg/L IAA + 0.5 mg/L NAA + 0.5 mg/L CCC + 0.5 mg/L PP333, with which the rooting rate was 100%. The regenerated plantlets grew well on the matrix consisting of loess and nutrition soil, and the survival rate was as high as 95%.
Miscanthus sinensis; energy plant; in vitro culture; orthogonal design; variance analysis
10.13331/j.cnki.jhau.2014.06.004
投稿网址:http://www.hunau.net/qks
S543+.9
A
1007−1032(2014)06−0583−06
芒(Miscanthus sinensis)系禾本科(Poaceae)芒属(Miscanthus)的一种 C4多年生高大草本植物,俗称“芒草”,主要分布于东亚和东南亚地区。因芒具有生物质产量大[1–2]、纤维素含量高[3]、灰分含量低[4]、燃烧值高[5]、生态适应性强[6]、栽培成本低等优点,而被公认为是一种极具开发潜力的新型能源植物。早在20世纪90年代,欧美地区一些国家将从日本引进的一种芒草(M. giganteus)作为首选能源植物开展了一系列研究,并推出了能源芒草商业品种[7–8]。中国是芒草的自然分布中心,从北纬 18°~43°,东经97°~126°都有芒草生长,其种质资源极为丰富。近年来,中国也已启动了能源芒草的研发工作,在种质资源评价与筛选[9–10]、遗传多样性分析[11–14]、品种培育与改良[15–16]等方面都已开展了研究,但有关种苗繁殖技术的研究尚少见报道。由于芒草是一种异交植物,种子苗遗传分离大,出苗率低,其自然繁殖多以无性繁殖为主,种苗繁殖已成为制约芒草大规模人工栽培的一个瓶颈问题,因此,建立其体细胞大规模离体快繁技术体系,是满足能源芒草产业化应用种苗需求的有效途径。
2014–04–08
国家“ 863”课题(2011AA10020901);美国孟德尔生物技术公司合作项目( SR0373)
黄丽芳(1976—),女,回族,湖南中方人,硕士,助理研究员,主要从事生物新能源品种选育与栽培技术研究,hlf20060829@ 163.com;*通信作者, yizili889@163.com
