急性髓系白血病患者骨髓WT1基因的表达与预后的关系
2014-08-31万鼎铭边志磊刘延方曹伟杰何海燕玄中乾
万鼎铭,边志磊,刘延方,曹伟杰,张 媛,李 涛,何海燕,玄中乾
1)郑州大学第一附属医院血液科 郑州 450052 2)新乡医学院第一附属医院血液科 新乡 453100 3) 郑州大学血液病研究所 郑州 450052△男,1963年5月生,博士,教授,主任医师,研究方向:血液病和造血干细胞移植的基础和临床,E-mail:wwddmm@vip.sina.com
急性髓系白血病患者骨髓WT1基因的表达与预后的关系
万鼎铭1)△,边志磊1),刘延方1),曹伟杰1),张 媛2),李 涛1,3),何海燕1),玄中乾1)
1)郑州大学第一附属医院血液科 郑州 450052 2)新乡医学院第一附属医院血液科 新乡 453100 3) 郑州大学血液病研究所 郑州 450052△男,1963年5月生,博士,教授,主任医师,研究方向:血液病和造血干细胞移植的基础和临床,E-mail:wwddmm@vip.sina.com
急性髓系白血病;WT1基因;预后
目的:探讨急性髓系白血病(AML)患者骨髓WT1基因的表达与预后的关系。方法应用实时定量逆转录PCR方法检测122例初诊AML患者骨髓WT1基因的表达水平,并进行初次诱导化疗缓解率(CR1)及2 a无白血病生存率(LFS)和总生存率(OS)的分析。对照组为21例非白血病患者或造血干细胞移植健康供者。结果对照组骨髓WT1基因表达水平为0.007(0.002,0.080);AML组为0.677(0.336,0.763),明显高于对照组(Z=2.620,P<0.001)。AML-M3患者WT1基因高表达组与低表达组CR1、2 a LFS和OS无差异。AML(非M3)患者WT1基因低表达组CR1为82.6%(38/46),高表达组为52.3%(23/44),两组比较,差异有统计学意义(χ2=9.476,P=0.002);两组的总生存曲线和无白血病生存曲线差异有统计学意义(χ2=5.410、4.698,P<0.05),高表达组2 a OS(36.0%)和LFS(33.3%)均低于低表达组(57.7%和53.7%)。结论骨髓WT1基因表达水平是预测AML预后的有效监测指标。
急性髓系白血病(acute myeloid leukemia,AML)是一类高度异质性疾病,不同亚型甚至同一亚型仍可能有不同的长期预后[1]。如何准确地作出预后分层,进而提供更加具有针对性和个体化的治疗方案,从而提高整体长期生存率,是AML治疗中最热门也是最棘手的问题之一。实时定量逆转录PCR(RQ-RT-PCR)是应用荧光探针结合逆转录PCR方法动态监测封闭试管内mRNA水平变化,与流式细胞术相比,具有更高的敏感性和特异性。该方法用于特定融合基因或突变基因的检测已相当成熟,广泛应用于AML的预后分层及复发预测[2-3]。然而大部分AML患者并不存在特异的遗传学或分子学标记,因此需要寻找新的泛白血病监测指标。WT1基因的过表达存在于多种恶性血液疾病,已成为监测AML微小残留病灶的敏感指标[4-7],但WT1基因与AML长期预后的关系还存在争议[8-9]。作者通过监测初诊AML患者骨髓WT1基因表达水平,并分析其与初次诱导化疗缓解率(the complete remission rate after the first induction chemotherapy,CR1)及2 a无白血病生存率(leukemia-free survival rate,LFS)和2 a总生存率(overall survival rate,OS)的关系,探讨其在AML预后分层和复发预测中的意义。
1 对象与方法
1.1研究对象选取郑州大学第一附属医院血液科2010年1月至2012年1月门诊或住院收治的AML患者122例,男68例,女54例,年龄16~70岁,中位年龄54岁。白血病的诊断均经临床症状、血常规、骨髓细胞学及组织化学染色、免疫分型、染色体核型分析确诊,部分患者行融合基因检测,符合白血病形态学、免疫学、细胞遗传学及分子学(MICM)诊断标准。122例患者同时经FAB分型,其中M0型3例,M1型5例,M2型53例,M3型32例, M4型14例, M5型15例。患者及家属均同意接受规范方案治疗。对照组21例,为同期就诊的非白血病(过敏性紫癜、缺铁性贫血、免疫性血小板减少性紫癜、巨幼细胞性贫血)患者及造血干细胞移植健康供者。
1.2治疗方案及疗效标准AML-M3治疗方法参照《急性早幼粒细胞白血病中国诊疗指南(2011年版)》[10]。AML(非M3)治疗方法参照《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2011年版)》[11],应用标准量“DA”或“IA”方案作为初治诱导缓解方案,其后根据预后分层制定相应治疗方案。根据1987年全国白血病化疗讨论会制定的白血病疗效评价标准,以骨髓细胞形态学检测幼稚细胞比例≥0.05,或存在且病理活检证实髓外浸润作为复发及未缓解标准。随访时间1~36个月,中位随访时间21个月。
1.3观察指标CR1:根据初次诱导化疗后3周骨髓细胞学检查结果,以骨髓细胞形态学幼稚细胞<0.05且无髓外浸润为化疗缓解标准,计算化疗缓解率。 2 a LFS:2 a观察期内无白血病复发生存的概率,以复发为终点事件。2 a OS:2 a观察期内的总生存率,以死亡为终点事件。
1.4WT1基因的检测
1.4.1 总RNA的提取和逆转录反应 无菌条件下常规抽取对照组及AML患者治疗前骨髓1~2 mL,0.5 mol/L EDTA抗凝,用常规Trizol方法提取总RNA,紫外分光光度计定量,-80 ℃冻存。逆转录反应采用TaKaRa逆转录试剂盒,按说明书操作。
1.4.2 引物和探针的设计、合成 引物及探针序列根据GenBank基因序列自行设计,由上海Invitrogen公司合成。WT1上游引物为5’-CAGGCTGCAATA AGAGATATTTTAAGCT-3’,下游为5’-GAAGTCA CACTGGTATGGTTTCTCA-3’,扩增片段大小为120 bp;探针序列为5’-CTTACAGATGCACAGCAGGAAG CACACTG-3’,5’端标记荧光发光基团,3’端标记荧光淬灭基团。内参ABL基因上游引物为5’-TG GAGATAACACTCTAAGCATAACTAAAGGT-3’,下游为5’-GATGTAGTTGCTTGGGACCCA-3’;探针序列为5’-CCATTTTTGGTTTGGGTTCACACCATT-3’。
1.4.3 阳性标准品的制备 从K562细胞(由郑州大学干细胞中心提供)中提取总RNA,逆转录获得cDNA后,在PE9700 PCR仪上进行扩增。扩增条件:95 ℃ 40 s,60 ℃ 30 s,72 ℃ 50 s, 35个循环。扩增产物经20 g/L琼脂糖凝胶电泳,凝胶切割、回收并纯化,连结到PUCm-T质粒,克隆后测序,证明连接产物为WT1基因片段。重组质粒体外克隆后混匀、紫外分光光度计定量,稀释为104~106拷贝数,-20 ℃保存备用。同法制备内参基因阳性标准品。
1.4.4 荧光定量PCR 总反应体系20 μL:包括Premia Ex TaqTM 10 μL,上游引物0.4 μL,下游引物0.4 μL,荧光探针0.8 μL,cDNA模版溶液2 μL,灭菌去离子水6.4 μL。反应程序:第一步42 ℃ 30 min,第二步94 ℃ 5 min,第三步94 ℃ 45 s,第四步60 ℃ 80 s,重复第三步到第四步40个循环。每批实验均设立阴性及阳性对照。以WT1与内参ABL绝对拷贝数之比作为WT1基因的表达水平。
1.5统计学处理采用SPSS 19.0进行数据分析。WT1基因表达水平呈非正态分布,用中位数(下,上四分位数)描述,采用Kaplan-Meier法绘制生存曲线,计算2 a LFS和2 a OS,并进行log-rank检验。检验水准α=0.05。
2 结果
2.1AML患者骨髓WT1基因的表达对照组骨髓WT1基因表达水平为0.007(0.002,0.080);AML组为0.677(0.336,0.763),明显高于对照组(Z=2.620,P<0.001)。不同临床特征AML患者骨髓WT1基因的表达水平见表1。

表1 不同临床特征AML患者骨髓WT1基因的表达
2.2AML-M3患者WT1基因表达水平与预后的关系32例AML-M3患者在观察期内,除4例初次诱导治疗中出现颅内出血死亡,余28例均初治诱导达完全缓解,且该28例在观察期内无复发及死亡发生。以WT1基因表达水平中位数0.853为界,<0.853为WT1低表达,≥0.853为高表达,则这28例患者在观察期内,WT1基因高表达组与低表达组CR1、2 a LFS和OS相同。
2.3AML(非M3)患者WT1基因表达水平与预后的关系AML(非M3)患者90例,以 WT1基因表达水平中位数0.583为界,<0.583为WT1基因低表达,≥0.583为高表达。低表达组CR1为82.6%(38/46),高表达组为52.3%(23/44),差异有统计学意义(χ2=9.476,P=0.002)。两组的2 a总生存曲线和无白血病生存曲线(图1)差异有统计学意义(χ2=5.410,P=0.020;χ2=4.698,P=0.030)。高表达组2 a OS(36.0%)和LFS(33.3%)均低于低表达组(57.7%和53.7%)。
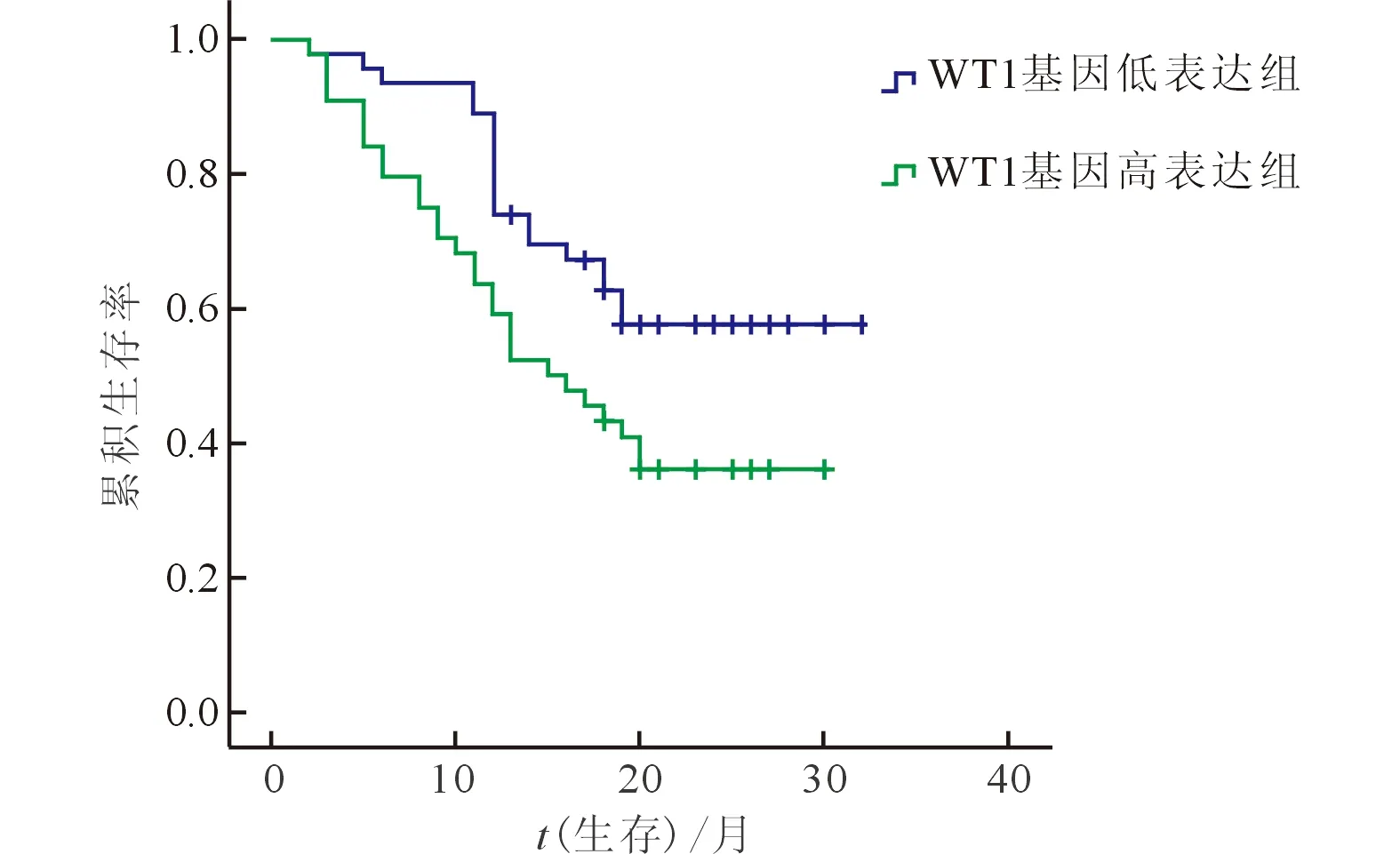
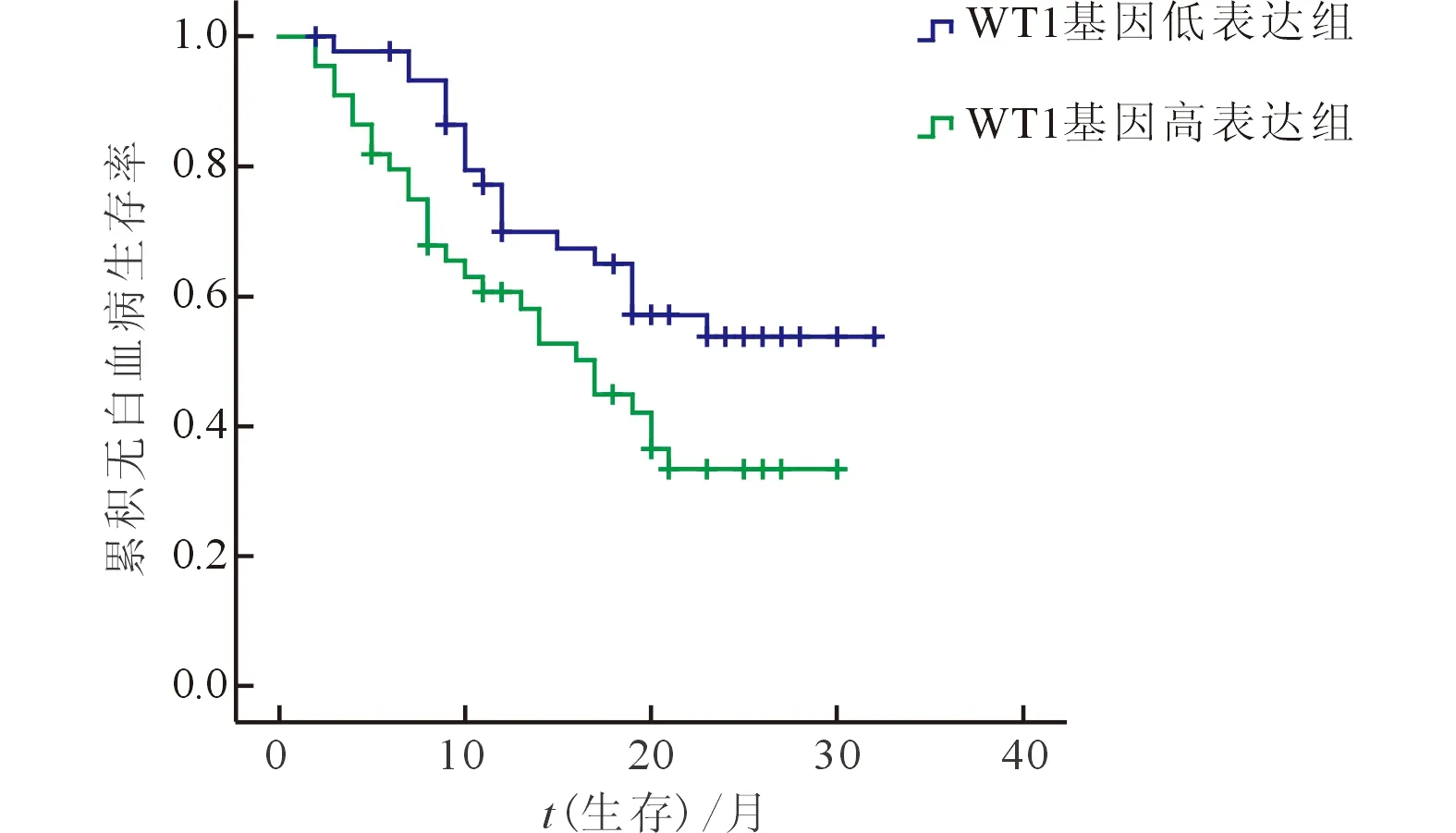
图1 WT1基因高、低表达组的生存曲线
3 讨论
WT1基因最早以抑癌基因被发现于肾母细胞瘤中,该基因位于11p13,编码一种锌指蛋白类的转录因子。AML中WT1基因异常过度表达已被国内外多中心研究所证实[5-6],这也是WT1基因作为AML预后分层和复发预测的分子学标记的理论基础。用WT1基因预测AML短期复发的灵敏性和特异性均优于传统的流式细胞术方法[12],但WT1基因与AML长期预后的关系还存在争议[8-9]。此次研究通过比较AML患者骨髓WT1基因高表达组与低表达组间CR1、2 a LFS和OS的差异,探讨该基因对AML长期预后的预测作用。结果显示,WT1基因高表达的AML(非M3)患者组CR1、2 a LFS和OS均低于WT1基因低表达组,这与国外Nomdedeu等[8]的研究结果一致,但与Miglino等[9]的研究结果相悖,可能与病例数、分层及治疗方案的不同有关。同时作者还发现AML-M3患者骨髓WT1基因表达水平与患者的预后并没有相关性,这可能与该亚型的靶向治疗药物全反式维甲酸和三氧化二砷的应用有关[13]。靶向治疗药物出现后AML-M3患者的长期生存率明显提高,因此成为在AML预后分层中相对独立的一个亚型。目前WT1基因在AML中过表达的机制尚不清楚,现主要考虑有WT1基因启动子去甲基化、GATA等转录因子的过度激活、WT1基因突变等[14-15]。WT1基因表达水平与AML-M3患者的预后没有相关性这一结果也从一个侧面证明WT1基因的高表达并不是该疾病发病的始动因素,可能是由于信号传导通路中相关转录因子的改变影响了该基因的表达状态,并进一步影响了下游基因的表达。
此次回顾性研究观察时间1~3 a,相信随着样本数量的增加及观察时间的延长,WT1基因与AML患者预后的关系会更明确。虽尚不能完全了解AML患者WT1基因过度表达的具体机制,但该基因在AML预后分层、微小残留病灶监测甚至治疗中的作用将会越来越重要。该研究中WT1基因高表达组及低表达组均采用标准预后分层及治疗分案[10-11],在下一步治疗中如果采用加入WT1基因的预后分层系统,根据预后分层采取不同的治疗分案,相信能获得更好的长期生存率。另外与WT1基因相关的肿瘤疫苗[16]已在研制过程中,相信随着研究的进一步深入,以WT1基因作为治疗靶点的基因工程药物也会越来越多。
[1]Estey EH.Acute myeloid leukemia:2013 update on risk-stratification and management[J].Am J Hematol,2013,88(4):318
[2]Szanto A,Pap Z,Benedek I,et al.Monitoring M-BCR-ABL expression level in CML patients by RQ-PCR:experience of a single center[J].Rom J Morphol Embryol,2013,54(1):37
[3]Zapparoli GV,Jorissen RN,Hewitt CA,et al.Quantitative threefold allele-specific PCR (QuanTAS-PCR) for highly sensitive JAK2 V617F mutant allele detection[J].BMC Cancer,2013,13:206
[4]Zhao XS,Yan CH,Liu DH,et al.Combined use of WT1 and flow cytometry monitoring can promote sensitivity of predicting relapse after allogeneic HSCT without affecting specificity[J].Ann Hematol,2013,92(8):1111
[5]秦亚溱,阮国瑞,李金兰,等.定量检测WT1基因表达水平在急性髓系白血病微量残留病监测中的意义[J].中华血液学杂志,2005,26(11):649
[6]Yoon JH,Kim HJ,Shin SH,et al.Serial measurement of WT1 expression and decrement ratio until hematopoietic cell transplantation as a marker of residual disease in patients with cytogenetically normal acute myelogenous leukemia[J].Biol Blood Marrow Transplant,2013,19(6):958
[7]Kramarzova K,Boublikova L,Stary J,et al.Evaluation of WT1 expression in bone marrow vs peripheral blood samples of children with acute myeloid leukemia-impact on minimal residual disease detection[J].Leukemia,2013,27(5):1194
[8]Nomdedeu JF,Hoyos M,Carricondo M,et al.Bone marrow WT1 levels at diagnosis, post-induction and post-intensification in adult de novo AML[J].Leukemia,2013,27(11):2157
[9]Miglino M,Colombo N,Pica G,et al.WT1 overexpression at diagnosis may predict favorable outcome in patients with de novo non-M3 acute myeloid leukemia[J].Leuk Lymphoma,2011,52(10):1961
[10]中华医学会血液学分会.急性早幼粒细胞白血病中国诊疗指南(2011年版)[J].中华血液学杂志,2011,32(12):885
[11]中华医学会血液学分会.成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2011年版)[J].中华血液学杂志,2011,32(11):804
[12]Fang M,Storer B,Wood B,et al.Prognostic impact of discordant results from cytogenetics and flow cytometry in patients with acute myeloid leukemia undergoing hematopoietic cell transplantation[J].Cancer,2012,118(9):2411
[13]郭学军,李凤菊,林晓燕,等.急性早幼粒细胞白血病患者完全缓解后小剂量砷剂加全反式维甲酸治疗18例[J].郑州大学学报:医学版,2006,41(3):597
[14]Goodfellow SJ,Rebello MR,Toska E,et al.WT1 and its transcriptional cofactor BASP1 redirect the differentiation pathway of an established blood cell line[J].Biochem J,2011,435(1):113
[15]Subbiah V,Brown RE,Jiang Y,et al.Morphoproteomic profiling of the mammalian target of rapamycin (mTOR) signaling pathway in desmoplastic small round cell tumor (EWS/WT1), Ewing’s sarcoma (EWS/FLI1) and Wilms’ tumor(WT1)[J].PLoS One,2013,8(7):e68985
[16]Sugiyama H.WT1-targeting cancer vaccine[J].Nihon Rinsho,2012,70(12):2105
(2013-10-11收稿 责任编辑王 曼)
Prognostic value of WT1 expression in bone marrow for acute myeloid leukemia
WANDingming1),BIANZhilei1),LIUYanfang1),CAOWeijie1),ZHANGYuan2),LITao1,3),HEHaiyan1),XUANZhongqian1)
1)DepartmentofHematology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
2)DepartmentofHematology,theFirstAffiliatedHospital,XinxiangMedicalUniversity,Xinxiang453100
3)InstituteofHematology,ZhengzhouUniversity,Zhengzhou450052
acute myeloid leukemia;WT1 gene;prognosis
Aim: To investigate the relationship between WT1 gene expression level in bone marrow of acute myeloid leukemia (AML) patients and the prognosis. Methods: A total of 122 newly diagnosed AML patients were subjected to detect WT1 expression level in bone marrow by real time quantitative reverse transcription-PCR method,and the complete remission rate after the first induction chemotherapy(CR1), two-year leukemia-free survival rate(LFS) and two-year overall survival rate (OS) were calculated.A total of 21 cases of non-AML were the control.Results: The median expression level of WT1 in AML patients was 0.677(0.336,0.763), which was higher than that of control[0.007(0.002,0.080),Z=2.620,P<0.001]. With regard to AML-M3 patients,CR1, two-year LFS and OS of the patients with high expression level of WT1 was similar to those of the patients with low expression level of WT1.With regard to non AML-M3 patients, CR1 in the high WT1 expression group was 52.3%, lower than that of 82.6% in the low WT1 expression group(χ2=9.476,P=0.002);the two-year leukemia-free survival curve and overall survival curve of high WT1 expression patients differed from those of low WT1 expression patients(χ2=4.698,5.410,P<0.05),and two-year LFS and OS of high WT1 expression patients were 33.3% and 36.0%,lower than 53.7% and 57.7% of the low WT1 expression patients.Conclusion: WT1 expression level in bone marrow could be an useful prognosis marker for AML patients.
10.13705/j.issn.1671-6825.2014.03.027
R557.3
