脂质体紫杉醇联合顺铂对晚期宫颈癌术前化疗的疗效观察
2014-08-28,,,
,, ,
(重庆医科大学附属永川医院妇产科,重庆 永川 402160)
宫颈癌是女性最常见的恶性肿瘤,已成为威胁广大女性身体健康和生命安全的主要元凶之一。根据流行病学调查的结果显示,初潮年龄较小、初次性生活年龄较小、早育、多胎、性生活频繁或紊乱、人类乳头瘤病毒感染等都是女性宫颈部位癌变的独立危险因素[1-2]。由于宫颈癌发病的早期和发展阶段几乎没有任何明显及特异的临床症状,所以一旦发现阴道接触性流血大多已经是宫颈癌晚期。目前,尽管宫颈癌的诊治有了长足的进步和发展,然而化疗药物和化疗方案的种类纷繁众多,医学界对于宫颈癌根治术前的最佳化疗方案尚无统一认识[3]。因此,为比较目前临床上常用宫颈癌术前化疗方案的临床疗效和不良反应的差异,本研究将2005年5月至2009年5月我院妇产科收治的晚期局部宫颈癌患者78例,随机分组进行了脂质体紫杉醇联合顺铂和顺铂联合5-氟尿嘧啶的宫颈癌根治术前化疗,现总结报告如下。
1 资料与方法
1.1 临床资料
本组患者78例,年龄60~71岁,平均(65.3±4.9)岁。本研究获得我院伦理委员会批准,所有入选患者均签署知情同意书,均符合晚期宫颈癌的临床诊断标准[4],且术中或术后经过病理报告复核诊断。按就诊顺序将患者分为顺铂联合5-氟尿嘧啶化疗组(PF组,39例)和脂质体紫杉醇联合顺铂化疗组(Taxol组,39例)。78例宫颈癌患者于入院后完善病史采集、体格检查和实验室相关检查,进一步排除宫颈癌远处转移可能,并排除内脏器官功能异常和患有其他全身性疾病的患者。PF组和Taxol组患者在年龄、病情轻重程度和临床表现等方面比较无统计学差异(P>0.05),2组患者具有可比性。
1.2 化疗方案
1.2.1 脂质体紫杉醇联合顺铂化疗方案 首先给予患者60 mg/m2或135 mg/m2脂质体紫杉醇连续静脉滴注3 h,然后给予顺铂60 mg/m2,每隔2 周进行1次化疗,连续2个疗程。每次化疗使用脂质体紫杉醇前6 h和12 h嘱患者口服20 mg地塞米松,脂质体紫杉醇化疗前30 min再给予静注300 mg西咪替丁和肌注50 mg苯海拉明处理。化疗过程中出现不良反应应对症处理。
1.2.2 顺铂联合5-氟尿嘧啶化疗方案 首先给予患者30 mg/m2或40 mg/m2顺铂静脉滴注,随后给予5-氟尿嘧啶500 mg/m2静脉滴注,每隔1 周进行1次化疗,连续4个疗程。其他处理同脂质体紫杉醇联合顺铂化疗方案组。
1.3 手术方法
2组患者均在化疗结束后2~4 周行全麻下广泛全子宫附件切除术和盆腔淋巴结清扫术:在全麻或硬膜外麻醉下施行手术;借助阴道拉钩,在阴道穹隆顶处切开阴道黏膜,分离子宫直肠间隙、子宫膀胱间隙及两侧直肠侧窝;于近盆腔壁侧行钳夹、切断、缝扎双侧骶韧带;然后吻合阴道断端;分别清扫双侧髂总、髂内、髂外、闭孔、腹股沟浅及腹股沟深等各组淋巴结,部分患者行腹主动脉旁淋巴结清扫术[5]。所有患者均于术中或术后送病理活检复核宫颈癌诊断。
1.4 临床疗效评价
2组患者化疗后不良反应根据WHO抗癌药物不良反应分级标准[6]评定为:0、Ⅰ、Ⅱ、Ⅲ和Ⅳ级。疗效评价依据WHO标准[7]分为:①完全缓解(CR),肿瘤完全消失并维持至少4周以上;②部分缓解(PR),肿瘤缩小50%以上并维持至少4周以上;③稳定(SD),肿瘤增大或缩小不超过25%并且没出现新发病灶;④进展(PD),肿瘤增大超过25%或者出现新发病灶。总有效率为完全缓解率和部分缓解率之和。
1.5 统计学处理
2 结果
2.1 患者不良反应比较
2组患者的化疗不良反应主要有骨髓抑制、消化道反应、口腔黏膜炎、脱发、肾脏毒性和过敏反应。由于化疗方案的不同,2组患者不良反应构成比也不尽相同。PF组患者不良反应主要为消化道反应、口腔黏膜炎和骨髓抑制,而Taxol组患者的不良反应主要集中在骨髓抑制、口腔黏膜炎和肾脏毒性,具体数据见表1。2种化疗方案患者化疗期间骨髓抑制发生率都较高,但是化疗结束后1 周2组患者骨髓抑制情况却不尽相同。PF组患者主要表现为白细胞抑制,而Taxol组患者则表现为粒细胞抑制;此外,还表现出不同程度的血红蛋白抑制和血小板抑制,具体数据见表2。
2.2 患者的临床疗效观察
Taxol组患者完全缓解率达到了30.77%(12/39),显著高于PF组的10.26%(4/39)(χ2=5.032,P=0.025)。Taxol组和PF组患者化疗总有效率分别达到了56.41%(22/39)和46.15%(18/39),见表3。
2.3 患者的生存率比较
Taxol组和PF组患者平均生存时间分别是33.5个月和34.7个月,3年生存率分别为59.6%和70.2%,差异无统计学意义(χ2=1.859,P=0.173),见图1。
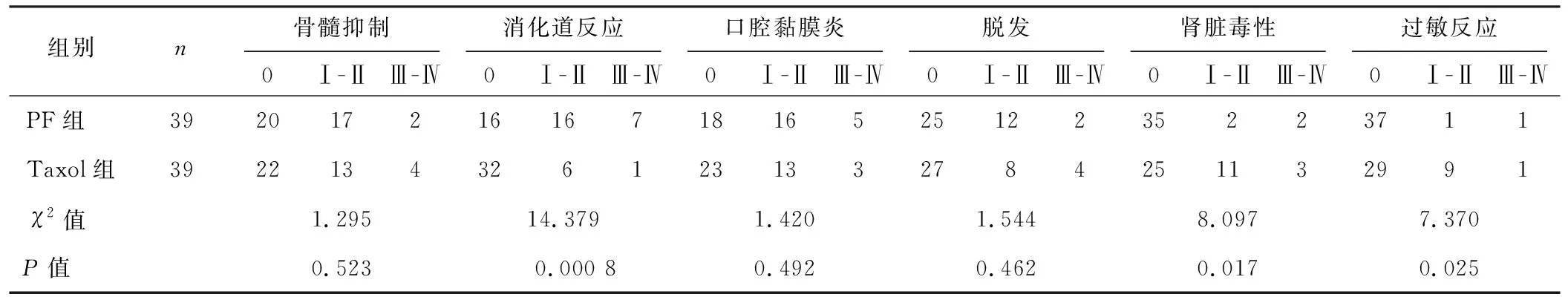
表1 2组患者化疗期间不良反应情况(例)

表2 2组患者化疗期间骨髓抑制情况

表3 2组患者临床疗效比较(n=39,例)
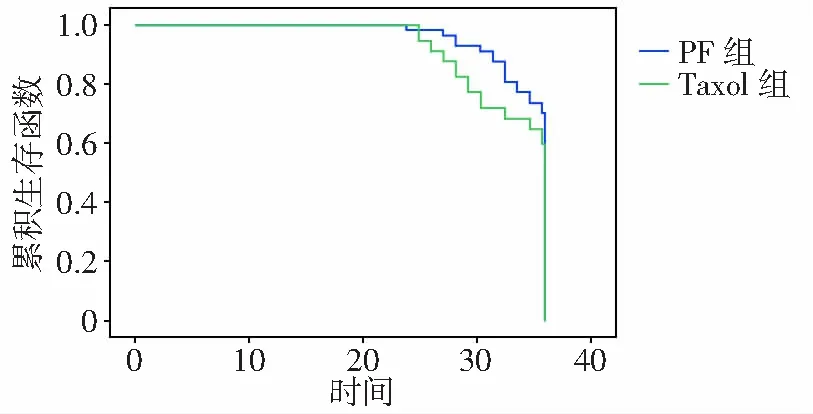
图1 2组患者3年生存率比较
3 讨论
自从1983年Friedlander等[8]首次报道了采用顺铂、长春碱和博来霉素等对宫颈癌患者进行化疗的研究,从而将宫颈癌重新定义为一种适用于化疗的恶性肿瘤。对于具有组织学上分化较差、局部晚期宫颈癌、肿瘤病理类型特殊以及具有宫颈癌家族史等不良预后危险因素的患者来说,手术治疗前的化疗就显得特别重要[9]。目前临床上用于宫颈癌化疗的药物仍层出不穷,宫颈癌的化疗方案也纷繁众多。医学界对于宫颈癌患者术前的最佳化疗方案仍然缺乏共识,化疗效果有限、不良反应严重、化疗药物有效剂量与有害剂量之间安全阈值较窄等都是制约某些对于其他肿瘤化疗疗效理想的方案应用于宫颈癌术前化疗的主要因素[10-12]。当前,顺铂联合5-氟尿嘧啶以及顺铂联合脂质体紫杉醇都是临床上较为常用的局部晚期宫颈癌术前化疗方案。本组资料显示2种化疗方案的不良反应构成存在差异,顺铂联合5-氟尿嘧啶化疗组的不良反应主要有消化道反应、口腔黏膜炎和骨髓抑制,而顺铂联合脂质体紫杉醇化疗组的不良反应主要表现为骨髓抑制、口腔黏膜炎和肾脏毒性。此外,过敏反应也是顺铂联合脂质体紫杉醇化疗方案中不可忽视的不良反应之一。骨髓抑制在2种化疗方案中具有较高的发生率,但是顺铂联合5-氟尿嘧啶化疗组的骨髓抑制主要体现在白细胞抑制方面,而顺铂联合脂质体紫杉醇化疗组的骨髓抑制主要表现为粒细胞抑制。
紫杉醇是一种来源于红豆杉科植物提取物的常用化疗药物[13]。在卵巢癌和乳腺癌的临床治疗中应用较为广泛;在宫颈癌的治疗中,尤其是在晚期宫颈癌的术前化疗中的应用时间相对较短。紫杉醇类化疗药物的主要抗癌机理是通过促进肿瘤细胞的细胞骨架成分β-微管蛋白的聚合,抑制β-微管蛋白的解聚,从而将肿瘤细胞“阻滞”在细胞有丝分裂间期,进一步达到引起肿瘤细胞死亡而治疗癌症的效果[14]。经过一段时间的临床实践,目前认为紫杉醇联合顺铂辅助化疗局部晚期宫颈癌患者能够达到缩小肿瘤体积、抑制肿瘤生长和转移、创造手术条件和机会、减少肿瘤复发的作用[15]。紫杉醇水溶性较差,易溶于有机溶剂,临床化疗时通常将紫杉醇溶解于聚氧乙烯蓖麻油进行静脉滴注。然而,无论是紫杉醇化疗前常规使用的大剂量地塞米松,还是紫杉醇溶剂聚氧乙烯蓖麻油本身都极易引起化疗患者不同程度的过敏反应。因此,过敏反应也是限制紫杉醇临床化疗应用的一大瓶颈。随着肿瘤药剂学和分子药理学的研究取得突破和进展,脂质体紫杉醇作为一种紫杉醇的特殊剂型被推广到临床应用阶段。脂质体紫杉醇是将脂质体作为紫杉醇的特殊载体,紫杉醇被包封在脂质体双分子层结构当中。与单纯紫杉醇相比,脂质体紫杉醇不仅改善了紫杉醇的溶解性,使之更容易透过肿瘤细胞细胞膜的脂质双分子层结构进入肿瘤细胞内部发挥治疗效应,而且降低了药物的毒副作用、延长了药物的代谢半衰期、一定程度上提高了紫杉醇的化疗靶向性[16]。本研究中,虽然在顺铂联合脂质体紫杉醇化疗组仍旧出现了10例过敏反应,但是仅有1例为Ⅲ型不良反应;并且所有出现过敏反应的患者经过对症支持处理后能够耐受,继续完成了化疗方案。在考虑紫杉醇剂型、剂量、疗程和化疗人群种属差异性的基础上,与类似本研究所报道的紫杉醇化疗所致过敏反应的发生率相比,低了2.55%。因此,脂质体紫杉醇是一种既安全有效又能够被患者临床耐受的化疗药物。
[参考文献]
[1] Huang L,Zheng M,Zhou QM,et al.Identification of a 7-gene signature that predicts relapse and survival for early stage patients with cervical carcinoma[J].Med Oncol,2012,29(4):2911-2918.
[2] Beriwal S,Kannan N,Sukumvanich P,et al.Complete metabolic response after definitive radiation therapy for cervical cancer:patterns and factors predicting for recurrence[J].Gynecol Oncol,2012,127(2):303-306.
[3] Moreno-Acosta P,Gamboa O,Sanchez de Gomez M,et al.IGF1R gene expression as a predictive marker of response to ionizing radiation for patients with locally advanced HPV16-positive cervical cancer[J].Anticancer Res,2012,32(10):4319-4325.
[4] 2010年NCCN宫颈癌临床实践指南(中国版)[M].2010:M5-7,MS-9.
[5] 王慧霞.宫颈癌患者腹腔镜下广泛子宫切除及盆腔淋巴结清扫术临床疗效分析[J]. 中国老年学杂志,2011,31(24):4785-4786.
[6] Bjelic-Radisic V,Jensen PT,Vlasic KK,et al.Quality of life characteristics inpatients with cervical cancer[J].Eur J Cancer,2012,48(16):3009-3018.
[7] Wamai RG,Ayissi CA,Oduwo GO,et al.Assessing the effectiveness of a community-based sensitization strategy in creating awareness about HPV,cervical cancer and HPV vaccine among parents in North West Cameroon[J].J Community Health,2012,37(5):917-926.
[8] Friedlander M,Kaye SB,Sullivan A,et al.Cervical carcinoma:a drug-responsive tumor--experience with combined cisplatin,vinblastine,and bleomycin therapy[J].Gynecol Oncol,1983,16(2):275-281.
[9] Angioli R,Plotti F,Montera R,et al.Neoadjuvant chemotherapy plus radical surgery followed by chemotherapy in locally advanced cervical cancer[J].Gynecol Oncol,2012,127(2):290-296.
[10] Furusaka T,Asakawa T,Tanaka A,et al.Efficacy of multidrug superselective intra-arterial chemotherapy (docetaxel,cisplatin,and 5-fluorouracil) using the Seldinger technique for tongue cancer[J].Acta Otolaryngol,2012,132(10):1108-1114.
[11] Mabuchi S,Okazawa M,Matsuo K,et al.Impact of histological subtype on survival of patients with surgically-treated stage IA2-IIB cervical cancer:adenocarcinoma versus squamous cell carcinoma[J].Gynecol Oncol,2012,127(1):114-120.
[12] Morice P,Uzan C,Leary A.Are the outcomes of neoadjuvant chemotherapy for stage IB2 cervical cancer similar in pregnant and nonpregnant patient?[J].Gynecol Oncol,2012,127(1):257-258.
[13] Fruscio R,Mangioni C,Milani R.Reply to:Are the outcomes of neoadjuvant chemotherapy for stage Ib2 cervical cancer similar in pregnant and nonpregnant patients [J].Gynecol Oncol,2012,127(1):258-259.
[14] Pak D,Vineberg K,Feng F,et al.Lhermitte sign after chemo-IMRT of head-and-neck cancer:incidence,doses,and potential mechanisms[J].Int J Radiat Oncol Biol Phys,2012,83(5):1528-1533.
[15] Kulshrestha P,Gogoi M,Bahadur D,et al.In vitro application of paclitaxel loaded magnetoliposomes for combined chemotherapy and hyperthermia[J].Colloids Surf B Biointerfaces,2012,96:1-7.
[16] Chen F,Dong D,Fu Y,et al.Anti-tumor activity of biodegradable polymer-paclitaxel conjugate micelles on lewis lung cancer mice models[J].Chemical research in chinese universitties,2012,28(4):656-661.
