浅谈发酵工艺中溶氧浓度光学检测的技术应用
2014-08-27宋有星
宋有星 辛 亮
(山东鸿基换热技术有限公司,山东济南250022)
0 引言
溶解氧(DissolvedOxygen,简称DO)是指溶解在水或发酵液中的氧,溶解氧以分子状态存在于水或发酵液中。
水中溶解氧的含量受到2种作用的影响:一种是使DO下降的耗氧作用,包括耗氧有机物降解的耗氧和生物呼吸耗氧;另一种是使DO增加的复氧作用,主要有空气中氧的溶解、水生植物的光合作用等。这2种作用的相互消长,使水中溶解氧的含量呈现出时空变化。
微生物发酵是指利用微生物在适宜的条件下,将原料经过特定的代谢途径转化为人类所需要的产物的过程。微生物发酵生产水平主要取决于菌种本身的遗传特性和培养条件。
微生物细胞在发酵过程中要进行上百个酶反应,并受到多种工艺参数的影响,因此发酵过程非常复杂,其若要实现药品质量的过程控制较化学合成方式要复杂得多。但随着对菌体的培养规律、菌体对环境条件的要求和代谢变化规律的创新研究,以及过程检测技术的长足进步,通过适时检测控制发酵条件和微生物细胞代谢变化有关的各项工艺参数,可检测与控制整个发酵过程,使菌种的代谢变化按照所需要的条件进展,以达到预期目的。
微生物发酵中各工艺参数的过程检测与控制对于微生物的生长和产物形成有着重要的影响,需要进行过程检测的有温度、压力、空气流量(需氧发酵的参数控制,影响氧或其他参数的传递)、浊度(适时反映细胞生长的状态)、pH值(依据试验条件获取的最适宜的pH值作为参照进行适时检测与调控)、浓度(适时检测发酵液中糖、氮等重要营养物质的浓度以及菌体或目标物浓度)、溶氧量(需氧菌发酵的必备条件和重要参数)等数10种工艺参数。
发酵液中的溶氧浓度是需氧菌发酵的必备条件和重要参数,发酵液的DO值对菌体生长、目标物的性质和产量都会产生不同影响,通过发酵液中溶氧量的变化,可以了解微生物生长代谢是否正常、工艺控制是否合理、设备供氧能力是否正常等,因此溶氧浓度是生物产品质量过程控制的重要参数之一。
1 溶氧量控制的作用
溶解氧是发酵过程中至关重要的一个参数指标,控制溶解氧的目的是把溶解氧浓度值稳定在一定的期望值或范围内。对这些参数进行精确、实时在线测量是实现溶解氧自动控制的一个基本前提。
发酵中因受到生物反应器中多种物理、化学和微生物因素的影响和制约,溶解氧浓度与其他工艺参数的关系也变得极为复杂。在生物反应器内的质量传递主要为气-液传递和液-固传递。气-液传递主要是好氧发酵过程中的氧传递以及二氧化碳的释放,而液-固传递主要发生于反应系统中含固定化酶、固定化细胞、生物膜、絮凝细胞的过程。
大多数微生物发酵过程为好氧的,对于好氧发酵来说,溶解氧通常既是营养因素,又是环境因素。特别是对于具有一定氧化还原性质的代谢产物的生产来说,DO值的改变势必会影响到菌株培养体系的氧化还原电位,同时也会对细胞生长和产物的形成产生影响。
发酵过程中溶氧量会随着菌体生长的不同阶段呈短暂曲线型变化。在发酵前期,因菌丝大量繁殖,需氧量会大于供氧,溶氧出现短暂低峰;在生长与产物合成阶段,需氧量会逐渐减少,溶氧趋于稳定,但受补料等条件的影响,又会引起溶氧浓度的下降;在发酵后期,由于菌体衰老,溶氧浓度又会逐渐上升,一旦菌体自溶,溶氧浓度则会明显上升。整个发酵过程是通过在线溶氧浓度检测和适时改变通气速率来实现自动化控制的,以便把溶解氧浓度值稳定在该菌体生长所需的可控期望值或范围内。
2 溶氧对微生物生长的影响
根据对氧的需求情况,微生物可分为好氧生物(通气发酵)和厌氧生物(静置发酵)。
好氧生物的发酵,只能在有氧的环境中生存,属于微生物中的一部分,好氧生物是把氧作为最终的电子受体,借助有氧呼吸获取生长所需的能量。它包括原核生物中的一部分细菌、放线菌、螺旋体、支原体、立克次氏体、衣原体;真核生物中的一部分真菌、藻类、原生动物;一部分非细胞类的病毒和亚病毒。此类微生物在发酵过程中为促进生长,一般需要尽可能地提高溶氧度。
厌氧微生物的发酵有如丙酮丁醇发酵、酵母菌的酒精发酵、乳酸发酵等。其中,产生丙酮、丁醇的梭状芽孢杆菌(Clostridium)是一种专性厌氧微生物,它的发酵和菌体发酵应在无氧条件下进行,氧对其显示为毒性,会产生甲烷杆菌,此时能否限制DO值在一个较低值就会成为发酵成败的关键因素。
还有一种菌种为兼性厌氧微生物,例如酵母菌根据其生理特点,在种子制备时应在搅拌通风的条件下进行,以促使其生长繁殖,而酒精发酵则在缺氧条件下进行。乳酸菌大多属耐气性厌氧菌,它们的生长和代谢产物合成与氧的有无关系不大,但为了防止杂菌污染,还是以在缺氧环境中发酵为宜。
溶解氧对微生物自身生长的影响很大,DO值的高低会改变微生物的代谢途径,以致改变发酵环境甚至使目标产物发生偏离。所以,精确检测溶氧值以便适时调节相应的装置,才能有效完成发酵过程,降低风险。
3 传统的溶氧检测方式
水中溶解氧的含量与大气压力、水温及含盐量等因素有关。早在1984年国际标准ISO5814—1984中,即对溶解氧的测定有了标准化规定,该标准又在1990年国际标准ISO5814—1990中进行过修订。我国的检测方法标准GB11913—89《水质溶解氧的测定电化学探头法》的制定时间是1989年,是采用了国际标准ISO5814—1984编制而成。
2009年12月1日我国颁布实施的HJ506—2009《水质溶解氧的测定电化学探头法》中,规定了测定水中溶解氧的电化学探头法。该标准是对《水质溶解氧的测定电化学探头法》(GB11913—89)的修订。自该标准实施之日起,原国家环境保护局于1989年12月25日批准、发布的国家环境保护标准《水质溶解氧的测定电化学探头法》(GB11913—89)废止。
3.1 电化学探头法
在HJ506—2009标准中,规定溶解氧的测定方法为电化学探头法,在GB11913—89标准中也规定了电化学探头法,两者的原理与测量方法基本一致。
3.1.1 测量原理
溶解氧电化学探头是一个用选择性薄膜封闭的小室,室内有2个金属电极并充有电解液,氧和一定数量的其他气体及亲液物质可透过这层薄膜,但水和可溶物质的离子几乎不能透过这层膜。将探头浸入水中进行溶解氧的测定时,通过电池作用或外加电压在2个电极间产生电位差,使金属离子在阳极进入溶液,同时氧气通过薄膜扩散在阴极获得电子被还原,产生的电流与穿过薄膜和电解质层的氧的传递速度成正比,即在一定的温度下该电流与水中氧的分压(或浓度)成正比。
薄膜对气体的渗透性受温度变化的影响较大,要采用数学方法对温度进行校正,也可在电路中安装热敏元件对温度变化进行自动补偿。
3.1.2 测量探头
测量探头有原电池型(例如铅/银)和极谱型(例如银/金),探头上宜附有温度补偿装置。
3.1.3 校准
当测量的溶解液浓度水平低于1mg/L(或10%饱和度),或者当更换溶解氧罩或内部的填充电解液时,需要进行零点检查和调整。若仪器具有零点补偿功能,则不必调整零点。
3.1.4 测定
将探头浸入样品,不能有空气泡截留在膜上,停留足够时间,待探头温度与水温达到平衡,且数字显示稳定时读数。必要时根据所用仪器的型号及对测量结果的要求,检测水温、水压或含盐量,并对测量结果进行校正。探头的膜接触样品时,样品要保持一定的流速,防止与膜接触的瞬间将该部位样品中的溶解氧耗尽,使读数发生波动。
3.1.5 结果计算
溶解氧的质量浓度以每升水中氧的毫克数表示,也可以用饱和百分率来表示溶解氧的浓度。
3.1.6 电极的维护
注意电极与膜片的清洗,若膜片和电极上有污染物,会引起测量误差,一般要求1~2周清洗1次。
当电极的线性不合格时,就需要对电极进行再生,电极的再生一般1年1次,包括更换溶解氧膜罩、电解液和清洗电极。每隔一定时间或当膜被损坏和污染时,需要更换溶解氧膜罩并补充新的填充电解液。如果膜未被损坏或污染,建议2个月更换1次填充电解液。
3.2 碘量法
在GB7489—89中规定了碘量法的溶氧检测方式,是一种离线取样检测的方法。
3.2.1 原理
在水样中加入硫酸锰和碱性碘化钾,水中溶解氧将低价锰氧化成高价锰,生成四价锰的氢氧化物棕色沉淀。加酸后,氢氧化物沉淀溶解并与碘离子反应而释出游离碘。以淀粉作指示剂,用硫代硫酸钠滴定释出碘,可计算溶解氧的含量。
3.2.2 测量
3.2.2.1 溶解氧的固定
用吸管插入溶解氧瓶的液面下,加入1mL硫酸锰溶液、2mL碱性碘化钾溶液,盖好瓶塞,颠倒混合数次,静置。待棕色沉淀物降至瓶内一半时,再颠倒混合一次,待沉淀物下降到瓶底。溶解氧一般在取样现场固定。
3.2.2.2 析出碘
轻轻打开瓶塞,立即用吸管插入液面下,加入2mL硫酸。小心盖好瓶塞,颠倒混合摇匀,至沉淀物全部溶解为止,放置暗处5min。
3.2.2.3 滴定
吸取100mL上述溶液于250mL锥形瓶中,用硫代硫酸钠溶液滴定至溶液呈淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚好褪去为止,记录硫代硫酸钠溶液用量。
计算:
式中 M——硫代硫酸钠溶液浓度,mol/L;
V——滴定时消耗硫代硫酸钠溶液体积,mL。
3.2.2.4 精密度和准确度
经不同海拔高度的4个实验室分析于20℃含饱和溶解氧6.85~9.09mg/L的蒸馏水,单个实验室的相对标准偏差不超过0.3%;含4.73~11.4mg/L溶解氧的地面水,单个实验室的相对标准偏差不超过0.5%。
溶解氧测量方法除上述几种最常用的测量方式外,还有“叠氮化钠修正法”、“高锰酸钾修正法”等。
4 光学荧光法测量技术的应用
在过去的50多年里,一直采用电流法和极谱法测量溶解氧。这种方法对于发酵、市政和工业废水中的溶解氧监测曾起着非常重要的作用,但是传统的电化学方法的使用膜、电极和电解液会导致很多问题,即使进行定期维护,还是不能得到准确的测量结果。
新型荧光技术不需要使用膜和电解液,几乎不用维护,性能优异,使用方便。本文将浅谈光学荧光法的测量的有关技术应用。
4.1 原理
荧光法测量溶解氧的技术是基于荧光淬灭原理,如图1所示。蓝绿光照射到荧光物质上激发荧光物质并发出红光,由于氧分子可以带走能量(淬灭效应),所以激发的红光的时间和强度与氧分子的浓度成反比。通过测量激发红光与参比光的相位差,并与内部标定值对比,从而可计算出氧分子的浓度。
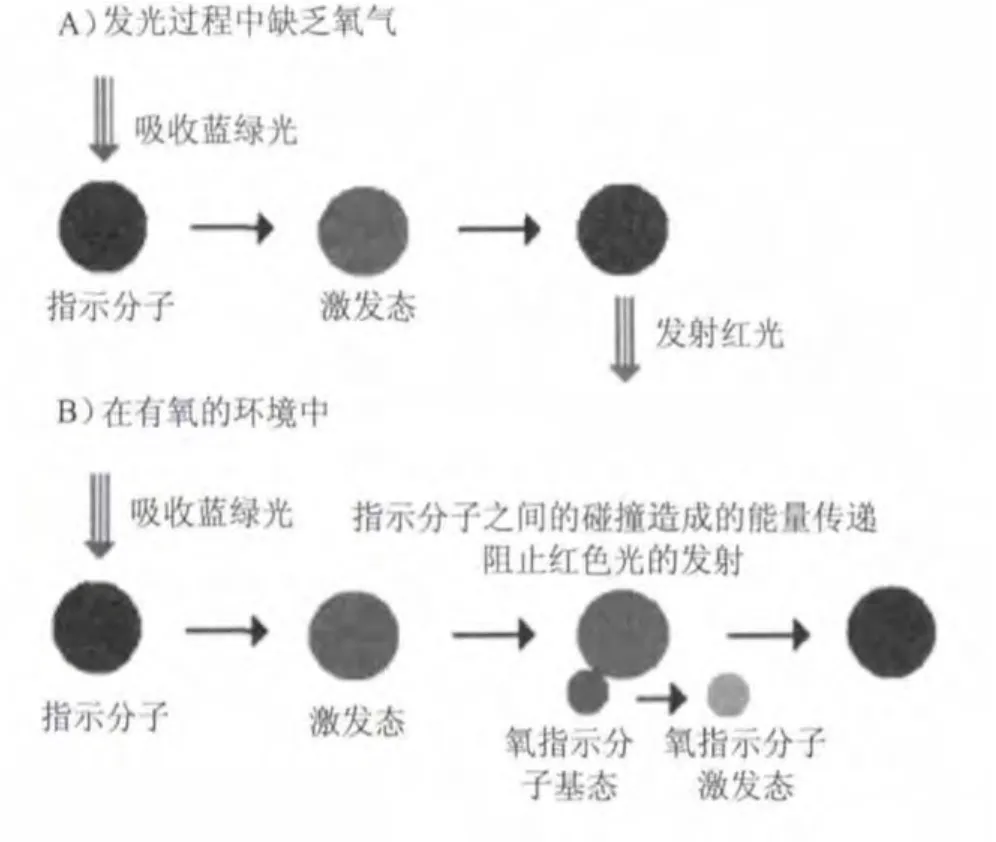
图1 荧光淬灭原理
4.2 国外光学溶氧传感器的产品研发与应用
在欧美等国家基于“荧光淬灭”原理已经研发出具体的光学溶氧传感器或相应的溶氧测量仪,在生物发酵、水质监测等领域已经被广泛使用,光学溶氧传感器的产品设计是通过一个发光二极管来监视传感器的蓝色LED,特定的发光体被蓝光激发后发生冷光现象(荧光),带有红光过滤器的发光二极管用来测量冷光产生的红光,以判断和计算氧分子的数量。
4.3 与电化学方式的比较
极谱式溶氧电极在近10年来应用广泛,但具有一定的局限性,在进行微量测量时不能保证稳定和输出测量数据的准确性,当溶氧量保持一定时,因传感器没有电流流动而不能动态地显示结果。当线缆发生故障时,显示结果也会保持不变,导致难以发现故障所在。
光学溶氧传感器适用于实时溶解氧监测,坚固耐用,测量结果准确,并且易于维护。光学溶解氧传感器具有很强的耐受性,能承受压力冲击、温度骤变以及能够导致电化学电极产生误报警的断流效应。光学传感器无电解液,无需极化,仅需定期更换膜组件即可。更换过程仅需1min,光学溶解氧传感器的维护便捷。即插即测启动,所有的传感器数据,包括校准历史都存储在传感器内。在执行完维护和校准后,在线安装操作非常简单。由于具有“即插即测”功能,在将传感器连接后,所有相关的数据都自动上传至变送器,并立即显示氧含量读数,且无需极化。传感器甚至可以预校准并校准曲线,以方便随时使用,从而更快、更方便地更换传感器。
表1为光学溶氧与电化学溶氧监测技术的比较与特点。
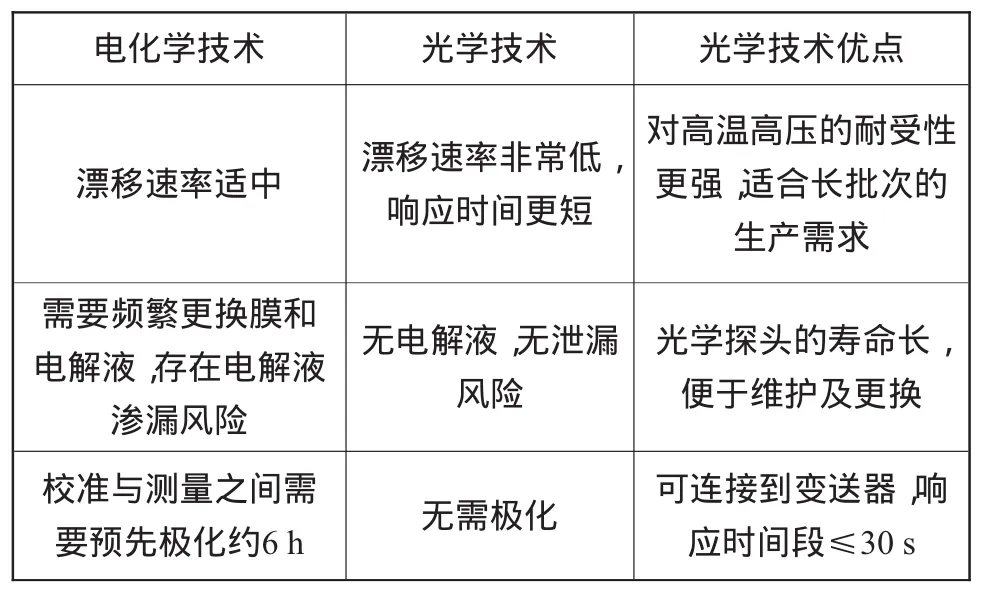
表1 光学溶氧与电化学溶氧监测技术比较与特点
4.4 以德国Centec光学溶氧传感器为例简述其技术应用
4.4.1 在线溶氧传感器
表2为在线溶氧传感器外形及技术参数。
4.4.2 便携式溶氧传感器
表3为便携式溶氧传感器外形及技术参数。
4.4.3 应用
过程连接根据被测设备的接口尺寸选择,电气连接输入一般为24V直流电源,输出为电流或电压信号,用于外部显示或PLC的信号采集。

表2 在线溶氧传感器外形及技术参数
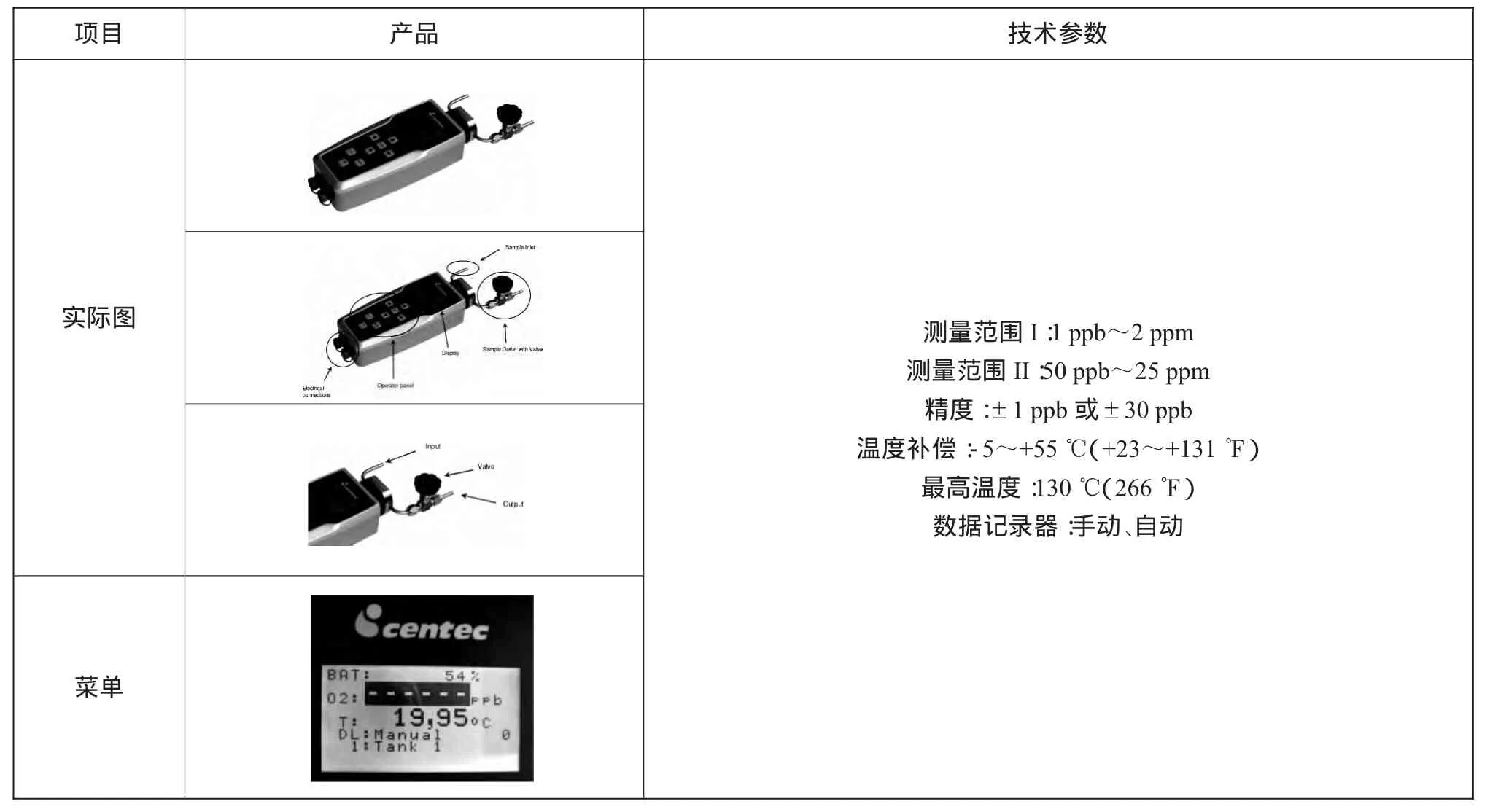
表3 便携式溶氧传感器外形及技术参数
测量方法是将光学溶氧测量探头浸入被测液体,通过专用软件或仪器外部显示器对各项参数进行设定,如测量范围、精度、测量间隔时间、压力范围、温度补偿、上限温度、报警值等项目。氧敏感层的使用寿命与以上参数的设定有着密切的关系,如果测量的间隔时间缩短、测量频率增大就会缩短敏感层的使用寿命。通过设定测量温度和压力的上限值,可以在高温及高压环境下停止溶解氧的测量,对光敏感层起到一个保护作用。
5 风险分析
在传统溶氧类传感器的产品应用案例中,近年来食品与药品行业对传统电化学式溶氧电极中因为电解液渗漏带来的潜在风险而受到越来越多的关注。
电化学溶氧电解的电解液为氢氧化钾或氯化钾溶液,具强碱性及腐蚀性。当溶解于水、醇或用酸处理时会产生大量热量,属中等毒性,溶于乙醇,微溶于醚,对组织有烧灼作用,可溶解蛋白,形成碱性变性蛋白。溶液或粉尘溅到皮肤上,尤其溅到黏膜,可产生软痂。溶液浓度越高,温度越高,作用越强。溅入眼内,不仅可损伤角膜,而且能使眼深部组织损伤。
在发酵过程中出现电解液泄漏的情况会破坏发酵液的pH值,导致整个批次产品被污染。如果后期没有及时发现,成品流通到市场则会对消费者的生命安全带来极大的威胁。
6 结语
风险控制并非完全意义上的杜绝风险,而是如何通过先进的技术创新、产品创新以及质量体系文件的建立等多种举措使得运营风险可控化、可视化,并可实现可追溯。
随着中国食品药品质量监管体系的日趋完善,尤其是在制药、生物发酵等特殊行业中,对于过程的适时检测与理化分析势必会成为未来的主流技术发展方向。溶氧虽然只是发酵行业的诸多工艺参数之一,但是却有着至关重要的作用,所以光学溶氧检测技术一定会得到越来越广泛的应用。
[1]HJ506—2009 水质 溶解氧的测定 电化学探头法[S]
[2]GB7489—89 水质溶解氧测定[S]
[3]付燕.微生物来源药物制备工艺研究中质量控制要素探讨——发酵工艺的过程控制[J].中外健康文摘,2012(8)
