转化生长因子-β1在家兔羊水栓塞后肺损伤中的作用
2014-08-22刘伯毅湖北医药学院附属人民医院妇产科湖北十堰442000
岳 艳,范 丽,刘伯毅(湖北医药学院附属人民医院妇产科,湖北十堰 442000)
羊水栓塞(amniotic fluid embolism,AFE)是由于羊水进入母体血液循环而引起的一系列严重的临床综合征,发病急,病情进展迅速,病死率高。AFE后患者易出现急性肺损伤与急性呼吸窘迫综合征(ARDS),部分患者死于严重的低氧血症。本研究旨通过动物实验,探讨AFE后肺损伤的机制,现报道如下。
1 材料与方法
1.1 动物模型制作 健康妊娠晚期(24~26d)家兔20只,体质量3.3~4.0kg(湖北医药学院动物实验中心提供)。随机分为两组:对照组(生理盐水组)及羊水组,每组各10只。术前禁食12h,禁水2h。用3%戊巴比妥钠30mg/kg静脉注射麻醉,仰卧固定于兔台上,固定头部和四肢,备皮,常规局部消毒、铺巾,腹正中线切口10cm,暴露子宫并切开子宫,取出胎兔、胎盘,用注射器抽取羊膜腔羊水300mL备用。羊水组家兔经耳缘静脉注射羊水3mL/kg,对照组注射生理盐水3mL/kg,1h后处死动物,切开家兔胸腔,取肺组织备用。
1.2 实验方法
1.2.1 病理学检查 取一小块肺组织用4%多聚甲醛溶液固定5h,用磷酸缓冲液(PBS)冲洗,石蜡包埋、切片、HE染色,在显微镜下观察肺组织病理学变化。
1.2.2 肺组织转化生长因子-β1(TGF-β1)表达的检测 取肺组织称重,加生理盐水(按100mg肺组织,加生理盐水0.9mL比例),用玻璃匀浆器制备肺组织匀浆,以1 000r/min的速度离心20min,取上清液,置于-20℃冰箱冻存,采用链霉素亲和素-生物素-过氧化酶复合物(SABC)法对肺组织 TGF-β1蛋白表达进行免疫组织化学染色(试剂盒及TGF-β1的单克隆抗体购自武汉博士德生物工程有限公司)。按照试剂盒操作步骤操作,以PBS代替一抗作阴性对照,阳性染色为细胞质呈棕黄色。采用MIAS-2000医学图像分析系统,进行蛋白半定量分析,以最大灰度值反映TGF-β1蛋白表达量。
1.3 统计学处理 采用SPSS15.0软件进行统计分析,计量资料以±s表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 肺组织病理变化 羊水组可见肺间质及肺泡水肿、充血,肺泡可见炎症细胞浸润(图1)。
2.2 肺组织TGF-β1见图2。对照组肺组织TGF-β1呈阴性表达,为(5.02±0.76)μg/L;羊水组肺组织 TGF-β1胞质可见棕黄色染色,呈阳性表达,为(19.85±1.92)μg/L,两组 TGF-β1水平比较差异有统计学意义(P<0.05)。

图1 家兔肺组织(HE×200)
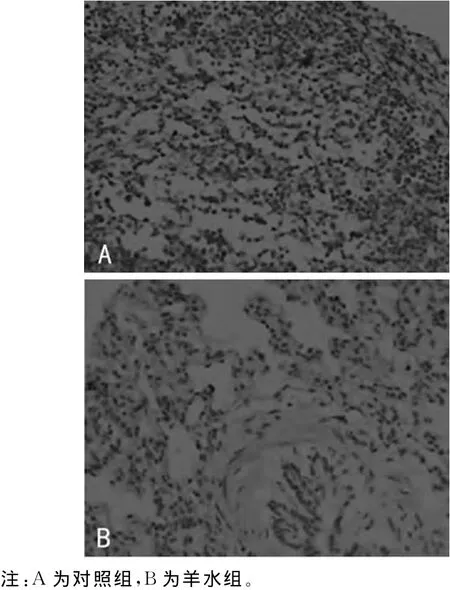
图2 家兔肺组织TGF-β1的表达
3 讨 论
本研究中羊水组可见肺间质及肺泡水肿、充血,提示肺部发生肺损伤。近年来,AFE后肺部病理变化受到重视[1],许多患者AFE后因ALI/ARDS,而出现顽固性低氧血症危及患者生命AFE后肺损伤的机制:(1)羊水进入肺循环导致肺血管痉挛、肺动脉高压、换气功能下降[2];(2)肺部白三烯、前列腺素、补体等物质释放,导致肺部炎性反应,引起肺损伤[3];(3)大量中性粒细胞在肺泡腔内黏附、聚集、活化,介导炎性反应加重肺损害[4]。部分研究发现,AFE后肺损伤发病机制及病理生理变化复杂,某些机制不明[5-6]。
TGF-β是一种多功能细胞因子,TGF-β1是TGF-β亚型,能调节多种细胞的增殖、分化、凋亡和合成细胞外基质等,在组织的发生、发育及损伤后修复过程中发挥重要作用[7]。TGF-β1在多种细胞和组织中均有表达,在肺部主要表达于气道上皮及肺泡巨噬细胞,妊娠期可表达于胎盘滋养层细胞、子宫蜕膜细胞、肌层细胞及羊水中,对滋养层细胞和蜕膜细胞内分泌、免疫及黏附分子表达功能及胚胎发育均具有重要的调节作用[8]。AFE后TGF-β1与肺损伤的关系目前并无相关研究,本实验发现,羊水组肺组织TGF-β1明显升高(P<0.05),而对应的病理切片有炎症细胞浸润和肺实质及间质水肿和充血。表明TGF-β1在AFE后肺损伤发病机制上有重要作用。肺损伤后肺组织TGF-β1表达升高机制尚不明确[9]。升高的TGF-β1引起肺损伤的机制:(1)TGF-β1作用于细胞纤维化的多个环节,刺激各种细胞外基质起作用,使纤维化降解抑制剂的合成增加,基质降解酶减少,导致肺纤维化,加重肺损伤[10];(2)TGF-β1抑制肺表面活性物质,诱导肺细胞凋亡[11],导致肺泡壁上皮细胞和血管内皮细胞通透性增高、肺泡炎症和水肿;(3)TGF-β1抑制肺内皮细胞、上皮细胞增殖[12],使损伤的肺组织得不到及时的修复。
综上所述,AFE肺损伤发生与TGF-β1表达升高密切相关,从而导致肺组织损伤、纤维化,同时因损伤的肺组织不能及时修复,加重肺损伤。抑制TGF-β1表达,可以减轻或预防肺损伤,改善AFE患者预后。
[1]Michael D,Benson MD,Richard K,et al.Immunologic studies in presumed amniotic fluid embolism[J].Obstet Gynecol,2001,97(4):510-514.
[2]Masson RG.Amniotic fluid embolism[J].Clin Chest Med,1992,13(4):657-665.
[3]栾秀平.羊水栓塞的发病机制及早期诊断[J].临床和实验医学杂志,2006,5(3):293-295.
[4]芮萌,段蕴铀.中性粒细胞凋亡与急性肺损伤[J].中国急救医学,2008,28(12):1129-1132.
[5]Clark SL,Hankins GD,Dudlev DA,et al.Amniotic fluid embolism:analysis of the mational registry[J].Am J Obstet Gynecol,1995,172(4Pt 1):1158-1167.
[6]张华.羊水栓塞的发病机制及诊治进展[J].实用妇产科志,2000,16(3):134-136.
[7]Mahmoud M,Upton PD,Arthur HM.Angiogenesis regulation by TGF beta signalling:dues from an inherited vascular disease[J].Biochem Soc Trans,2011,39(6):1659-1666.
[8]王越,杨静.转化生长因子β与妊娠[J].国外医学:妇产科学分册,2003,30(4):234-237.
[9]Ohta N,Shimaoka M,Imanaka H,et al.Glucocorticoid suppresses neutrophil activation in ventilator-induced lung injury[J].Crit Care Med,2001,29(5):1012-1016.
[10]郑桂林,林群英,涂海健,等.特发性肺纤维化患者血清TGF-β1、PDGF、IL-13水平变化及相关研究[J].中国现代医生,2012,50(31):59-61.
[11]陈光建,邱海波,陆晓旻,等.ACE基因I/D多态性与急性肺损伤发生及预后的关系[J].临床麻醉学杂志,2009,25(9):806-808.
[12]唐仕芳,朱洪春,李华强.转化生长因子TGF-β1在新生大鼠高浓度氧致肺损伤中的作用研究[J].重庆医学,2009,38(4):438-440.
