β-环糊精对9,10-蒽醌的荧光增敏效应研究
2014-08-20姜慧明杨红
姜慧明,杨红
(1.大连民族学院生命科学学院,辽宁 大连116600;2.大连民族学院环境与资源学院,辽宁 大连116600)
0 引言
9,10 -蒽醌是一种化工原料,难溶于水,也难溶于大多数有机溶剂,主要用于染料工业,用于染料的生产,有一定的毒性.以蒽醌为原料,经磺化、氯化、硝化等,可得到范围很广的染料中间体,用于生产蒽醌系分散染料、酸性染料、还原染料;反应染料等,形成性能好的染料类别.据统计,蒽醌染料有四百多个品种,在合成染料领域中占有很重要的地位.
蒽醌化合物还有其他的应用领域,如用于高浓度过氧化氢的生产、在化肥工业中用以制造脱硫剂蒽醌二磺酸钠、在印染工业中用作染助剂等.蒽醌也是中药的一种成份,如大黄等药材,但长期服用将会给人体的红细胞和血红蛋白造成损伤,对SD大鼠的毒性反应靶器官主要为肾脏,且毒性反应是可逆的,对SD大鼠的安全剂量为794mg/kg.鉴于以上因素,对蒽醌的定性和定量检测是必要的.
蒽醌的检测目前主要采用分光光度法[1]、紫外分光光度法[2]、液相色谱法[3]及高效液相色谱质谱法[4]等,荧光法尚未进行深入研究.在荧光检测技术中,超分子增敏效应是一种新型的技术手段,因其具有更高的灵敏度和易操作性,逐渐成为一种主要的检测技术.在众多的超分子主体化合物中,β-环糊精因其具有价格低廉、绿色环保等优越性,因而受到科研工作者的青睐.
β-环糊精是一种具有疏水空腔和亲水表面的超分子主体化合物,具有分子识别功能,能够选择性地结合有机分子,形成主客体超分子化合物.与单体分子相比,超分子体系内的客体分子的许多性能,如溶解性能、化学性能、扩散性能、电化学性能以及光化学性能等,也都将随之发生一定的变化[5-8].目前认为β-环糊精引起荧光增强的主要原因是增加发射速度常数,减少分子移动自由度,避免去活碰撞,保持适宜的微环境以及保护激发态不与大体积水分子和猝灭剂接触[9].段云青等[10]通过实验数据推测溴敌隆结构中的疏水基团4-羟基香豆素母环或者溴代联苯基进入了β-环糊精的疏水空腔之中形成超分子包合物引起荧光显著增强,为环糊精荧光增强机理研究提供了必要的依据.但是目前其荧光增敏机理基本处于推测阶段[11-13].
本部分探讨了9,10-蒽醌的荧光光谱,以及在β-环糊精存在下9,10-蒽醌的荧光增强效应,建立了快速高效的荧光测定9,10-蒽醌含量的方法.与已经报道的几种检测技术比较,本检测方法具有更高的检测灵敏度.
1 实验部分
1)仪器与试剂 RF-5301PC荧光分光光度计,SHIMADZU,Japan;9,10-蒽醌,本实验室合成,配成1×10-5mol/L的乙醇/水溶液;β-环糊精(国药集团化学试剂有限公司):二次重结晶,60℃真空干燥后配成0.01mol水溶液,实验用水为二次蒸馏水.
Britton-Robinson(B-R)缓冲溶液的配置:取 H3BO30.618 3g,85%的 H3PO40.68mL,36%的乙酸1.16mL,用蒸馏水配成250mL的三酸混合液;再取2.0g NaOH,配置成0.2mol/L溶液,将配好的三酸混合液与NaOH溶液以不同体积混合,可配置为不同pH的B-R缓冲溶液.
2)实验方法 移取一定量的9,10-蒽醌溶液,加入不同量的B-R缓冲溶液及β-环糊精溶液后移入25mL比色管中,加水定容,室温下振荡10min,然后测定溶液的相对荧光强度.
2 结果与讨论
图1列出了9,10-蒽醌的激发谱和发射谱,确定测定波长λex/em=265/473nm.
9,10 -蒽醌在265nm的激发波长下,出现了两组发射峰,分别位于336nm和473nm处,其中473 nm的发射峰荧光吸收强度较强,因此确定了9,10-蒽醌的激发波长和发射波长分别为265nm和473 nm.
2.1β-环糊精浓度的影响及包合常数测定 在确定了9,10-蒽醌的激发和发射波长后,笔者在蒽醌溶液中加入了不同浓度的β-环糊精,得到了一系列荧光光谱,如表1和图2所示.
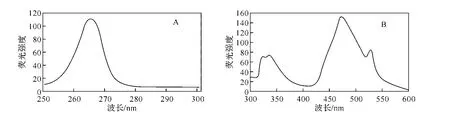
图1 9,10-蒽醌的激发光谱(A)和发射光谱(B)(狭缝宽度:5nm)
图3列出了β-环糊精浓度对9,10-蒽醌荧光强度的影响.由表1和图2、图3可以清楚看出,9,10-蒽醌溶液在加入β-环糊精后,在380、410和473nm处出现了3组荧光发射峰,473nm处的发射峰强度最大,且发射峰的荧光强度有了明显的增强.在β-环糊精的浓度范围为4×10-4~3.2×10-3mol/L之内,9,10-蒽醌的荧光强度随着β-环糊精浓度的增加而增强.
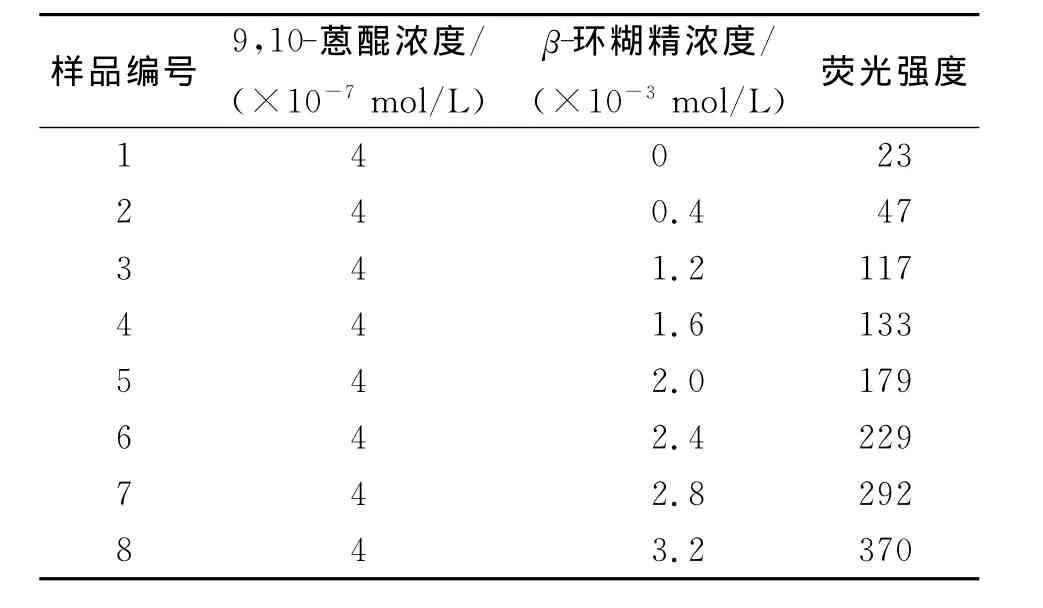
表1 不同β-环糊精浓度下9,10-蒽醌的荧光强度
β-环糊精对9,10-蒽醌的的荧光增敏作用是由于9,10-蒽醌在疏水作用、范德华力及氢键力等非共价键作用的驱动下,进入β-环糊精空腔形成超分子包合物,在空腔内9,10-蒽醌分子的运动自由度以及水分子的松弛效应大大降低,阻止了碰撞失活,减少了非辐射跃迁的几率;环糊精空腔所提供的非极性微环境近似于有机介质[5],使9,10-蒽醌分子的荧光在β-环糊精空腔中受到保护和屏蔽,减少了与腔体外主体溶液中水分子、氧等碎灭剂的接触;空腔尺寸大小与极性对客体进行选择性识别包合.据此,建立了水溶液中高灵敏度与高选择性测定9,10-蒽醌的荧光光谱法.
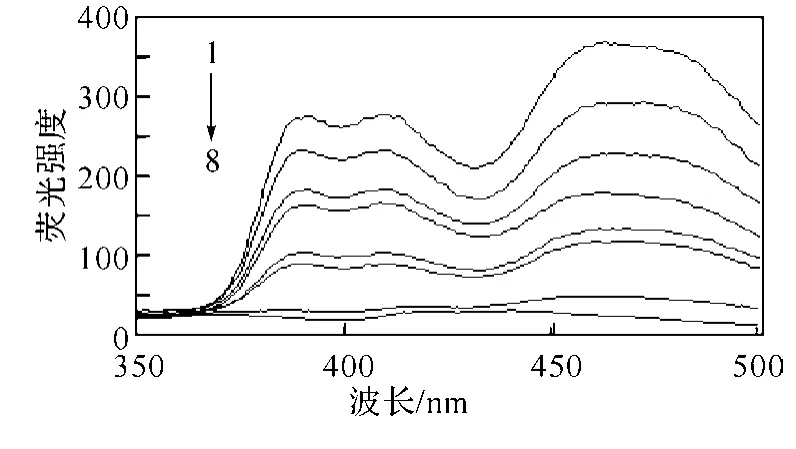
图2 不同β-环糊精浓度下9,10-蒽醌的荧光发射光谱(狭缝宽度均为5nm)
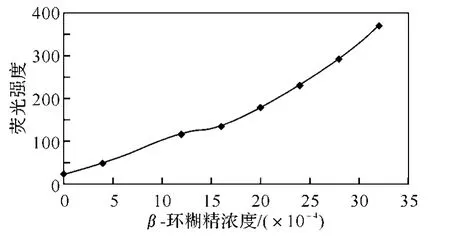
图3 β-环糊精浓度对9,10-蒽醌荧光强度的影响
对β-环糊精与9,10-蒽醌的包合体系,将所得实验数据按1/(F-F0)对1/[CD]作图,可得一线性关系较好的直线(R=0.998 3),说明主客体间形成了1∶1的超分子包合物.由直线的截距与斜率之比可求得β-环糊精-9,10-蒽醌的结合常数K=1.35×102,如图4所示.
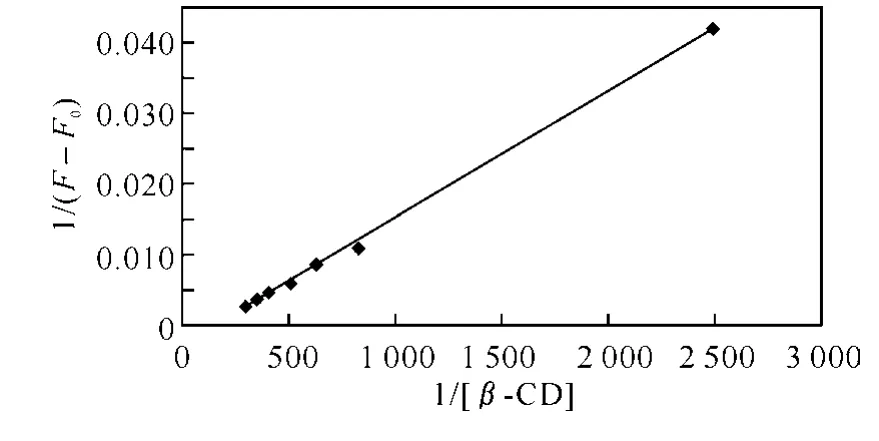
图4 β-环糊精-9,10-蒽醌一元包合物关系式方程曲线
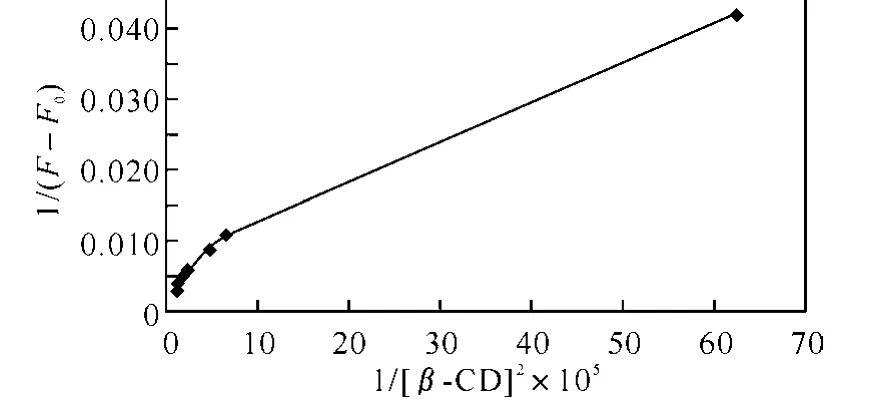
图5 β-环糊精-9,10-蒽醌二元包合物关系式方程曲线
假设在β-环糊精与9,10-蒽醌的包合物中,主客体的化学计量比为2∶1,将测得的实验数据按1/(F-F0)对1/[CD]2作图,不呈直线(图5),因此主客体的化学计量比不是2∶1.
2.2 pH值对9,10-蒽醌荧光强度的影响β-环糊精对碱稳定,但在强酸性介质中将分解为由开环产物直至葡萄糖组成的混合物.本文中探讨了pH=2.0~10.0范围内β-环糊精与9,10-蒽醌包合及其对荧光强度的影响,结果如图6和图7所示.体系的pH值是由B-R缓冲溶液来调节的.
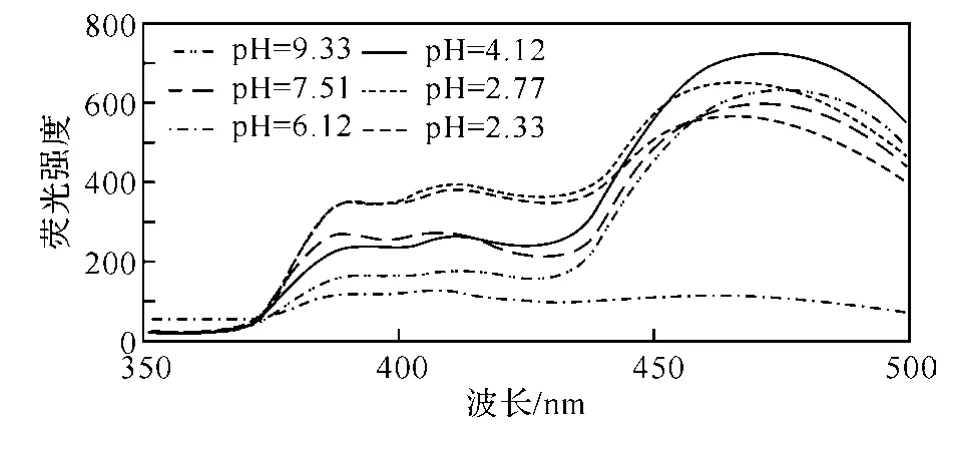
图6 pH值对β-环糊精包合9,10-蒽醌荧光强度的影响(狭缝宽度均为5nm)
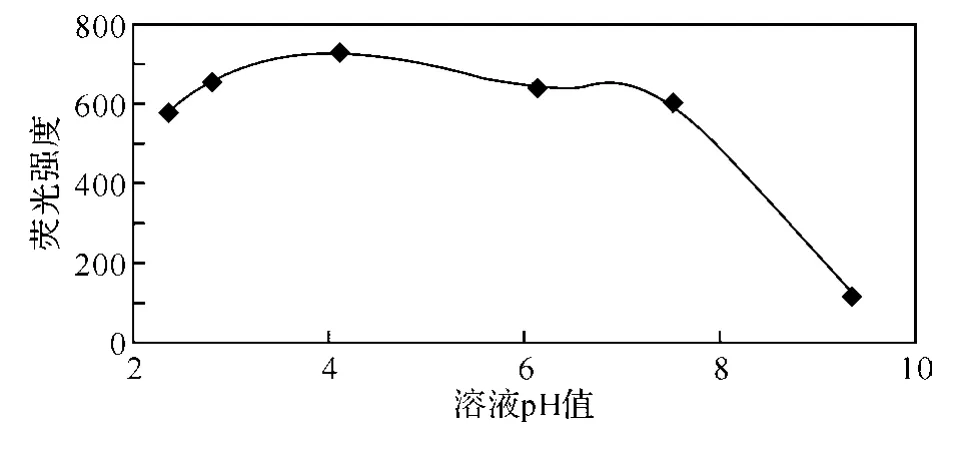
图7 pH值对β-环糊精包合9,10-蒽醌荧光强度影响的工作曲线
由图6和图7看出,在强酸性溶液中,β-环糊精包合9,10-蒽醌的荧光强度都很强,其中以pH=4.12的溶液荧光强度最大;而在中性和碱性条件下,β-环糊精包合9,10-蒽醌的荧光强度较弱.本实验选择pH=4.12作为荧光测定的最佳pH值.
2.3 9 ,10-蒽醌在β-环糊精包合状态下的工作曲线、检测下限和精密度 由表1看出,当β-环糊精的浓度为4×10-3mol/L时,9,10-蒽醌的荧光强度最大,因此在测定9,10-蒽醌的工作曲线时,固定β-环糊精的浓度为4×10-3mol/L而改变9,10-蒽醌的浓度,得到了9,10-蒽醌在不同浓度时的荧光强度,如表2和图8所示.
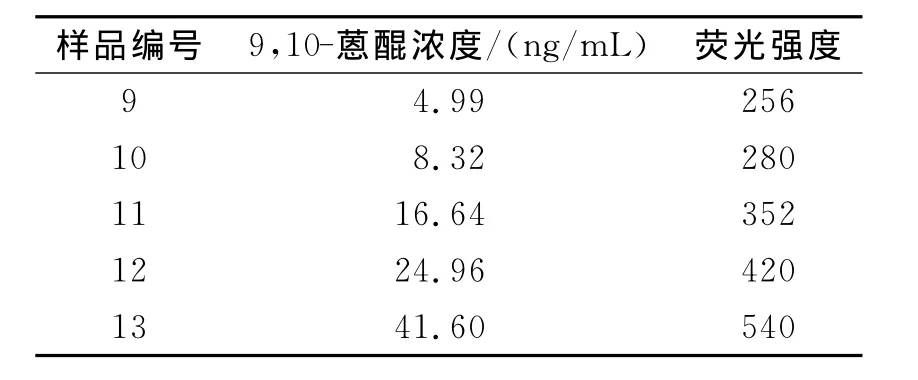
表2 9,10-蒽醌不同浓度时的荧光强度(固定β-环糊精的浓度为4×10-3 mol/L)
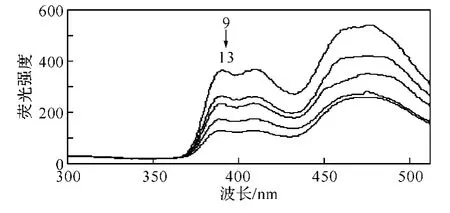
图8 不同浓度9,10-蒽醌的荧光强度曲线固定β-环糊精的浓度为4×10-3 mol/L,狭缝宽度均为5nm
下图(图9)列出了β-环糊精存在下9,10-蒽醌的工作曲线.
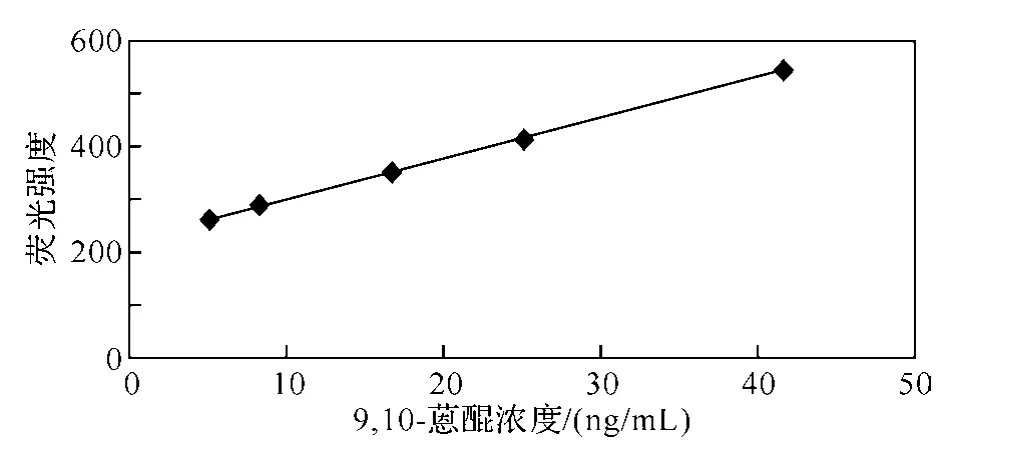
图9 β-环糊精存在下9,10-蒽醌的工作曲线
由图9看出,9,10-蒽醌在4.99~66.56ng/mL范围内呈现良好的线性关系,回归方程为F=7.82c(ng/mL)+218.6,相关系数为0.998 5.依照IUPAC规定,cL=kS0/S,其中cL为检测下限,k为与置信水平相关的常数,S0为n次空白溶液测定值的标准偏差(S0=0.12),S为标准工作曲线的斜率.当置信水平为90%时k取3,计算求得本法的检测限为0.046ng/mL,2.08μg/mL 9,10-蒽醌标准溶液9次平行测得值的相对标准偏差为1.3%.
3 结论
对9,10-蒽醌在与β-环糊精包合后的荧光光谱进行了研究,结果发现,在水相中,二者形成了1∶1的超分子体系,包合常数K=1.35×102.在中性水溶液中,β-环糊精的浓度范围为4×10-4~3.2×10-3mol/L.时,9,10-蒽醌的荧光强度随着β-环糊精浓度的增加而增强.在酸性介质中,客体分子的荧光增强效应更加明显,其中在pH=4.12的溶液中,β-环糊精对9,10-蒽醌的荧光增强效应最大.在pH=4.12的水溶液中,固定β-环糊精的浓度为4×10-3mol/L,得到了9,10-蒽醌的工作曲线,结果显示,9,10-蒽醌在4.99~66.56ng/mL浓度范围内的荧光强度呈现良好的线性关系,回归方程为F=7.82C(ng/mL)+218.6,相关系数为0.998 5.随着荧光强度的增强,该体系对9,10-蒽醌的检测限也大大提高,达到了0.04ng/mL,是已经报道检测极限数量级(0.2μg/mL)[13]的万分之一,此法具有非常广泛的应用价值.随着β-环糊精及衍生物对客体分子荧光增强效应机理研究的深入,其在药物检测、食品添加剂检测、农药残留检测、食品安全等领域将具有极广阔的发展前景.
致谢 本研究工作得到了沈阳农业大学植保学院应用化学实验室的大力支持,在此表示感谢.
[1]鲁彦,郭建宇,朱贤,等.分光光度法测定大黄中总蒽醌[J].化学分析[B],2011,47(1):21-23.
[2]刘云娣,李得堂,任结梅,等.紫外分光光度法测定大承气冲剂中大黄总蒽醌的含量[J].中医药导报,2010,16(7):108-110.
[3]许乾丽,茅向军,熊慧林.HPLC法测定六味安消胶囊中游离蒽醌、总蒽醌和结合蒽醌的含量[J].贵州医学院学报,2010,35(6):578-583.
[4]王杨,黄熙,梁清华,等.超高效液相色谱法测定脑外伤患者口服大黄后尿液中蒽醌类成分[J].中草药,2010,41(7):1103-1106.
[5]申健.新型β-环糊精衍生物的合成及应用[D].济南:山东大学,2008.
[6]Ma L,Tang B,Chu C.Spectrofluorimetric study of theβ-cyclodextrin 3-dapsone-3-linear alcohol supramolecular system and determination of dapsone[J].Analytica Chimica Acta,2002,469(2):273-283.
[7]Tang B,Ma L,Wang H Y,et al.Study on the supramolecular interaction of curcumin andβ-cyclodextrin by spectrohotometry and its analytical application[J].Agr Food Chem,2002,50(6):1355-1361.
[8]Tang B,Ma L,Ma C.Spectrofluorimetric study of theβ-cyclodextrin:Rubidate complex and determination of rubidate by beta-CD-enhanced fluorimetry[J].Talanta,2002,58(5):841-848.
[9]童林荟.环糊精化学:基础与应用[M].北京:科学出版社,2001(1):145-148.
[10]段云青,闵顺耕.杀鼠剂溴敌隆和环糊精的超分子作用及分析应用[J].分析实验室,2009,28(5):1-5.
[11]魏丹毅,葛从辛,周湘池,等.β-环糊精及其衍生物对Al(Ⅲ)-铁试剂的荧光增强效应及机理[J].化学研究与应用,2000,12(6):626-628.
[12]朱利中,陆州舜,戚文彬.影响β-环糊精及其衍生物对萘胺的荧光增强效应的一些因素[J].分析化学,1997,25(5):563-566.
[13]Frankewich R P,Thimmaiah K N,Hinze W L.Evalution of the relative effectiveness of differentwater-solubleβcyclodextrinmedia[J].Analytica Chimica Acta,1991,63:2924-2933.
