新型单羰基姜黄素类似物的合成及抗肿瘤活性研究
2014-08-16周代营田宇光杜志云赵肃清
周代营,田宇光,杜志云,赵肃清,郑 希,张 焜*
(1.广东食品药品职业学院,广州510520;2.广东工业大学,广州510006)
姜黄素(curcumin,difesuloyl methane)是姜黄属植物姜黄(curcuma)发挥药理作用的主要成分[1].研究表明,姜黄素可以用于预防和治疗肿瘤,对多种肿瘤细胞的产生、增殖、转移均具有抑制作用,如结肠癌、胃癌、肝癌、乳腺癌、前列腺癌、肺癌等[2-6].其抗肿瘤谱广、分子量小、毒性低是一种具有广阔开发前景的化学治疗药物.美国国家癌症研究所(NCI)已经将其列为第三代防癌药来进行研究,因而姜黄素是一种具有临床应用价值的抗癌药物.但姜黄素水溶性差,生物利用率低,体内代谢快的缺点限制了其广泛应用[7],近年来国内外学者以姜黄素为先导,合成了大量姜黄素结构类似物[8-11],以解决其临床应用缺陷,并希望开发出高效的姜黄素类新药物.最近有报道含氟单羰基类似物EF24可抑制多种肿瘤细胞,其IC50是姜黄素相应值的1/15,并且毒性比姜黄素更低,并研究了其抗肿瘤机制[12-13].本文在前期研究姜黄素及其类似物的基础上[14-16],基于姜黄素母体结构,以4-哌啶酮水合盐酸盐为原料,经氮烷基化、羟基保护、醛酮缩合三步反应合成了2个系列8个新型单羰基类似物,以寻找具有高生物活性的系列化合物,并分析化合物结构与抗癌活性的构效关系,其中化合物B4抗肿瘤谱广,活性较好.
1 实验方法
1.1 试剂与仪器
芳香醛(美国Sigma公司);N-苄基哌啶酮 (百灵威公司);浓硫酸、浓盐酸、冰醋酸(天津市大茂化学试剂厂);氘代DMSO、氘代氯仿、氘代甲醇(美国CIL公司);试剂均为分析纯.
Varian Unity INOVA 400型核磁仪(美国Varian公司);液相色谱-质谱联用仪LCMS-2010A(日本Shimadzu公司);三用紫外(上海精科有限公司);旋转蒸发仪R-1001N(北京大龙兴创实验仪器公司).
1.2 单羰基姜黄素类似物的合成
1.2.1 中间体A'的合成 将15 mmol 4-哌啶酮水合盐酸盐,2 mg碘化钠,15 mmol无水碳酸钾和15 mmol 4-溴-2-氟苄基溴依次加入到250 mL的圆底烧瓶中,用80 mL的甲醇溶解,60℃常压回流并搅拌12 h,呈黄色并有白色沉淀析出,沉淀用甲醇洗涤,合并洗涤液与滤液,真空蒸馏浓缩,重新溶解到乙醚中水洗数次,用无水硫酸镁干燥,过滤浓缩滤液至适量,湿法上样,以石油醚/二氯甲烷为洗脱剂,硅胶柱纯化,收集浅黄色色带,得浅黄色固体样品4.60 g,产率为 73.03%.方程式如下[17]:
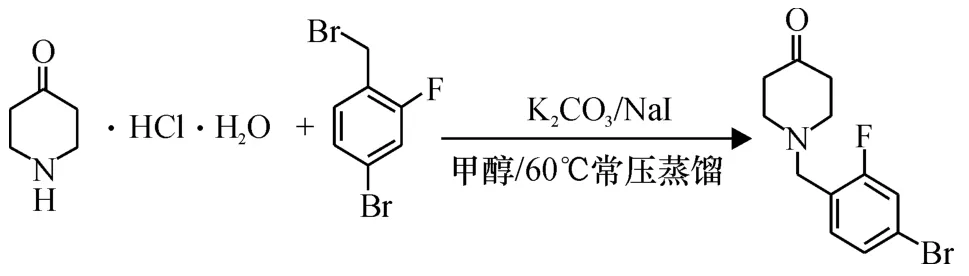
图1 中间体A'的合成Figure 1 Synthesis of intermediate A'
1.2.2 B系列目标化合物的合成 将0.01 mol中间体 B'(2-F,4-Br-苄基哌啶酮)和0.02 mol芳香醛置于圆底烧瓶中,加入25 mL 30%(质量百分比,全文同)的氢氧化钠乙醇溶液,搅拌或加入少量的四氢呋喃助溶直至全部溶解,室温下密封,薄层色谱(TLC)跟踪反应情况,待反应结束后对固体进行抽滤,滤饼依次用EtOH、乙酸乙酯石油醚溶液(体积比为1∶9)、水洗涤至中性,倘若没有固体析出,用10%的稀盐酸中和,然后按照上述方法操作[18].

图2 单羰基姜黄素类似物的合成路线Figure 2 Synthetic routes ofmono-carbonyl curcumin analogues
1.3 单羰基姜黄素类似物的结构表征
采用X-5显微熔点测定仪、Bruker Avance DPX 300超导核磁共振仪、等离子质谱分析仪(ICP-MS)、Vario ELⅢ元素分析仪、红外光谱仪和碳核磁共振仪对产物进行表征.
1.4 单羰基姜黄素类似物抗肿瘤活性检测
采用MTT比色法测试姜黄素类似物的体外抗肿瘤活性(表1).细胞分别接种于96孔培养板中,调整细胞悬液为含10%热灭活新生牛血清、青霉素100 U/mL、链霉素100μg/mL的 RPMI-1640培养基,每孔加入100μL,使细胞密度为4 000个/孔.于37℃含5%CO2饱和湿度的培养箱中培养24 h.姜黄素类似物试液浓度范围设为:50、30、20、10、5、3、2、1、0.5、0.2、0.1 μmol/L.留3 孔只加培养液作为空白对照,同时以相同浓度的未经修饰的姜黄素为参照组,以不加姜黄素类似物只加二甲基亚砜(DMSO)的培养液孔作为阴性对照.培养72 h后除去上清液,加入100μL 5mg/mL的MTT溶液继续培养1 h后再次除去上清液,加入100μL DMSO振摇5~10 min,使蓝紫色结晶充分溶解.用酶联免疫检测仪在570 nm波长处测定光密度值.抗肿瘤活性测试实验在美国罗格斯大学Allan H Conney院士实验室进行.
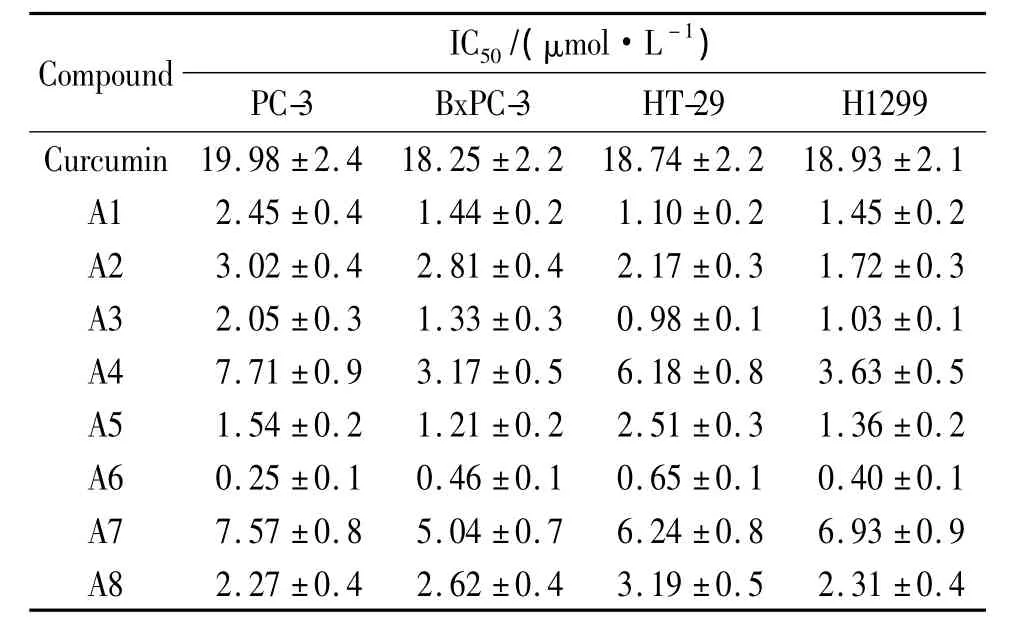
表1 单羰基姜黄素类似物对 PC-3、BxPC-3、HT-29和H1299细胞的IC50Table 1 Inhibitory effects ofmono-carbonyl curcumin analogues on the growth of PC-3,BxPC-3,HT-29 and H1299 cells
2 结果与讨论
2.1 合成的化合物结构分析
合成的化合物结构较为复杂,相邻单键之间相互作用,各种单键的强度大体相同,部分基团的吸收峰偏移,一个区域内的吸收光谱互相影响或重叠.如红外光谱中苯环的═C C骨架振动本应为1 580和1 600 cm-1,一般产生2个峰,有时列分为4个峰,增加了1 450和1 500 cm-1,由于产物具有大共轭基团,所以在1 580和1 600 cm-1的2个峰明显加强.酮羰基═C O伸缩振动约为1 715 cm-1,烯键伸缩振动在1 620~1 680 cm-1,酮羰基与烯键═C C共轭导致频率低移至1 650~1 700 cm-1,并重叠在一起,但总体变化不大,能够找出产物相对应的特征官能团.熔点测定、质谱分析、红外光谱测定、碳氢核磁共振分析及元素分析等结果表明,8种姜黄素类似物均具有姜黄素的官能团结构特点,所合成产物均为目标产物.
A':4-溴-2-氟苄基哌啶-4-酮
产率 92%.Mp 28~29℃.1H NMR(400 MHz,DMSO)δ7.28(s,1H,Ar—H),7.26(d,1H,Ar—H),7.20(d,1H,—Ar—H),3.62(s,2H,—CH2),2.75(t,4H,—CH2),2.42(t,5H,—CH2).ESI-MS(m/z):288[M+3H]3+.Chemical Formula,C12H13BrFNO:285.0.
A1:1-(4-溴-2-氟苄基)-3,5-二(4-氟苯亚甲基)哌啶-4-酮
产率92%.Mp 146~148℃.1H NMR(300 MHz,,7.61 ~ 7.24(m,11H,ArH),4.40(s,6H,—CH2—N—CH2—,—CH2—).ESI-MS(m/z):497.7[M]+.Chemical Formula,C26H19BrF3NO:497.06.
A2:1-(4-溴-2-氟苄基)-3,5-二 (4-氯苯亚甲基)哌啶-4-酮
产率 92%.Mp 185~187℃.1H NMR(300 MHz,DMSO)δ7.81(s,2H,Ar—(dt,J=20.5,9.1 Hz,11H,ArH),4.38(d,J=20.3 Hz,6H,—CH2—N—CH2—,—CH2—).ESIMS(m/z):531.5[M+2H]2+.Chemical Formula:C26H19BrCl2FNO:529.0.
A3:1-(4-溴-2-氟苄基)-3,5-二 (4-溴苯亚甲基)哌啶-4-酮
产率92%.Mp 176~178℃.1H NMR(400 MHz,DMSO)δ8.46 ~ 6.82(m,13H,Ar—CH ,ArH),4.43(s,6H,—CH2—N—CH2—,—CH2—).ESI-MS(m/z):621.5[M+H]+.Chemical Formula,C26H19Br3FNO:620.9.
A4:1-(4-溴-2-氟苄基)-3,5-二 (4-羟基苯亚甲基)哌啶-4-酮
产率78%.Mp 181~183℃.1H NMR(400 MHz,DMSO)δ10.35(s,1.81H,Ar—OH),7.77(d,J=15.2 Hz,2H,ArH),7.73 ~7.60(m,2H,ArH),7.49(d,J=8.0 Hz,1H,ArH),7.35(d,J=8.3 Hz,4H,ArH),6.92(d,J=8.3 Hz,4H,,4.66(d,J=83.6 Hz,6H,—CH2—N—CH2—,—CH2—).ESI-MS(m/z):493[M]+.Chemical Formula,C26H21BrF NO3:493.1.A5:1-(4-溴-2-氟苄基)-3,5-二 (3-甲氧基-4-羟基苯亚甲基)哌啶-4-酮
产率98%.Mp 193~195℃.1H NMR(400 MHz,DMSO)δ9.97(s,1.64H,Ar—OH),7.87 ~7.61(m,4H,ArH),7.52(d,J=8.0 Hz,1H,ArH),,6.95(dd,J=19.4,8.3 Hz,4H,ArH),4.57(s,6H,—CH2—N—CH2—,—CH2—),3.85(s,6H,—OCH3).ESI-MS(m/z):553.8[M]+.Chemical Formula,C28H25BrFNO5:553.1.
A6:1-(4-溴-2-氟苄基)-3,5-二 (3,5-甲氧基-4-羟基苯亚甲基)哌啶-4-酮
产率 92%.Mp 176~179℃.1H NMR(400 MHz,DMSO)δ9.03(s,1H,ArOH),7.50(d,J=35.0 Hz,3H,ArH),7.40(dt,J=9.8,82 Hz,2H,ArH),6.76(s,4H,ArH),3.96 ~3.67(m,18H,—CH2—N—CH2—,—OCH3,—CH2—). 13C NMR(101 MHz,DMSO)δ186.05(s),160.40 ~157.26(m),147.81(s),137.41(s),135.53(s),134.15 ~ 132.48(m),130.97(s),127.41(s),124.84(s),123.34 ~122.85(m),122.31 ~121.95(m),118.71(s),118.60 ~ 118.24(m),108.57(s),55.89(s),53.74(s),53.27(s).ESI-MS(m/z):615.52[M+2H]2+.Chemical Formula,C30H29BrFNO7:613.11.
A7:1-(4-溴-2-氟苄基)-3,5-二 (-3,5-氟-4-羟基苯亚甲基)哌啶-4-酮
产率 80%.Mp 211~215℃.1H NMR(400 MHz,DMSO)δ11.10(s,2H,Ar—OH),7.95 ~7.42(m,5.5H,ArH),7.28(d,J=7.7 Hz,3.5H,ArH),4.48(s,6H,—CH2—N—CH2—,—CH2—).ESI-MS(m/z):565.8[M]+.Chemical Formula,C26H17BrF5NO3:565.03.
A8:1-(4-溴-2-氟苄基)-3,5-二 (3,4-羟基苯亚甲基)哌啶-4-酮 产率 92%.Mp 187~189℃.1H NMR(400 MHz,HDMSO)δ9.84(s,2H,Ar—OH),9.35(s,2H,Ar—OH),7.81 ~7.54(m,4H,ArH),7.45(d,J=7.6 Hz,1H,ArH),6.95 ~6.74(m,6H,ArH,),4.49(s,6H,—CH2—N—CH2—,—CH2—).ESI-MS(m/z):525.9[M]+.Chemical Formula,C26H21BrFNO5:525.06.
2.2 合成的化合物抗肿瘤活性
表1数据表明:8个姜黄素类似物中大部分对人前列腺癌细胞PC-3、人体胰腺癌细胞BxPC-3、人结肠癌细胞HT-29和人肺癌细胞H1299均有较强的抑制作用,肿瘤细胞的增殖受到不同程度的抑制.化合物A2、A4、B2、B3和B4等具有显著的强抗肿瘤活性,体外抗肿瘤活性均为姜黄素的40倍以上,说明有望从姜黄素类似物中寻找有潜力的抗癌新药,姜黄素类似物或衍生物的设计合成及其抗肿瘤活性研究具有重要意义.
2.3 合成的姜黄素类似物抗癌活性构效关系
以姜黄素为先导化合物,通过改造姜黄素结构的活性官能团,合成8个姜黄素类似物.其中侧链苯环上的H对称地被—OH或—OCH3取代,并且中间连接桥B区的双羰基结构被单羰基2-氟-4溴-苄基哌啶酮结构取代,生成不同的姜黄素类似物.MTT法检测合成的8种姜黄素类似物和姜黄素的抗癌活性,分别测试其对人前列腺癌细胞PC-3,人体胰腺癌细胞BxPC-3、人结肠癌细胞HT-29和人肺癌细胞H1299作用72 h的半数生长抑制浓度IC50,结果表明姜黄素类似物结构与抗肿瘤活性密切相关.
2.3.1 两侧苯环 3、4、5 位—OH 和—OCH3取代基的影响 从8个化合物的结构和抗肿瘤活性数据可以看出,两侧苯环3、4、5位的—OH或—OCH3能显著提高姜黄素类似物的抗癌活性,苯环上3位—OCH3增多能增强抗癌活性.此结论与文献[19-20]报道一致.A6具有最强的抗肿瘤活性,说明苯环上的—OCH3对姜黄素类似物抗癌活性有重要影响,—OCH3增多能增强抗癌活性.
2.3.2 中间连接桥结构的影响 8个化合物中间连接桥均为单羰基结构,有别于中间连接桥为双羰基结构的姜黄素,但均具有姜黄素的典型结构特点,即两端芳香环通过双键和羰基连接,构成一个对称的共轭大分子体系,因此具备姜黄素所具有的生物活性位点.MTT法测试结果显示,8个化合物抗癌活性均比姜黄素强,其中化合物 A1、A2、A3、A5、A6 和A8等具有显著的强抗肿瘤活性,体外抗肿瘤活性在4种细胞株中均比姜黄素强7~75倍,说明中间连接桥为单羰基结构的大部分姜黄素类似物其抗肿瘤活性比姜黄素强,中间双羰基结构不是必须的.此结论与文献报道相符.
侧链相同时,中间连接桥为2-氟-4溴-苄基哌啶酮与中间连接桥为苄基哌啶酮[16]相比,连接桥为2-氟-4溴-苄基哌啶酮的化合物明显比连接桥为苄基哌啶酮抗癌活性强,这与前期理论计算结果一致,但有个别化合物的抗癌活性反而比苄基哌啶酮弱,这可能是由于中间连接桥为2-氟-4溴-苄基哌啶酮系列的空间位阻比中间连接桥为苄基哌啶酮系列大的缘故造成的.
3 结论
采用氮烷基化、羟基保护、醛酮缩合三步反应合成了8个新型单羰基姜黄素类似物,并运用MTT染色法体外检测所合成的8个化合物对人肺癌细胞H1299,结肠癌细胞HT-29,人体胰腺癌细胞BxPC-3和人前列腺癌细胞PC-3的抗癌活性.半数抑制浓度IC50值结果显示:所合成的8个姜黄素类似物对4种细胞均有较强的抑制作用,其中化合物A6在4种细胞中的半数抑制浓度IC50均在0.65μmol/L以下,抗癌活性比姜黄素提高了40倍以上.
[1]Egan M E,Pearson M,Weiner SA,et al.Curcumin,a major constituent of turmeric,corrects cystic fibrosis defects[J].Science,2004,304:600-602.
[2]Kuttan R,Bhanumathy P,Nirmala K,et al.Potential anticancer activity of turmeric(Curcuma longa)[J].Cancer Letters,1985,29:197-202.
[3]Du B,Jiang L,Xia Q,et al.Synergistic inhibitory effects of curcumin and 5-fluorouracil on the growth of the human colon cancer cell line HT-29[J].Chemotherapy,2006,52(1):23-28.
[4]NotarbartolM,Poma P,PerriD,etal.Antitumor effects of curcumin,alone or in combination with cisplatin or doxorubicin,on human hepatic cancer cells analysis of their possible relationship to changes in NF-κB activation levels and in IAP gene expression[J].Cancer Letters,2005,224(1):53-65.
[5]Chan M M,Fong D,Soprano K J,et al.Inhibition of growth and sensitization to cisplatin-mediated killing of ovarian cancer cells by polyphenolic chemopreventive agents[J].Journal of Cellular Physiology,2003,194(1):63-70.
[6]Koo JY,Kim H J,Jung K O,et al.Curcumin inhibits the growth of AGS human gastric carcinoma cells in vitro and shows synergism with 5-fluorouracil[J].Journal of Medicinal Food,2004,7(2):117-121.
[7]Anand P,Kunnumakkara A B,Newman R A,etal.Bioavailability of curcumin:problems and promises[J].Molecular Pharmaceutics,2007,4:807.
[8]Thomas S L,Zhao J,Li Z,et al.Activation of the p38 pathway by a novel monoketone curcumin analog,EF24,suggests a potential combination strategy[J].Biochemical Pharmacology,2010,80:1309-1316.
[9]Thomas S L,Zhao J,Li Z,et al.Activation of the p38 pathway by a novel monoketone curcumin analog,EF24,suggests a potential combination strategy[J].Biochem.Pharmacol.,2010,80:1309-1316.
[10]王玉玲,吴振,张喜轩.姜黄素类化合物的抗肿瘤活性[J].中国医科大学学报,2006,5(4):380-381.Wang Y L,Wu Z,Zhang X X.Anti-tumor activity of curcumin-related compounds[J].Journal of China Medical University,2006,5(4):380-381.
[11]Fuchs JR,Pandit B,Bhasin D,et al.Structure-activity relationship studies of curcumin-related compounds[J].Bioorganic& Medicinal Chemistry Letters,2009,19(7):2065-2089.
[12]Adams B K,Cai J,Armstrong J,et al.EF24,a novel synthetic curcumin analog,induces apoptosis in cancer cells via a redox-dependent mechanim[J].Anticancer Drugs,2005,16,263-275.
[13]赵承光,杨菊,梁栋楼,等.新型含氟姜黄素类似物的合成、晶体结构及抗肿瘤活性,有机化学,2010,30(2):289-294.Zhao C G,Yang J,Liang D L,et al.Synthesis,crystal and Anti-tumor properties of fluorine-containing curcumin analogues[J].Chinese Journal of Organic Chemistry,2010,30(2):289-294.
[14]Du ZY,Liu R R,ShaoW Y,etal.a-Glucosidase inhibition of natural curcuminoids and curcumin analogs[J].European Journal ofMedicinal Chemistry,2006,41:213-218.
[15]Wei X X,Du Z Y,Zheng X,etal.Synthesis and evaluation of curcumin-related compounds for anticancer activity[J].European Journal of Medicinal Chemistry,2012,53:235-245.
[16]Zhou D Y,Zhang K,Conney A H,et al.Synthesis and evaluation of curcumin-related compounds containing benzyl piperidone for their effects on human cancer cells[J].Chemical& Pharmaceutical Bulletin,2013,61(11):1-7.
[17]Bull SD,Davies SG,Fenton G,et al.Chemoselective debenzylation of N-benzyl tertiary amines with ceric ammonium nitrate[J].Journal of the Chemical Society,Perkin Transactions 1,2000,(22):3765-3774.
[18]Kumar R S,Rajesh SM,Perumal S,et al.1,3-Dipolar cycloaddition of nitrile oxides to(R)-1-(1-phenylethyl)-3,5-bis[(E)-arylmethylidene]tetrahydro-4(1H)-pyridi n-ones:synthesis and antimycobacterial evaluation of novel enantiomerically pure di-and trispiroheterocycles[J].Tetrahedron:Asymmetry,2010,21(11):1315-1327.
[19]Dinkova-Kostova A T,Talalay P.Relation of structure of curcumin analogs to their potencies as inducers of Phase 2 detoxi?cation enzymes[J].Carcinogenesis,1999,20:9111-9114.
[20]James R F,Bulbul P,Deepak B,etal.Structure-activity relationship studies of curcumin-related compounds[J].Bioorganic& Medical Chemistry Letters,2009,19:2065-2069.
