手性分子识别与分离研究进展
2014-08-16章伟光郑盛润
林 纯,章伟光,2*,范 军*,郑盛润,殷 霞
(1.华南师范大学化学与环境学院,广州510006;2.广州研创生物技术发展有限公司,广州510663)
手性是自然界特别是生物体的本质属性,作为生命活动重要基础的生物大分子和许多作用于受体的活性物质均具有手性特征,如酶、载体、受体、血浆蛋白和多糖等.对映异构体在生物活性、生理活性和药理活性等方面存在较大差异甚至可能完全相反的作用,因此获得单一的对映异构体对生理学和药理学的研究有着非常重要的意义[1].近年来,有关手性识别与分离的技术发展迅速,其中色谱法、传感器法和光谱法等具有适用性好、应用范围广、灵敏度高、检测速度快等优点,在分离识别和纯化手性化合物中受到研究者的极大关注.结合本课题组的研究,主要对色谱法、传感器法和光谱法等在手性分离和识别的研究现状进行综述.
1 色谱法
色谱法可满足各种条件下对映体拆分和测定的要求,能够快速对手性样品进行定性、定量分析和制备拆分.目前,高效液相色谱、气相色谱、超临界流体色谱、模拟移动床色谱和毛细管电泳等在手性研究中得到了广泛应用.其中,高效液相色谱法(HPLC)进行手性药物对映体的光学拆分已成为药学研究中的一大热点,开发一些新型、具有不对称中心的手性固定相成为发展手性色谱技术的前沿领域之一.在手性固定相材料中,手性选择剂和手性分子间形成非对映异构体络合物,但由于不同对映体分子间存在空间结构的差异,直接影响两者的结合和络合物的稳定性.根据这些差异有望实现对手性底物的拆分[2].以环糊精衍生物、多糖衍生物和蛋白质等为手性选择剂的手性固定相材料备受研究者的关注,它们对许多手性药物对映体表现出良好的分离性能,已有许多填充手性固定相的色谱柱实现商品化,广泛应用在制药工业、化学品和食品等行业中.下文针对新型环糊精手性固定相、多糖手性固定相和蛋白质手性分离材料的制备及在拆分手性对映体方面的研究进行综述.
1.1 环糊精类手性固定相
β-环糊精由7个葡萄糖单元通过α-1,4糖苷键连接形成,内部有一个疏水性手性空腔,可与有机物、无机物及生物分子形成主客体包合物.1965年,Solms等[3]首先开发了适用于液相色谱标准粒径的环糊精聚合物固定相.通过化学修饰可改变β-环糊精的内腔深度和氢键作用位点,引入静电作用和ππ作用位点,满足识别不同类型和结构的底物要求,提高β-环糊精衍生物的手性识别能力.环糊精手性固定相在巴比妥酸、阻断剂、镇静安眠剂、抗组胺剂、生物碱、胡萝卜素、二肽、多肽、氨基酸、芳香醇、黄酮类等的分析检测和制备方面得到很好的应用[4].
目前,研究主要集中在开发环糊精与基质材料间新型键合方式[5-6]和探讨衍生基团对手性固定相分离能力的影响[7-8].环糊精(衍生物)与硅胶间通过酰胺键、氨酯键和醚键等形成手性固定相,但这些键合臂存在易水解和稳定性差的不足;同时环糊精与硅胶间键合位点不确定,手性固定相结构不明确,反应的重现性差[9].针对这些问题,研究者应用施陶丁格(Staudinger)反应或点击化学(Click Chemistry)反应来开发一些新型环糊精手性固定相[6-7].结合本课题组的研究,下面针对它们在制备环糊精手性固定相的应用现状进行介绍.
1.1.1 施陶丁格反应 在含叠氮基的手性选择剂和硅胶基质发生施陶丁格反应后,新生成的脲键将两者连接,与此前通过酰胺键、氨酯键和醚键等方式形成的材料[9]相比,脲键连接的环糊精固定相材料在正相、极性相和含水比例较高的反相等条件中稳定性高,对手性底物的分离性能好,同时发生施陶丁格反应的反应点确定、条件温和、重现性好[10].
本课题组采用施陶丁格反应将单(6A-叠氮-6A-脱氧)-p-氯苯氨基甲酰化β-环糊精键合在硅胶表面,得到一种新的单脲键键合β-环糊精手性固定相(SCDP)[11](图1A),它对哌嗪衍生物对映体表现出良好的分离性能;应用SCDP半制备柱(250×10.0 mm ID)对氧氟沙星实现半制备分离[12],氧氟沙星对映体的纯度超过98%;探讨基质粒径(3、5、10 μm)和孔径(10、30、50 nm)等对固定相分离性能的影响[13].结果表明,10 nm~3μm环糊精手性固定相对底物表现出了最佳的分离性能,硅胶粒径增大导致色谱柱的理论塔板数和手性拆分能力降低;随着孔径增大,底物在色谱柱上的保留时间变短,分离度下降,这意味着在大孔填料上,分析物与手性固定相间不能充分接触就被冲出色谱柱,分离效果差.
此外,还改变苯异氰酸酯上的取代基(如H和CH3等)制备得到2种新的单脲键环糊精手性固定相(SPCP和SDMP等),探讨了取代基对分离性能的影响(图1A)[8].芳环上的氢原子被氯原子取代后,芳环π-电子密度降低而显π-酸性,而甲基取代使其π-电子密度升高.研究表明,π-酸性的手性固定相对π-碱的底物的分离效果更好,反之亦然,同属π-酸或π-碱性的手性底物和固定相之间作用较差.
手性选择剂和基质间的多键键合可提高手性固定相材料的耐酸和耐水性能[9].本课题组以七取代(6-叠氮-6-脱氧)-(2,3-p-氯苯氨基甲酰化)β-环糊精和硅胶反应得到一种新的多脲键β-环糊精手性固定相材料(MCDP,图 1B)[7],在极性有机相模式下对手性锇苯配合物进行制备拆分,对映体的纯度在98%以上(图2).锇苯阳离子和流动相中NO-3-环糊精形成的离子对增强了环糊精疏水性空腔对底物的包合作用,促进了手性固定相对底物的分离.同时,结合圆二色谱及理论计算确定手性锇苯配合物的绝对构型,首先被洗脱的为Δ-对映体,而Λ-对映体与固定相间作用要强于Δ-异构体.这是首例运用环糊精手性固定相拆分惟手性金属中心(Chiralonly-at-Metal)锇苯配合物的报道.手性金属苯配合物具有独特的配位结构、特殊的催化活性、磁力敏感性及分子识别能力在生物无机化学、不对称催化和超分子化学等领域具有良好的应用前景[14-15].这种高效的色谱分离方法为研究者获得单一对映体成为可能.
1.1.2 点击化学反应 点击化学(Click Chemistry)反应是指通过小单元的拼接快速完成化学合成的方法,如Cu(I)催化的端炔基和叠氮基间发生点击反应形成1,2,3-三唑.Wang 等[16-17]相继报道了以天然环糊精和苯氨基甲酰化环糊精等为手性选择剂的点击式环糊精手性固定相,它们在酸性和碱性介质中稳定性好,键合臂和键合位点对手性固定相的拆分性能具有很大的影响.通过点击化学反应,本课题组得到一种新的三唑键合型环糊精手性固定相SCBE(图 1C)[15],它对 4-苯基-1,3-口恶唑烷-2-硫酮、芳香醇、黄酮类化合物和安息香等表现出良好的分离效果,探讨了柱温、流动相pH值和醇含量等条件对手性分离的影响.

图 1 不同键合方式的 β-环糊精手性固定相的合成路线图[7,8,11,17]Figure 1 Synthetic routes of β-CD CSPs with different linkages[7,8,11,17]

图2 MCDP手性固定相对锇苯手性配合物的拆分[7]Figure 2 Enantioseparation of an osmabenzene chiral complex on MCDP[7]
1.2 多糖手性固定相
在多糖中,一些葡萄糖单元间通过氢键形成不对称的单螺旋结构链,相邻的螺旋结构链排列形成有序的超分子手性区域,因而多糖分子具有大量的手性活性点,表现出优良的手性识别性能[18].在多糖骨架上引入取代基(如苯甲酸酯基和苯氨基甲酸酯基等)很好地增强手性固定相的手性选择性[19].常用的多糖手性固定相分为涂敷型和键合型.其中,涂敷型材料在HPLC手性分离中应用较多,但在一些非常规溶剂(如四氢呋喃、氯仿和丙酮等)中,多糖衍生物容易溶胀或溶解,其应用范围受到一些限制;而键合型多糖固定相在各种流动相条件下稳定性好,在制备色谱中应用潜力巨大,成为当前多糖固定相研究的主要内容之一[20].
本课题组采用施陶丁格反应将含叠氮的多糖衍生物键合到硅胶基质表面,得到一系列新型键合型多糖手性固定相材料[21-24](表1).键合型(p-氯苯氨基甲酰化)纤维素手性固定相在正相和反相条件下拆分30种手性底物[21],探讨了酸/碱添加剂对手性分离性能的影响[22].结果表明,手性固定相对底物的包合作用、π-π堆积、氢键和空间位阻等都是手性拆分的主要作用力;在流动相中加入酸/碱添加剂后,手性固定相对底物的分离性能加强,酸性分析物洗脱加快,而加入二乙胺则使碱性分析物的保留变强.并与商品柱Chiralcel OF(涂敷型手性柱)的分离性能进行对比.尽管它们拥有相同的衍生基团(即p-氯苯氨基甲酰基)和纤维素骨架,但其分离性能截然不同,这可能归因于手性选择剂和硅胶间结合方式不同.
本课题组还得到3种新的脲键键合型多糖手性固定相,即ChiralCN IA、ChiralCN IB和ChiralCN IC(表1)[23-24].键合型多糖手性固定相(ChiralCN IA和IB)和具有相同衍生基团的涂敷型纤维素手性固定相的分离性能具有一定的互补性[23],如异丙甲草胺和紫杉醇侧链在2种纤维素手性固定相上都无法分离,但在ChiralCN IA上分离度(Rs)分别为1.78和1.63;手性固定相ChiralCN IC对一些质子泵抑制剂和芴甲氧羰基(Fmoc)-氨基酸衍生物表现出良好的分离性能.在拆分一系列Fmoc-氨基酸衍生物时,意外发现了由纤维素骨架上衍生基团变化引起的对映体洗脱反转现象(图3)[24].对映体洗脱反转在高效液相色谱的手性分离中是一个非常有趣的现象,改变手性选择剂的种类及固定方式[25-27]、柱温[26]、流动相 pH[27-28]、有机添加剂的种类和比例[26-28]等可能引起对映体洗脱反转.

表1 常见的脲键键合型多糖手性固定相Table 1 Summary of polysaccharide chiral stationary phases with urea linkage

图3 Fmoc-丙氨酸(A)和Fmoc-O-叔丁基-谷氨酸(B)在ChiralCN IC和ChiralCN IB柱上的色谱图[24]Figure 3 Chromatograms of Fmoc-alanine(A)and 5-tert-tutyl Fmoc-gluta mute(B)on the ChiralCN IB and ChiralCN IC CSPs,respectively.(mobile phase:Hex/EtOH/TFA=90/10/0.1)[24]
1.3 蛋白质类手性固定相
在蛋白质中,手性亚单位L-氨基酸能特异性地结合手性分子,常作为手性固定相使用,其中对牛血清白蛋白(BSA)[30-31]、人血清白蛋白[32]、α-酸性糖蛋白[33]、卵粘蛋白[34]、纤维二糖水解酶和胃蛋白酶等研究较多.
本课题组采用羰基咪唑法键合BSA到硅胶上得到键合 BSA 生物手性柱(ChiralCN BSA)[30-31],在反相体系下拆分色氨酸、匹多莫德、4-苯基-1,3-口恶唑烷-2-硫酮、N-(2,4-二硝基苯基)氨基酸衍生物、甘草素、安息香和氧氟沙星等底物,考察了流动相pH值、离子强度、有机改性剂的比例、进样浓度和柱温等条件对分离性能的影响.由于流动相pH改变会影响到BSA的表面电荷,影响底物分子和BSA间的静电作用,因而pH是影响蛋白质手性固定相手性拆分性能的重要因素之一.另一方面,有机修饰剂(如甲醇、乙腈等)会改变BSA的空间构型和立体环境,对BSA的拆分能力产生影响.在拆分N-(2,4-二硝基苯基)脯氨酸(DNP-pro)和N-(2,4-二硝基苯基)-丝氨酸(DNP-ser)时,也意外发现了由流动相中乙腈含量、pH值和醇的种类改变引起的手性识别反转现象(图4),同时乙腈和pH值存在协同效应,手性识别反转区域随乙腈浓度变化而变化[28].
1.4 其他类型手性固定相
Pirkle型、大环类(冠醚/抗生素)、分子印迹和配体交换色谱手性固定相等均有各自的优势,在手性分离中占据着不可替代的地位[35].此外,手性多孔金属有机框架材料(MOFs)具有独特的空间结构和手性孔道,在高效液相色谱[36]和气相色谱手性分离中[37]表现出良好的应用前景.本课题组以管状结构的MOF-CJ3及MOF-TZn材料作为气相色谱固定相[38].研究其对芳环衍生物的位置异构体及烷烃同系物等的分离性能,寻求配合物结构与分离性能的构效关系.
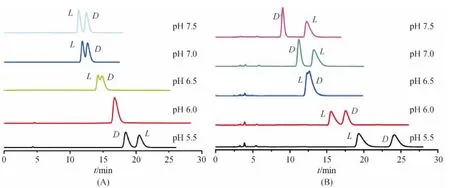
图4 DNP-ser(A)和DNP-pro(B)在BSA柱上的色谱图[28]Figure 4 Chromatograms of DNP-ser(A)and DNP-pro(B)on the BSA chiral column[28]
2 手性传感器识别法
手性传感器识别法具有简单快捷、高效灵敏和选择性高的特点.电化学传感器主要通过主体选择性键合客体分子引起传感器的电信号变化而实现手性识别[39];荧光传感器基于对映体分子和手性选择剂形成缔合物的荧光差异来实现识别[40].在压电传感器中,手性选择膜镀在石英晶体上,当手性分子与手性膜发生作用时,会引起石英晶体的质量和振动频率改变,故称为石英晶体微天平(Quartz Crystal Microbalance,QCM)[41-42].QCM 技术始于 20 世纪60年代初期,因具有灵敏度高、检测限低(达到纳克级)、快速、容易实现在线分析检测的特点,在手性化合物的识别和检测方面得到很好的应用.
2.1 气相QCM传感器
1997 年,Bodenhöfer等[43]首先在 Nature 报道QCM气敏传感器手性识别的研究,掀起了一股研究热潮.QCM传感器感应手性化合物的关键条件是在石英晶体上构建具有手性识别位点的手性选择剂.研究者选择 L-苯丙氨酸[44]、杯芳烃类化合物[45]、环糊精衍生物[46]和血清蛋白[41-42]等作为手性选择剂,用于开发QCM手性传感器.
本课题组将单(6A-ω-巯乙基氨基)-全苯氨基甲酰基环糊精自组装到石英晶片表面得到环糊精衍生物QCM传感器[46],在气相条件下对 R,S-(±)-(3-甲氧苯基)乙胺实现手性识别,QCM识别因子为1.33;还将人、牛、羊和兔血清蛋白(HSA/BSA/GSA/RbSA)等以自组装单分子膜技术固定到石英晶体表面得到一系列生物蛋白手性传感器[41-42](图5).这些生物手性传感器对手性化合物表现出不同的手性识别能力和选择性.如R,S-(3-甲氧基苯基)乙胺和R,S-(4-甲氧基苯基)乙胺在BSA传感器的QCM识别因子大于HSA传感器,而HSA传感器对R,S-四氢萘胺、R,S-辛醇和 R,S-乳酸甲酯的选择性高于BSA传感器.

图5 自组装QCM系统示意图[41]Figure 5 A schematic view of the self-assembled QCM system[41]
2.2 液相QCM传感器
20世纪80年代开始发展了液相介质的QCM传感器.Inagaki等[47]报道根据QCM传感器与手性化合物的作用结果预测手性化合物在HPLC柱上的分离趋势和效果.
近年来,流动注射分析(FIA)-QCM传感器可实时、动态和连续监测生物分子与传感器间的相互作用.Liu等[48]将HSA结合到石英晶片表面,研究其在液相条件下对抗体的识别作用.本课题组[49]采用自组装FIA-QCM系统研究了BSA和GSA对扁桃酸的手性识别作用,其中血清蛋白与R-扁桃酸作用强于与S-对映体的作用力;从识别因子看,GSA对扁桃酸的手性识别能力优于BSA.
3 光谱法
采用紫外 -可见光谱[50]、荧光光谱[51]、红外光谱[52]和圆二色光谱法[53]等考察手性选择剂和手性底物的混合溶液在光谱上的细微变化,辅助以化学计量学分析或其它光谱联用也可用于手性识别研究.
在开展QCM生物传感器手性识别研究的同时,分别采用UV光谱和荧光光谱的方法深入研究HSA、BSA、GSA和RbSA与手性分子间的手性识别机理[41-42].在血清蛋白溶液中,加入四氢萘胺、(4-甲氧基苯基)乙胺和(3-甲氧基苯基)乙胺后,紫外吸收峰蓝移,说明加入这些底物分子会使血清蛋白的疏水作用减弱,底物与血清蛋白间通过疏水作用结合;而加入2-辛醇和乳酸甲酯后,血清蛋白的紫外吸收峰强度明显降低,归因于底物分子与血清蛋白上氨基酸残基形成氢键引起振动减弱.在荧光光谱上,血清蛋白的内源性荧光猝灭,而手性底物的荧光强度增强,可解释为手性分子与蛋白质间形成静态复合物,底物进入血清蛋白的疏水空腔,改变了血清蛋白的内部微环境,从而对血清蛋白的荧光行为产生影响.同时,血清蛋白的紫外识别因子(αUV)、荧光识别因子(αFL)与QCM识别因子(αQCM)的变化趋势一致.此外,对(4-甲氧基苯基)乙胺、(3-甲氧基苯基)乙胺与血清蛋白的混合体系进行同步荧光光谱和荧光寿命研究[54],了解血清蛋白内部疏水微环境变化及能量转移过程,这为探讨手性药物分子对生命体系的作用机理提供理论基础.
4 展望
手性与生命过程息息相关,如手性药物的药效和作用机制、生化反应过程的立体选择性等和物质的立体构型间联系密切.自第一批商品化手性柱成功上市以来,高效液相色谱手性分离技术经过近30年的发展渐趋成熟,在手性药物的分析检测和制备拆分中占据了极为重要的位置.然而,随着手性药物、生命科学和材料科学等的迅速发展,对手性识别和分离的研究提出了新的要求.在复杂结构的手性药物的开发和生产中,不对称合成和手性拆分串联应用、新型手性固定相材料的设计、新的手性分离制备技术的开展(如模拟移动床色谱和超临界流体色谱技术等)必将引起研究者的更大关注.
[1]Berthod A.Chiral recognition mechanisms[J].Analytical Chemistry,2006,78(7):2093-2099.
[2]Lämmerhofer M.Chiral recognition by enantioselective liquid chromatography:Mechanisms and modern chiral stationary phases[J].Journal of Chromatography A,2010,1217(6):814-856.
[3]Solms J,Egli R H.Harzemit einschlus shohlräu men voncyclo dextrin-struktur[J]. Helvetica Chimica Acta,1965,48(6):1225-1228.
[4]Xiao Y,Ng SC,Tan T T Y,et al.Recent development of cyclodextrin chiral stationary phases and their applications in chromatography[J].Journal of Chromatography A,2012,1269:52-68.
[5]Zhang Z B,Wu M H,Wu R A,et al.Preparation of perphenylcarbamoylatedβ-cyclodextrin-silica hybrid monolithic column with“one-pot”approach for enantiose paration by capillary liquid chromatography[J].Analytical Chemistry,2011,83(9):3616-3622.
[6]Yao X B,Tan T TY,Wang Y.Thiol-ene click chemistry derived cationic cyclodextrin chiral stationary phase and its enhanced separation performance in liquid chromatography[J].Journal of Chromatography A,2014,1326:80-88.
[7]Lin C,Liu W N,Fan J,et al.Synthesis of a novel cyclodextrin-derived chiral stationary phase withmultiple urea linkages and enantiose paration toward chiral osmabenzene complex[J].Journal of Chromatography A,2013,1283:68-74.
[8]Lin C,LuoW J,Zhang S,etal.Phenylcarbamoylated β-CD:π-Acidic and π-basic chiral selectors for HPLC[J].Journal of Separation Science,2010,33(11):1558-1562.
[9]Muderawan IW,Ong T T,Ng SC.Urea bonded cyclodextrin derivatives onto silica for chiral HPLC[J].Journal of Separation Science,2006,29(12):1849-1871.
[10]Zhang L F,Wong Y C,Chen L,et al.A facile immobilization approach for perfunctionalised cyclodextrin onto silica via the Staudinger reaction[J].Tetrahedron Letters,1999,40(9):1815-1818.
[11]Zhang ZB,ZhangW G,LuoW J,et al.Preparation and enantioseparation characteristics ofa novel chiral stationary phase based onmono(6A-azido-6A-deoxy)-per(p-chlorophenylcarba moylated)β-cyclodextrin[J].Journal of Chromatography A,2008,1213(2):162-168.
[12]Fang Z L,Guo Z Y,Qin Q,et al.Semi-preparative enantiomeric separation of of loxacin by HPLC[J].Journal of Chromatographic Science,2013,51(2):133-137.
[13]Qin Q,Zhang S,ZhangW G,etal.The impactof silica gel pore and particle sizes on HPLC column efficiency and resolution for an immobilized,cyclodextrin-based,chiral stationary phase[J].Journal of Separation Science,2010,33(17/18):2582-2589.
[14]Wang TD,Li SH,Zhang H,etal.Annulation ofmetallabenzenes:From osmabenzene to osmabenzothiazole to osmabenzoxazole[J].Angewandte Chemie-International Edition,2009,48(35):6453-6456.
[15]Fan Q,Zhang K,Tian LW,et al.Preparation and enantioseparation of a new click derivedβ-cyclodextrin chiral stationary phase[J].Journal of Chromatographic Science,2014,doi:10.1093/chromsci/bmt060.
[16]Wang Y,Xiao Y,Tan T T Y,et al.Click chemistry for facile immobilization of cyclodextrin derivatives onto silica as chiral stationary phases[J].Tetrahedron Letters,2008,49(35):5190-5191.
[17]Wang Y,Young D J,Tan T T Y,et al.“Click”preparation of hindered cyclodextrin chiral stationary phases and their efficient resolution in high performance liquid chromatography[J].Journal of Chromatography A,2010,1217(50):7878-7883.
[18]Francotte E,Wolf R M,Lohmann D.Chromatographic resolution of racemates on chiral stationary phases:I:Influence of the supramolecular structure of cellulose triacetate[J].Journal of Chromatography A,1985,347:25-37.
[19]Okamoto Y,Yashima E.Polysaccharide derivatives for chromatographic separation of enantiomers[J].Angewandte Chemie-International Edition,1998,37(8):1020-1043.
[20]Shen J,Liu SY,Li PF,et al.Controlled synthesis and chiral recognition of immobilized cellulose and amylose tris(cyclohexylcarbamate)s/3-(triethoxysilyl)propylcarba mates as chiral packing materials for high-performance liquid chromatography[J].Journal of Chromatography A,2012,1246:137-144.
[21]Peng G M,Wu SQ,Fang Z L,et al.Preparation and chiral separation of a novel immobilized cellulose-based chiral stationary phase in high-performance liquid chromatography[J].Journal of Chromatographic Science,2012,50(6):516-222.
[22]Peng GM,Wu SQ,ZhangW G,etal.Cellulose 2,3-di(p-chlorophenylcarba mate)bonded to silica gel for resolution of enantiomers[J].Analytical Sciences,2013,29(6):637-642.
[23]Tan Y,Fan J,Lin C,etal.Synthesis and enantioseparation behaviors of novel immobilized 3,5-dimethylphenylcarba moylated polysaccharide chiral stationary phases[J].Journal of Separation Science,2014,37(5):488-494.
[24]涂鸿盛,范军,谭艺,等.新型键合型纤维素手性固定相的制备及拆分性能[J].色谱,2014,doi:10.3724/sp.J.1123.2014.01022.Tu H S,Fan J,Tan Y,et al.Preparation of a new immobilized cellulose-based chiral stationary phases and its enantioseparation behaviors[J].Chinese Journal of Chromatography,2014,doi:10.3724/sp.J.1123.2014.01022.
[25]Pittler E,Schmid M G.Enantioseparation of dansyl amino acids by HPLC on a monolithic column dynamically coated with a vancomycin derivative[J].Biomedical Chromatography,2010,24(11):1213-1219.
[26]Matarashvili I,Chankvetadze L,Fanali S,et al.HPLC separation of enantiomers of chiral arylpropionic acid derivatives using polysaccharide-based chiral columns and normal-phase eluents with emphasis on elution order[J].Journal of Separation Science,2013,36(1):140-147.
[27]Zhou L L,Mao B,Ge Z H.Comparative study of immobilizedα1 acid glycoprotein and ovo mucoid protein stationary phases for the enantiomeric separation of pharmaceutical compounds[J].Journal of Pharmaceutical and Biomedical Analysis,2008,46(5):898-906.
[28]Wang Q Y,Xiong Y,Lu B,etal.Reversal of elution order of N-(2,4-dinitrophenyl)-proline and N-(2,4-dinitrophenyl)-serine in HPLC by BSA chiral stationary phase[J].Journal of Separation Science,2013,36(8):1343-1348.
[29]Zhang S,Ong T T,Ng SC,et al.Chemical immobilization of azido cellulose phenylcarba mate onto silica gel via Staudinger reaction and its application as a chiral stationary phase for HPLC[J].Tetrahedron Letters,2007,48(31):5487-5490.
[30]Wang Q Y,Xiong Y J,Lu B Z,et al.Effect of chromatographic conditions on enantioseparation of bovine serum albumin chiral stationary phase in HPLC and thermodynamic studies[J].Chirality,2013,25(9):487-492.
[31]熊雅进,苏文翠,章伟光,等.流动相的pH值和离子强度对牛血清蛋白高效液相色谱手性柱分离性能的影响[J].分析化学,2012,40(1):89-94.Xiong Y J,Su W C,Zhang W G,et al.Effect of ionicstrength and pH value in mobile phase on enantioseparation of BSA high performance liquid chromatography column[J].Chinese Journal Analytical Chemistry,2012,40(1):89-94.
[32]Yao CH,Qi L,Qiao J,et al.High-performance affinity monolith chromatography for chiral separation and determination of enzyme kinetic constants[J].Talanta,2010,82(4):1332-1337.
[33]Michishita T,Franco P,Zhang T.New approaches of LC-MS compatiblemethod developmentonα1-acid glycoprotein-based stationary phase for resolution of enantiomers by HPLC[J].Journal of Separation Science,2010,33(23/24):3627-3637.
[34]Liu K,Zhong D F,Chen X Y.Enantioselective determination of doxazosin in human plasma by liquid chromatography-tandem mass spectrometry using ovomucoid chiral stationary phase[J].Journal of Chromatography B,2010,878(26):2415-2420.
[35]Ward T J,Ward K D.Chiral separations:A review of current topics and trends[J].Analytical Chemistry,2012,84(2):626-635.
[36]Tanaka K,Muraoka T,Hirayama D,et al.Highly efficient chromatographic resolution of sulfoxides using a new homochiral MOF-silica composite[J].Chemical Communications,2012,48(68):8577-8579.
[37]Xie SM,Zhang Z J,Wang Z Y,et al.Chiralmetalorganic frameworks for high-resolution gas chromatographic separations[J].Journal of the American Chemical Society,2011,133(31):11892-11895.
[38]Fang Z L,Zheng SR,Tan JB,et al.Tubularmetal-organic framework-based capillary gas chromatography column for separation of alkanes and aromatic positional isomers[J].Journal of Chromatography A,2013,1285:132-138.
[39]Huan SY,Shen G L,Yu R Q.Enantioselective recognition of amino acid by differential pulse voltammetry in molecularly imprinted monolayers assembled on Au electrodes[J].Electroanalysis,2004,16(12):1019-1023.
[40]Zhao JZ,Fyles TM,James TD.Chiral binol-bisboronic acid as fluorescence sensor for sugar acids[J].Angewandte Chemie-International Edition,2004,43(26):3461-3464.
[41]Su W C,Zhang W G,Zhang S,et al.A novel strategy for rapid real-time chiral discrimination of enantiomers using serum albumin functionalized QCM biosensor[J].Biosensors and Bioelectronics,2009,25(2):488-492.
[42]Chen W J,Zhang S,Su W C,etal.A new biosensor for chiral recognition using goat and rabbit serum albumin self-assembled QCM[J].Chirality,2012,24(10):804-809.
[43]Bodenhöfer K,Hierlemann A,Seemann J,et al.Chiral discrimination using piezoelectric and optical gas sensors[J].Nature,1997,387(6633):577-580.
[44]Guo H S,Kim JM,Chang SM,etal.Chiral recognition ofmandelic acid by L-phenylalanine-modified sensor using quartz crystalmicrobalance[J].Biosensors and Bioelectronics,2009,24(9):2931-2934.
[45]GuoW,Wang J,Wang C,etal.Design,synthesis,and enantiomeric recognition of dicyclodipeptide-bearing calix[4]arenes:A promising family for chiral gas sensor coatings[J].Tetrahedron Letters,2002,43(32):5665-5667.
[46]Luo M L,ZhangW G,Zhang S,etal.Self-assembly and chiral recognition of quartz crystal microbalance chiral sensor[J].Chirality,2010,22(4):411-415.
[47]Inagaki S,Min JZ,Toyòoka T.Prediction for the separation efficiency of a pair of enantiomers during chiral high-performance liquid chromatography using a quartz crystal microbalance[J].Analytical Chemistry,2008,80(5):1824-1828.
[48]Liu Y C,Wang C M,Hsiung K P.Comparison of different protein immobilization methods on quartz crystal microbalance surface in flow injection immunoassay[J].Analytical Biochemistry,2001,299(2):130-135.
[49]洪涛,王秋云,范军,等.流动注射-石英晶体微天平中血清蛋白对扁桃酸的手性识别[J].应用化学,2013,30(9):1096-1098.Hong T,Wang Q Y,Fan J,et al.Chiral recognition of mandelic acid with bovine and goat serum albumins by flow injection analysis-quartz crystal microbalance[J].Chinese Journal of Applied Chemistry,2013,30(9):1096-1098.
[50]Busch KW,Swamidoss IM,Fakayode SO,et al.Determination of the enantiomeric composition ofguestmolecules by chemometric analysis of the UV-visible spectra of cyclodextrin guest-host complexes[J].Journal of the A-merican Chemical Society,2003,125(7):1690-1691.
[51]Fakayode SO,Busch M A,Bellert D J,et al.Determination of the enantiomeric composition of phenylalanine samples by chemometric analysis of the fluorescence spectra of cyclodextrin guest-host complexes[J].Analyst,2005,130(2):233-241.
[52]Tran CD,Oliveira D,Grishko V I.Determination of enantiomeric compositions of pharmaceutical products by near-infrared spectrometry[J].Analytical Biochemistry,2004,325(2):206-214.
[53]Guo CN,Shah R D,Dukor R K,etal.Determination of enantiomeric excess in samples of chiralmolecules using fourier transform vibrational circular dichroism spectroscopy:simulation of real-time reactionmonitoring[J].Analytical Chemistry,2004,76(23):6956-6966.
[54]Fang Z L,Su W C,Zhang W G,et al.Chiral discrimination and interaction mechanism between enantiomers and serum albumins[J].Journal of Molecular Recognition,2013,26(4):161-164.
